解题方法
1 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是________ (填化学式),过氧化钠(Na2O2)中氧元素化合价为_____ 。(填数字)
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_________________ 。
②每生成1mol FeO42-转移___ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为_____ mol。
(3)配平下面化学方程式,回答下列问题:____ C +K2Cr2O7+H2SO4=K2SO4+CO2↑+Cr2(SO4)3+H2O。
①H2SO4在上述反应中表现出来的性质是(填选项编号)______ 。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_____ L。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1mol FeO42-转移
(3)配平下面化学方程式,回答下列问题:
①H2SO4在上述反应中表现出来的性质是(填选项编号)
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
解题方法
2 . 氯化亚硝酰(NOCl,沸点为-5.5℃)是有机合成中的重要试剂,为黄色气体,具有刺鼻恶臭味,遇水反应,有多种方法制备氯化亚硝酰。已知:HNO2既有氧化性又有还原性,AgNO2微溶于水,溶于硝酸:AgNO2+HNO3=AgNO3+HNO2。
(1)将5g在300℃下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002molNO2。反应12~36min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为_ 。氯化钾需要“干燥”的原因是__ 。
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为__ 。
②干燥管中盛放的试剂为_ 。
③生成NOCl的化学方程式为__ 。
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
(1)将5g在300℃下干燥了3h并研细的KCl粉末装入50mL带有接头及抽真空用活塞的玻璃容器内。将容器尽量减压,在减压条件下通入0.002molNO2。反应12~36min即可完成,红棕色的NO2消失,出现黄色的氯化亚硝酰,同时还得到一种盐,该盐的化学式为
(2)实验室可由氯气与一氧化氮在常温常压下合成氯化亚硝酰,装置如图所示。

①仪器a的名称为
②干燥管中盛放的试剂为
③生成NOCl的化学方程式为
(3)为验证NOCl与H2O反应后的溶液中存在Cl-和HNO2,设计如下实验步骤,完成下列表格。
| 步骤 | 实验现象或反应的化学方程式 |
| ①取5mL仪器a中产品,加入盛有水的烧杯中,充分反应 | NOCl与H2O反应的化学方程式为 |
| ②向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,再加入足量稀硝酸 | 加入稀硝酸后,实验现象为 |
| ③向步骤②烧杯中滴加酸性KMnO4溶液 | 实验现象为 |
您最近一年使用:0次
2020-05-09更新
|
175次组卷
|
2卷引用:2020届山东省部分学校联考模拟试题(化学)
解题方法
3 . 氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系: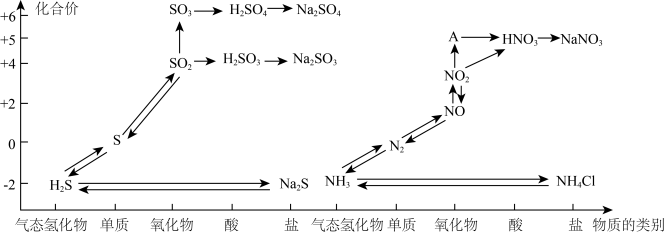
(1)根据A对应的化合价和物质类别,A为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有____________ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择________ ,反应的离子方程式为______________ 。
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:_______________ 。
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为_____ 。
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式_______ 。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为____________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为
您最近一年使用:0次
2020-05-29更新
|
709次组卷
|
2卷引用:山东省济宁市鱼台县第一中学2019-2020学年高一5月开学考试化学试题
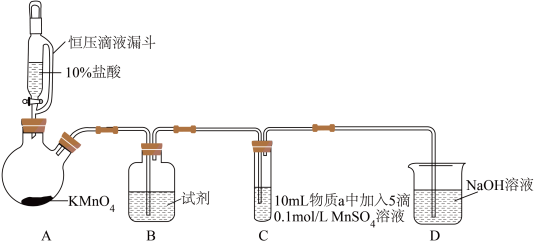
4 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
725次组卷
|
29卷引用:山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题
名校
5 . 在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。
(1)完成并配平下列化学方程式:_____________
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________ mol。
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为
您最近一年使用:0次
2018-12-11更新
|
125次组卷
|
4卷引用:【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题
【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题(已下线)2010年福建省厦门市杏南中学高三上学期10月月考化学卷福建省惠安惠南中学2019届高三上学期期中考试化学试题宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题
22-23高三上·广东·阶段练习
名校
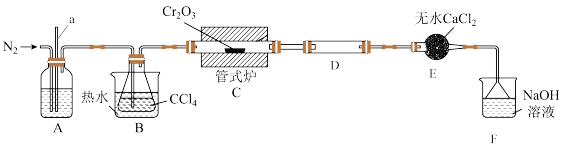
6 . 三氯化铬( )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的装置如图所示:
的装置如图所示:
已知:碱性条件下, 可将
可将 氧化
氧化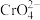 (黄色);酸性条件下,
(黄色);酸性条件下, 可将
可将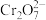 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。
回答下列问题:
(1)基态Cr原子的核外电子排布式为_______ 。
(2)装置B中热水的作用是_______ ;实验进行一段时间后,发现导管a中的液面在不断上升,出现该现象的可能原因是_______ ,改进的措施是_______ 。
(3)对于装置C中发生的反应,甲、乙分别提出了两种不同的观点,甲认为发生的反应是 ;乙认为发生的反应是
;乙认为发生的反应是 。
。
Ⅰ.查阅资料知: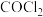 (俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为
(俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为_______ 。
Ⅱ.设计实验验证装置C中发生的反应;反应结束后,静置,待装置F中溶液分层后,取适量上层溶液于试管中,_______ ,证明甲的观点正确,
(4)测定某样品中 的质量分数的实验步骤如下:
的质量分数的实验步骤如下:
Ⅰ.取5.0g该样品,在强碱性条件下·加入过量30% 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为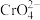 ,再继续加热一段时间。
,再继续加热一段时间。
Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使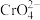 转化为
转化为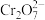 ,再加适量的蒸馏水将溶液稀释至100mL
,再加适量的蒸馏水将溶液稀释至100mL
Ⅲ.取25.00mL溶液,加入适量浓 混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的
混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液21.00mL(滴定中
标准溶液21.00mL(滴定中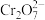 被
被 还原为
还原为 )。
)。
①步骤Ⅰ中完全转化时发生反应的离子方程式为_______ 。
②该样品中 的质量分数为
的质量分数为_______ 。
 )是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取
)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取 的装置如图所示:
的装置如图所示:
已知:碱性条件下,
 可将
可将 氧化
氧化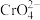 (黄色);酸性条件下,
(黄色);酸性条件下, 可将
可将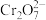 (橙色)还原为
(橙色)还原为 (绿色)。
(绿色)。回答下列问题:
(1)基态Cr原子的核外电子排布式为
(2)装置B中热水的作用是
(3)对于装置C中发生的反应,甲、乙分别提出了两种不同的观点,甲认为发生的反应是
 ;乙认为发生的反应是
;乙认为发生的反应是 。
。Ⅰ.查阅资料知:
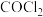 (俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为
(俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为Ⅱ.设计实验验证装置C中发生的反应;反应结束后,静置,待装置F中溶液分层后,取适量上层溶液于试管中,
(4)测定某样品中
 的质量分数的实验步骤如下:
的质量分数的实验步骤如下:Ⅰ.取5.0g该样品,在强碱性条件下·加入过量30%
 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为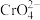 ,再继续加热一段时间。
,再继续加热一段时间。Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使
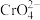 转化为
转化为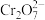 ,再加适量的蒸馏水将溶液稀释至100mL
,再加适量的蒸馏水将溶液稀释至100mLⅢ.取25.00mL溶液,加入适量浓
 混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的
混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的 的
的 标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗 标准溶液21.00mL(滴定中
标准溶液21.00mL(滴定中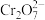 被
被 还原为
还原为 )。
)。①步骤Ⅰ中完全转化时发生反应的离子方程式为
②该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2022-10-12更新
|
486次组卷
|
5卷引用:山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(实验综合题)
(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(实验综合题)广东省部分学校2022-2023学年高三上学期10月联考化学试题江西省赣州市五校联考2022-2023学年高三上学期期中考试化学试题湖南省邵东市第一中学2022-2023学年高二上学期期中考试化学试题安徽省滁州市实验中学等2校2022-2023学年高二上学期1月期末考试化学试题
解题方法
7 . 根据所学知识回答下列问题:
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为__________ 。
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:__________ 。
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:
方案一:碱性条件下用 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为__________ 。
方案二:在碱性条件下,用铝粉处理,已知反应时Al与 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是__________ ,还原产物是__________ ,请写出反应的离子方程式:__________ 。
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:
(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:方案一:碱性条件下用
 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为方案二:在碱性条件下,用铝粉处理,已知反应时Al与
 为
为 ,且Al转化为
,且Al转化为 ,被氧化的元素是
,被氧化的元素是
您最近一年使用:0次
8 . 高铁酸钾 (K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知: 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与 反应制备
反应制备
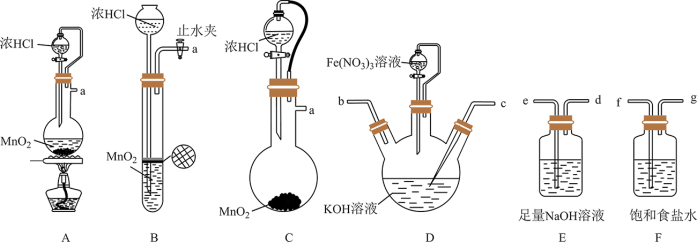
(1)氯气的发生装置可以选择图中的_______ (用图中大写字母表示);化学反应方程式为_______ 。
(2)选择上述装置,制备 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。_________
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。 在硫酸溶液中反应如下:
在硫酸溶液中反应如下:
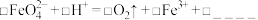
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。__________
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。
Ⅱ.干法制备高铁酸钾的主要反应为: 。
。
(4)①该反应中的还原剂是_______ 。
②每生成 转移
转移_______ 个电子(阿伏加德罗常数用 表示)。
表示)。
(5)简要说明 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用_______ 。
 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与
 反应制备
反应制备

(1)氯气的发生装置可以选择图中的
(2)选择上述装置,制备
 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。
 在硫酸溶液中反应如下:
在硫酸溶液中反应如下: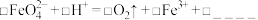
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
Ⅱ.干法制备高铁酸钾的主要反应为:
 。
。(4)①该反应中的还原剂是
②每生成
 转移
转移 表示)。
表示)。(5)简要说明
 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用
您最近一年使用:0次
名校
9 . I.海带中含有丰富的碘,某学习小组设计并进行以下实验:
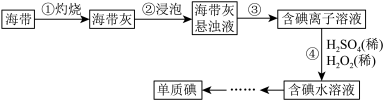
(1)步骤③的实验操作所用。用到的玻璃仪器有___________ 。步骤④的离子反应方程式为: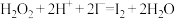 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是___________ ,还原剂是___________ 。步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现蓝色,说明有碘单质产生。
II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失, 被氧气氧化成碘单质(I2),同时得到强碱性物质。
被氧气氧化成碘单质(I2),同时得到强碱性物质。
(2)写出潮湿环境下KI与氧气反应的化学方程式:___________ 。
III.现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:
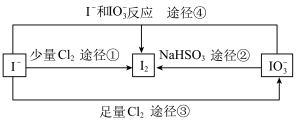
(3)四个途径中属于氧化还原反应的是___________ (填序号)。
(4)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为: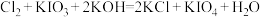 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。
(5)比较I2、 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:___________ 。

(1)步骤③的实验操作所用。用到的玻璃仪器有
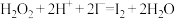 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,
 被氧气氧化成碘单质(I2),同时得到强碱性物质。
被氧气氧化成碘单质(I2),同时得到强碱性物质。(2)写出潮湿环境下KI与氧气反应的化学方程式:
III.现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:

(3)四个途径中属于氧化还原反应的是
(4)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为:
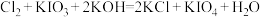 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)比较I2、
 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:
您最近一年使用:0次
名校
10 . Ⅰ.海带中含有丰富的碘,某学习小组设计并进行以下实验:
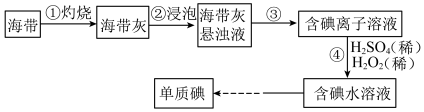
(1)步骤③的实验操作为___________ (填实验名称),此过程使用玻璃棒,玻璃棒的作用是___________ 。
(2)步骤④的离子反应方程式为: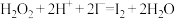 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是___________ ,还原剂是___________ 。步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现蓝色,说明有碘单质产生。
Ⅱ.碘称为“智力元素”。过去食盐中作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失, 被氧气氧化成碘单质(
被氧气氧化成碘单质( ),同时得到强碱性物质。
),同时得到强碱性物质。
(3)写出潮湿环境下 与氧气反应的化学方程式:
与氧气反应的化学方程式:___________ 。
Ⅲ.现在的食盐里改添加性质稳定的 ,以满足人们需要。几种粒子之间有如图所示关系:
,以满足人们需要。几种粒子之间有如图所示关系:
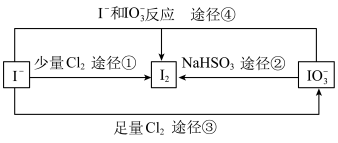
(4)四个途径中属于氧化还原反应的是___________ (填序号)。
(5)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(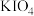 ),反应方程式为:
),反应方程式为: ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。
(6)比较 、
、 和
和 的氧化性强弱:
的氧化性强弱:___________ 。

(1)步骤③的实验操作为
(2)步骤④的离子反应方程式为:
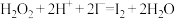 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是Ⅱ.碘称为“智力元素”。过去食盐中作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,
 被氧气氧化成碘单质(
被氧气氧化成碘单质( ),同时得到强碱性物质。
),同时得到强碱性物质。(3)写出潮湿环境下
 与氧气反应的化学方程式:
与氧气反应的化学方程式:Ⅲ.现在的食盐里改添加性质稳定的
 ,以满足人们需要。几种粒子之间有如图所示关系:
,以满足人们需要。几种粒子之间有如图所示关系:
(4)四个途径中属于氧化还原反应的是
(5)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(
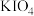 ),反应方程式为:
),反应方程式为: ,写出该反应的离子方程式:
,写出该反应的离子方程式:(6)比较
 、
、 和
和 的氧化性强弱:
的氧化性强弱:
您最近一年使用:0次



