1 . 高铁酸钾纯品为暗紫色有光泽粉末。在198  以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是
 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是A.由上述反应可知,Fe(OH)3的氧化性强于 |
| B.高铁酸钾中铁显 + 6价 |
| C.上述反应氧化剂和还原剂的物质的量之比为3 : 2 |
| D.K2FeO4处理水时,不仅能消毒杀菌,而且生成Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近一年使用:0次
2020-06-22更新
|
215次组卷
|
4卷引用:山东省临沂市莒南第二中学2021届高三10月月考化学试题
山东省临沂市莒南第二中学2021届高三10月月考化学试题陕西省延安市吴起高级中学2019-2020学年高二下学期第三次质量检测化学试题(已下线)第二单元 化学物质的变化测试题-2021年高考化学一轮复习名师精讲练(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)
名校
解题方法
2 . NaNO2 和食盐外观很像,曾出现误把 NaNO2 当食盐而造成人员中毒的事情,在酸性溶液中它也是一种氧化剂,如,NaNO2 能把 Fe2+氧化成 Fe3+。
已知 NaNO2 水溶液呈碱性,AgNO2 是一种难 溶于水白色固体。试回答下列问题:
(1)人体正常的血红蛋白含有 Fe2+。若误食亚硝酸盐,如NaNO2,则导致血红蛋白中的 Fe2+转化为Fe3+而中毒,可以服用维生素 C 解毒,维生素 C 在解毒的过程中表现出_____ (填“氧化”或“还原”)性。
(2)下列方法中,不能用来区分 NaNO2 和 NaCl 的是( ) (填序号)
A.测溶液的酸碱性
B.加入 AgNO3 溶液观察是否有沉淀生成
C.分别在它们的酸性溶液中加入FeCl2 溶液,观察溶液颜色变化
(3)S2O 可以与Fe2+反应制备 Fe2O3纳米颗粒。
可以与Fe2+反应制备 Fe2O3纳米颗粒。
① 若S2O 与Fe2+的个数之比为1:2,配平该反应的离子方程式:
与Fe2+的个数之比为1:2,配平该反应的离子方程式:
_____ Fe2++_____ S2O +
+_____ H2O2+_____ OH-=___ _Fe2O3+___ S2O +
+___ H2O
② 下列关于该反应的说法中正确的是______ (填序号)。
A.该反应中S2O 表现了氧化性
表现了氧化性
B.已知生成的 Fe2O3 纳米颗粒直径为 10 纳米,则 Fe2O3 纳米颗粒为胶体
C.该反应中 H2O2 作氧化剂
已知 NaNO2 水溶液呈碱性,AgNO2 是一种难 溶于水白色固体。试回答下列问题:
(1)人体正常的血红蛋白含有 Fe2+。若误食亚硝酸盐,如NaNO2,则导致血红蛋白中的 Fe2+转化为Fe3+而中毒,可以服用维生素 C 解毒,维生素 C 在解毒的过程中表现出
(2)下列方法中,不能用来区分 NaNO2 和 NaCl 的是
A.测溶液的酸碱性
B.加入 AgNO3 溶液观察是否有沉淀生成
C.分别在它们的酸性溶液中加入FeCl2 溶液,观察溶液颜色变化
(3)S2O
 可以与Fe2+反应制备 Fe2O3纳米颗粒。
可以与Fe2+反应制备 Fe2O3纳米颗粒。① 若S2O
 与Fe2+的个数之比为1:2,配平该反应的离子方程式:
与Fe2+的个数之比为1:2,配平该反应的离子方程式: +
+ +
+② 下列关于该反应的说法中正确的是
A.该反应中S2O
 表现了氧化性
表现了氧化性B.已知生成的 Fe2O3 纳米颗粒直径为 10 纳米,则 Fe2O3 纳米颗粒为胶体
C.该反应中 H2O2 作氧化剂
您最近一年使用:0次
2020-10-12更新
|
165次组卷
|
2卷引用:山东省济宁邹城市第一中学2020-2021学年高一10月月考化学试题
解题方法
3 . 高铁酸钾( )是新型的绿色环保水处理剂。一种制备
)是新型的绿色环保水处理剂。一种制备 的流程如下:
的流程如下:

下列说法错误的是( )
 )是新型的绿色环保水处理剂。一种制备
)是新型的绿色环保水处理剂。一种制备 的流程如下:
的流程如下:
下列说法错误的是( )
A.步骤i中反应的离子方程式为 |
B.步骤ⅱ说明碱性条件下,氧化性: |
C.步骤ⅲ的反应为复分解反应,说明溶解度: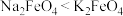 |
D. 作为性能优良的水处理剂,主要是利用了其强氧化性和还原后产生的具有絮凝作用的Fe(Ⅲ) 作为性能优良的水处理剂,主要是利用了其强氧化性和还原后产生的具有絮凝作用的Fe(Ⅲ) |
您最近一年使用:0次
名校
解题方法
4 . 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________ 。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________ 。
(3)根据上述反应可推知__________________ 。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
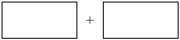
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________ 。
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________ 。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为
(3)根据上述反应可推知
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)

(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式
您最近一年使用:0次
2018-10-22更新
|
739次组卷
|
6卷引用:山东省临沂市第十九中学2019届高三上学期第三次质量调研考试化学试题
山东省临沂市第十九中学2019届高三上学期第三次质量调研考试化学试题(已下线)专题2.3 氧化还原反应 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》山东省济宁市嘉祥县第一中学2022届高三10月月考化学试题2017届内蒙古杭锦后旗奋斗中学高三上第一次月考化学试卷福建省平潭县新世纪学校2020届高三上学期第一次月考化学试题(已下线)第3讲 氧化还原反应
解题方法
5 . 宏观辨识与微观探析是化学学科核心素养之一、根据所学知识,回答下列问题:
(1)拟卤离子主要有 、
、 、
、 ,性质与卤离子相似,它们相应的中性分子性质与卤素单质也相似。
,性质与卤离子相似,它们相应的中性分子性质与卤素单质也相似。
①已知还原性;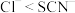 ,写出酸性条件下加热时,
,写出酸性条件下加热时, 和KSCN(aq)反应的离子方程式:
和KSCN(aq)反应的离子方程式:___________ 。
② 与水反应生成的含氧酸的结构式为
与水反应生成的含氧酸的结构式为___________ 。氰化提金工艺在黄金生产领域仍占主导地位,但会产生大量含氰( )废水,含氰废水中加入足量的
)废水,含氰废水中加入足量的 ,发生反应的离子方程式为
,发生反应的离子方程式为 。理论上处理含氰废水(含
。理论上处理含氰废水(含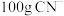 ),需要消耗
),需要消耗___________ g (保留2位小数)。按照理论值投放,含氰废水处理效果并不理想,请分析原因:
(保留2位小数)。按照理论值投放,含氰废水处理效果并不理想,请分析原因:___________ 。
(2)酒精仪中酸性重铬酸钾(稀硫酸酸化)可将乙醇氧化成乙酸,本身被还原成 。写出该反应的离子方程式:
。写出该反应的离子方程式:___________ ;在该反应中还原剂是___________ (填化学式)。氧化23g乙醇时转移电子的物质的量为___________ 。
(3) 和
和 都属于离子型化合物,前者跟水反应生成
都属于离子型化合物,前者跟水反应生成 和
和 ,写出
,写出 跟水反应的化学方程式:
跟水反应的化学方程式:___________ 。
(1)拟卤离子主要有
 、
、 、
、 ,性质与卤离子相似,它们相应的中性分子性质与卤素单质也相似。
,性质与卤离子相似,它们相应的中性分子性质与卤素单质也相似。①已知还原性;
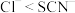 ,写出酸性条件下加热时,
,写出酸性条件下加热时, 和KSCN(aq)反应的离子方程式:
和KSCN(aq)反应的离子方程式:②
 与水反应生成的含氧酸的结构式为
与水反应生成的含氧酸的结构式为 )废水,含氰废水中加入足量的
)废水,含氰废水中加入足量的 ,发生反应的离子方程式为
,发生反应的离子方程式为 。理论上处理含氰废水(含
。理论上处理含氰废水(含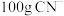 ),需要消耗
),需要消耗 (保留2位小数)。按照理论值投放,含氰废水处理效果并不理想,请分析原因:
(保留2位小数)。按照理论值投放,含氰废水处理效果并不理想,请分析原因:(2)酒精仪中酸性重铬酸钾(稀硫酸酸化)可将乙醇氧化成乙酸,本身被还原成
 。写出该反应的离子方程式:
。写出该反应的离子方程式:(3)
 和
和 都属于离子型化合物,前者跟水反应生成
都属于离子型化合物,前者跟水反应生成 和
和 ,写出
,写出 跟水反应的化学方程式:
跟水反应的化学方程式:
您最近一年使用:0次
2023-10-08更新
|
141次组卷
|
3卷引用:山东省部分学校2024届高三上学期十月联考化学试题
名校
解题方法
6 . 某同学设计如图装置探究H2O2、SO2、I2的氧化性强弱。首先用N2排净装置内空气,然后通入SO2,甲中蓝色溶液褪色,乙中产生不溶于盐酸的白色沉淀;关闭弹簧夹,打开甲中分液漏斗活塞,逐滴滴加H2O2溶液,开始时颜色无明显变化,继续滴加H2O2溶液,混合液逐渐变成蓝色。下列说法错误的是
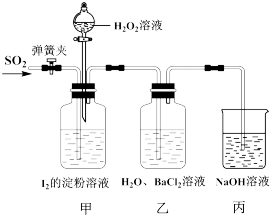

| A.甲中蓝色溶液褪色说明SO2将I2还原 |
| B.乙中反应的离子方程式是SO2+Ba2++H2O2=BaSO4↓+2H+ |
| C.实验中“开始时颜色无明显变化”的原因是SO2与H2O2反应 |
| D.由实验可知H2O2、SO2、I2氧化性由强到弱的顺序是I2>H2O2>SO2 |
您最近一年使用:0次
2021-01-04更新
|
51次组卷
|
2卷引用:山东省威海乳山市银滩高级中学2022-2023学年高一10月第二次考试化学试题
解题方法
7 . 氧化铈( )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、 等)为原料制备氧化铈,其工艺流程如图所示:
等)为原料制备氧化铈,其工艺流程如图所示:

已知:
① 在空气中易被氧化,易与
在空气中易被氧化,易与 形成复盐沉淀;
形成复盐沉淀;
②硫脲( )具有还原性,酸性条件下易被氧化为
)具有还原性,酸性条件下易被氧化为 ;
;
③ 在硫酸体系中能被萃取剂[
在硫酸体系中能被萃取剂[ ]萃取,而
]萃取,而 不能。
不能。
回答下列问题:
(1)“氧化焙烧”中氧化的目的是___________ 。
(2)步骤①中加入硫脲的目的是将四价铈还原为三价铈,写出硫脲与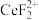 反应生成
反应生成 的离子方程式
的离子方程式___________ 。
(3)步骤③反应的离子方程式为___________ 。
(4)步骤④萃取时存在反应: 。
。 分别在有机层中与水层中存在形式的物质的量浓度之比称为分配比(
分别在有机层中与水层中存在形式的物质的量浓度之比称为分配比( )。取20mL含四价铈总浓度为0.1
)。取20mL含四价铈总浓度为0.1 的酸浸液,向其中加入10mL萃取剂
的酸浸液,向其中加入10mL萃取剂 ,充分振荡,静置,若
,充分振荡,静置,若 ,则水层中
,则水层中
_______________ 。(计算结果保留二位有效数字)。
(5)步骤⑤“反萃取”时双氧水的作用是___________ 。
(6)产品 是汽车尾气净化催化剂中最重要的助剂,催化机理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,催化机理如图所示。写出过程①发生反应的化学方程式___________ 。

 )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、 等)为原料制备氧化铈,其工艺流程如图所示:
等)为原料制备氧化铈,其工艺流程如图所示:
已知:
①
 在空气中易被氧化,易与
在空气中易被氧化,易与 形成复盐沉淀;
形成复盐沉淀;②硫脲(
 )具有还原性,酸性条件下易被氧化为
)具有还原性,酸性条件下易被氧化为 ;
;③
 在硫酸体系中能被萃取剂[
在硫酸体系中能被萃取剂[ ]萃取,而
]萃取,而 不能。
不能。回答下列问题:
(1)“氧化焙烧”中氧化的目的是
(2)步骤①中加入硫脲的目的是将四价铈还原为三价铈,写出硫脲与
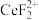 反应生成
反应生成 的离子方程式
的离子方程式(3)步骤③反应的离子方程式为
(4)步骤④萃取时存在反应:
 。
。 分别在有机层中与水层中存在形式的物质的量浓度之比称为分配比(
分别在有机层中与水层中存在形式的物质的量浓度之比称为分配比( )。取20mL含四价铈总浓度为0.1
)。取20mL含四价铈总浓度为0.1 的酸浸液,向其中加入10mL萃取剂
的酸浸液,向其中加入10mL萃取剂 ,充分振荡,静置,若
,充分振荡,静置,若 ,则水层中
,则水层中
(5)步骤⑤“反萃取”时双氧水的作用是
(6)产品
 是汽车尾气净化催化剂中最重要的助剂,催化机理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,催化机理如图所示。写出过程①发生反应的化学方程式
您最近一年使用:0次
名校
8 . 亚氯酸钠 主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
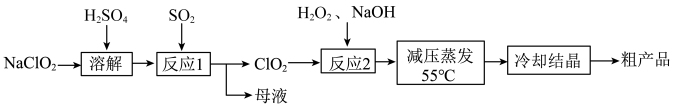
已知:①亚氯酸钠 受热易分解;②高浓度的
受热易分解;②高浓度的 易爆炸。
易爆炸。
(1) 与
与 因有强氧化性而用作常用消毒剂,消毒时均被还原为
因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力(转移电子的物质的量)是等质量的
的消毒能力(转移电子的物质的量)是等质量的 的
的______ 倍(保留小数点后一位)。“反应1”需要鼓入空气,空气的作用是______ 。
(2)“反应2”发生反应的化学方程式:______ 。“反应2”需要控制反应温度不能过高,温度过高可能导致______ 。
(3)从“母液”中可回收的主要物质是______ 。
(4)为探究 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂______ 。根据选择的试剂,描述能体现 氧化性的实验现象是
氧化性的实验现象是______
A.淀粉-KI溶液 B.酸性高锰酸钾溶液 C.氯水 D. 溶液
溶液
 主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
已知:①亚氯酸钠
 受热易分解;②高浓度的
受热易分解;②高浓度的 易爆炸。
易爆炸。(1)
 与
与 因有强氧化性而用作常用消毒剂,消毒时均被还原为
因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力(转移电子的物质的量)是等质量的
的消毒能力(转移电子的物质的量)是等质量的 的
的(2)“反应2”发生反应的化学方程式:
(3)从“母液”中可回收的主要物质是
(4)为探究
 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂 氧化性的实验现象是
氧化性的实验现象是A.淀粉-KI溶液 B.酸性高锰酸钾溶液 C.氯水 D.
 溶液
溶液
您最近一年使用:0次
名校
解题方法
9 . 填空。
(1)有下列四个反应:
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④SO2+2NaOH=Na2SO3+H2O
上述反应中不属于氧化还原反应的是___________ (填序号,下同);H2O只作还原剂的是___________ ;属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是___________ 。
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有___________ 性。下列不能实现这种转化的物质是___________ (填字母)。
a.酸性KMnO4溶液 b.FeCl3 c.O2 d.浓硫酸
(3)已知氧化性Fe3+>Cu2+>Fe2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入一定量的铁粉,下列说法正确的是___________。(填字母)
(4)我国古代炼丹术中用的铅丹与硝酸反应方程式是:X(铅丹)+4HNO3=PbO2+2Pb(NO3)2+2H2O,则铅丹的化学式为___________ ,其中+2价的Pb和+4价的Pb含量之比为:___________ 。
(5)治理汽车尾气方法之一是在汽车的排气管上安装“催化转化器”,CO和NO可以转化为两种无毒的气体,写出化学方程式,用单线桥标出电子转移的方向和数目:___________ 。
(1)有下列四个反应:
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2
④SO2+2NaOH=Na2SO3+H2O
上述反应中不属于氧化还原反应的是
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有
a.酸性KMnO4溶液 b.FeCl3 c.O2 d.浓硫酸
(3)已知氧化性Fe3+>Cu2+>Fe2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入一定量的铁粉,下列说法正确的是___________。(填字母)
| A.若铁粉无剩余,且溶液中有Cu2+,则溶液中可能有Fe3+ |
| B.若铁粉无剩余,溶液中一定有Fe2+,一定无Cu2+ |
| C.若铁粉有剩余,则不溶物一定有铜 |
| D.若铁粉有剩余,则溶液中一定有Fe2+和Cu2+ |
(5)治理汽车尾气方法之一是在汽车的排气管上安装“催化转化器”,CO和NO可以转化为两种无毒的气体,写出化学方程式,用单线桥标出电子转移的方向和数目:
您最近一年使用:0次
10 . 二氧化氯( )具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:
)具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:
(1) 与热水反应得到
与热水反应得到 、
、 。该反应的氧化产物是一种不含氯元素的气体,其分子式为
。该反应的氧化产物是一种不含氯元素的气体,其分子式为___________ 。
(2)将1
 通入
通入 和
和 的混合溶液中,充分反应后有
的混合溶液中,充分反应后有 生成,反应中共转移5
生成,反应中共转移5 电子,则发生反应的离子方程式为
电子,则发生反应的离子方程式为___________ 。
(3) 可通过下列反应制备:
可通过下列反应制备:
①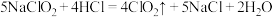
②
用上述两种方法制备等质量的 转移电子数之比为
转移电子数之比为___________ 。现在科学家研究出用草酸( )在酸性条件下还原
)在酸性条件下还原 的制备方法。已知
的制备方法。已知 被氧化生成
被氧化生成 。写出该制备方法的离子方程式:
。写出该制备方法的离子方程式:___________ 。该方法最突出的优点是___________ 。
(4)通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的大小。 和
和 在消毒时自身均被还原为
在消毒时自身均被还原为 ,则
,则 的消毒效率是
的消毒效率是 的
的___________ 倍(保留两位小数)。
 )具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:
)具有强氧化性,是一种安全、无毒的绿色消毒剂,遇热水易分解,浓度大时易爆炸。回答下列问题:(1)
 与热水反应得到
与热水反应得到 、
、 。该反应的氧化产物是一种不含氯元素的气体,其分子式为
。该反应的氧化产物是一种不含氯元素的气体,其分子式为(2)将1

 通入
通入 和
和 的混合溶液中,充分反应后有
的混合溶液中,充分反应后有 生成,反应中共转移5
生成,反应中共转移5 电子,则发生反应的离子方程式为
电子,则发生反应的离子方程式为(3)
 可通过下列反应制备:
可通过下列反应制备:①
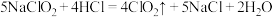
②

用上述两种方法制备等质量的
 转移电子数之比为
转移电子数之比为 )在酸性条件下还原
)在酸性条件下还原 的制备方法。已知
的制备方法。已知 被氧化生成
被氧化生成 。写出该制备方法的离子方程式:
。写出该制备方法的离子方程式:(4)通常用单位质量的消毒剂得到电子的多少来衡量消毒效率的大小。
 和
和 在消毒时自身均被还原为
在消毒时自身均被还原为 ,则
,则 的消毒效率是
的消毒效率是 的
的
您最近一年使用:0次



