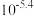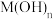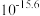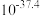1 . 从钼精矿焙烧烟尘(含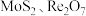 ,少量
,少量 )中回收铼的工艺流程如图所示:
)中回收铼的工艺流程如图所示: 元素易被氧化。②
元素易被氧化。②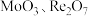 易溶于水生成
易溶于水生成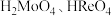 ,其它钼、铼的氧化物难溶于水。③钼元素与硫酸根可形成配离子。
,其它钼、铼的氧化物难溶于水。③钼元素与硫酸根可形成配离子。
回答下列问题:
(1) 焙烧产物基本全部为
焙烧产物基本全部为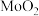 。焙烧时
。焙烧时 反应的化学方程式为:
反应的化学方程式为:
①
②_______ 。
(2)水浸时,加入 的作用是
的作用是_______ 。
(3)已知 在水中的溶解度:
在水中的溶解度:
水浸液中,钼的浓度约为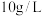 ,可能原因为
,可能原因为_______ 。钼、铼的浸出率随温度的变化关系如图1所示,则水浸时,适宜的温度为_______ ℃左右。 )与树脂上的官能团发生交换反应达到平衡。浸取液中
)与树脂上的官能团发生交换反应达到平衡。浸取液中 浓度对铼的吸附率影响如图2所示,铼的浸出率随
浓度对铼的吸附率影响如图2所示,铼的浸出率随 浓度变化的原因为
浓度变化的原因为_______ 。
(5) 的立方晶胞结构如下图所示,则
的立方晶胞结构如下图所示,则 配位数为
配位数为_______ ,若晶胞密度为 ,则晶胞参数
,则晶胞参数
_______  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ,少量
,少量 )中回收铼的工艺流程如图所示:
)中回收铼的工艺流程如图所示: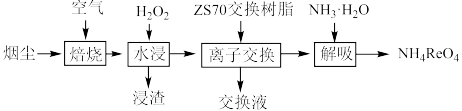
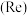 元素易被氧化。②
元素易被氧化。②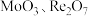 易溶于水生成
易溶于水生成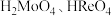 ,其它钼、铼的氧化物难溶于水。③钼元素与硫酸根可形成配离子。
,其它钼、铼的氧化物难溶于水。③钼元素与硫酸根可形成配离子。回答下列问题:
(1)
 焙烧产物基本全部为
焙烧产物基本全部为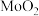 。焙烧时
。焙烧时 反应的化学方程式为:
反应的化学方程式为:①

②
(2)水浸时,加入
 的作用是
的作用是(3)已知
 在水中的溶解度:
在水中的溶解度:温度 | 18 | 30 | 45 | 60 | 70 | 80 |
溶解度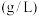 | 0.106 | 0.257 | 0.365 | 0.421 | 0.466 | 0.518 |
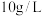 ,可能原因为
,可能原因为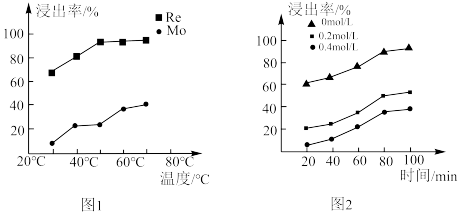
 )与树脂上的官能团发生交换反应达到平衡。浸取液中
)与树脂上的官能团发生交换反应达到平衡。浸取液中 浓度对铼的吸附率影响如图2所示,铼的浸出率随
浓度对铼的吸附率影响如图2所示,铼的浸出率随 浓度变化的原因为
浓度变化的原因为(5)
 的立方晶胞结构如下图所示,则
的立方晶胞结构如下图所示,则 配位数为
配位数为 ,则晶胞参数
,则晶胞参数
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。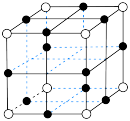
您最近一年使用:0次
解题方法
2 . 处理废旧铅酸电池中的含铅浆液(主要含 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。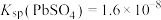 ,
,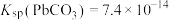 ,
,
ii. 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。
(1)向含铅浆液中加入过量的 实现转化脱硫。
实现转化脱硫。
①结合离子方程式说明 溶液显碱性的原因:
溶液显碱性的原因:________ 。
②转化脱硫反应的离子方程式是________ 。
③检验 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是________ 。
(2)受热时, 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。
将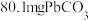 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中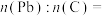
________ 。[ 、
、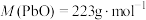 ]
]
(3)“还原”时加入 溶液,反应的化学方程式是
溶液,反应的化学方程式是________ 。
(4)“浸出”反应的离子方程式是________ 。
(5)以惰性电极电解 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是________ 。
 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。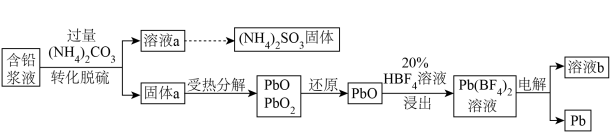
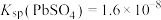 ,
,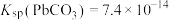 ,
,ii.
 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。(1)向含铅浆液中加入过量的
 实现转化脱硫。
实现转化脱硫。①结合离子方程式说明
 溶液显碱性的原因:
溶液显碱性的原因:②转化脱硫反应的离子方程式是
③检验
 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是(2)受热时,
 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。将
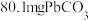 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中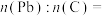
 、
、 ]
](3)“还原”时加入
 溶液,反应的化学方程式是
溶液,反应的化学方程式是(4)“浸出”反应的离子方程式是
(5)以惰性电极电解
 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是
您最近一年使用:0次
名校
解题方法
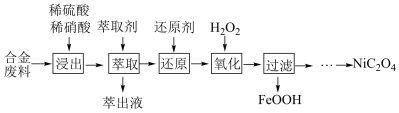
3 . 草酸镍(NiC2O4)是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图: 、
、 ;
;
②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体能吸附Ni2+。
③草酸的Ka1=6.0×10-2,Ka2=5.0×10-5。
回答下列问题:
(1)生产时为提高合金废料浸出率,下列措施可行的是_______ (填字母)。
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是_______ 。
(3)“氧化”过程中,控制70℃、pH小于3的条件下进行。
①“氧化”过程的离子方程式为_______ 。
②若pH大于3镍的回收率降低的原因是_______ 。
(4)“过滤”后的滤液中加入(NH4)2C2O4溶液反应得到草酸镍,过滤得到的草酸镍需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是_______ 。已知常温下Ksp[NiC2O4]=1.70×10-17,当溶液pH=2时,Ni2+沉淀完全[c(Ni2+)≤1×10-5mol·L-1时认为完全沉淀],则此时溶液中草酸的浓度c(H2C2O4)=_______ (保留两位有效数字)。
(5)在空气中加热二水合草酸镍得到NiO,该反应的化学方程式为_______ 。
 、
、 ;
;②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体能吸附Ni2+。
③草酸的Ka1=6.0×10-2,Ka2=5.0×10-5。
回答下列问题:
(1)生产时为提高合金废料浸出率,下列措施可行的是
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是
(3)“氧化”过程中,控制70℃、pH小于3的条件下进行。
①“氧化”过程的离子方程式为
②若pH大于3镍的回收率降低的原因是
(4)“过滤”后的滤液中加入(NH4)2C2O4溶液反应得到草酸镍,过滤得到的草酸镍需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是
(5)在空气中加热二水合草酸镍得到NiO,该反应的化学方程式为
您最近一年使用:0次
2024-05-21更新
|
419次组卷
|
3卷引用:2024届四川省成都外国语学校高三下学期高考模拟(二)理综化学试题
2024届四川省成都外国语学校高三下学期高考模拟(二)理综化学试题2024届江西省南昌市第十九中学高三下学期模拟预测化学试题(已下线)山东省青岛市2023-2024学年高三下学期第三次模拟考试化学试题
名校
解题方法
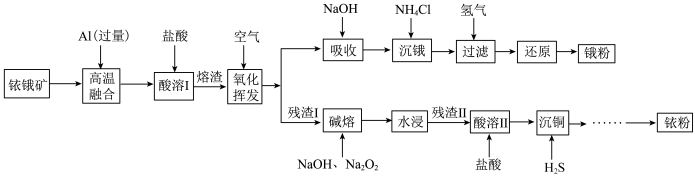
4 . 铱(77Ir)和锇(76Os)属于铂族金属,与金、银合称贵重金属,可以用于电气、精密仪表、催化剂等领域。铱锇矿的主要成分有Ir、Os、Ir2O3、OsO2,还含有CuO和SiO2等杂质,从铱锇矿中提取铱和锇的流程如下:
回答下列问题:
(1)“酸溶I”的目的是___________ ;酸溶I后溶渣的主要成分除Ir、Os外,还有___________ (填化学式)。
(2)“氧化挥发”是将溶渣置于300~800℃的管式炉内,通入空气氧化。再用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为___________ 。
(3)“沉锇”时,NH4Cl与Na2OsO4发生反应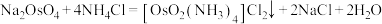 ,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是
,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是___________ 。
(4)“碱熔”时,“残渣I”中的Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为___________ 。
(5)“沉铜”过程中,当通入H2S达到饱和时测得溶液的pH=1,此时溶液中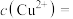
___________ mol/L。[已知:25℃,H2S溶于水形成饱和溶液时, ;H2S的电离常数
;H2S的电离常数 ,
,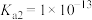 ;
;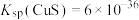 ]
]
(6)化合物 IrO2的四方晶格结构如图所示,其棱边夹角均为90°。已知IrO2晶体密度为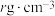 ,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为
,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为___________ (用代数式表示)g/mol。
回答下列问题:
(1)“酸溶I”的目的是
(2)“氧化挥发”是将溶渣置于300~800℃的管式炉内,通入空气氧化。再用NaOH溶液吸收OsO4生成Na2OsO4,该反应的离子方程式为
(3)“沉锇”时,NH4Cl与Na2OsO4发生反应
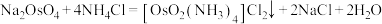 ,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是
,生成的锇盐要立即过滤,滤饼要经无水乙醇多次洗涤,用无水乙醇洗涤的优点是(4)“碱熔”时,“残渣I”中的Ir与Na2O2反应生成IrO2·nNa2O和O2,该反应的化学方程式为
(5)“沉铜”过程中,当通入H2S达到饱和时测得溶液的pH=1,此时溶液中
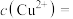
 ;H2S的电离常数
;H2S的电离常数 ,
,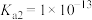 ;
;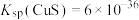 ]
](6)化合物 IrO2的四方晶格结构如图所示,其棱边夹角均为90°。已知IrO2晶体密度为
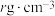 ,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为
,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为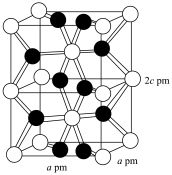
您最近一年使用:0次
2024-05-21更新
|
198次组卷
|
3卷引用:辽宁省协作校2023-2024学年高三下学期三模化学试题
名校
5 . 利用高压氨浸法从黄铜矿中提取铜具有提取率高、污染小等优点,被广泛使用。一种由黄铜矿(主要成分为 ,含少量
,含少量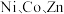 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下:
I.“固液分离”后溶液中主要离子为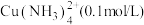 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为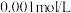 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为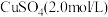 。
。
Ⅱ.不稳定常数对 ,不稳定常数
,不稳定常数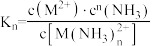
Ⅲ.溶度积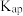
(1)基态 原子的价电子排布式为
原子的价电子排布式为________________ , 中氮原子的杂化方式为
中氮原子的杂化方式为_______________ 。
(2)①浸出前“粉碎磨矿”的目的是_______________ ,②“固液分离”用到的操作是_______________ 。
(3)①“搅拌浸出”主要成分反应的化学方程式为______________ 。(已知:硫元素变成最高价,铁元素变成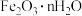 );
);
②铁元素没有以配合物离子存在的原因是__________________ 。
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为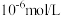 ],需调节
],需调节 至
至___________ ,“萃取”和“反萃取”的作用为________________ 。
 ,含少量
,含少量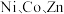 等元素)提取铜的工艺如下:
等元素)提取铜的工艺如下: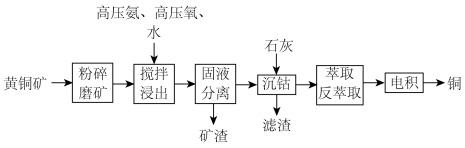
I.“固液分离”后溶液中主要离子为
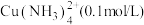 ,杂质离子为
,杂质离子为 、
、 、
、 等阳离子(浓度均为
等阳离子(浓度均为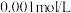 );“电积”时溶液中主要溶质为
);“电积”时溶液中主要溶质为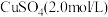 。
。Ⅱ.不稳定常数对
 ,不稳定常数
,不稳定常数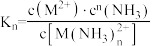
|
|
|
不稳定常数 |
| 0.2 |
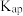
|
|
|
溶度积 |
|
|
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 中氮原子的杂化方式为
中氮原子的杂化方式为(2)①浸出前“粉碎磨矿”的目的是
(3)①“搅拌浸出”主要成分反应的化学方程式为
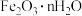 );
);②铁元素没有以配合物离子存在的原因是
(4)常温下,“沉钴”步骤中,溶液中氨气分子浓度为
 ,若要“沉钻”完全[
,若要“沉钻”完全[ 浓度为
浓度为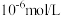 ],需调节
],需调节 至
至
您最近一年使用:0次
解题方法
6 . 黄铜矿的主要成份是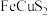 ,以
,以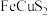 为原料实现如下转化:
为原料实现如下转化:
(1)写出溶液A中的所有阳离子___________ , 的作用
的作用___________ 。
(2)下列说法正确的是___________。
(3) 等锰(Ⅱ)的化合物可制备
等锰(Ⅱ)的化合物可制备 。
。 隔绝空气受热分解生成
隔绝空气受热分解生成 ,产物中无单质,写出该反应的化学方程式
,产物中无单质,写出该反应的化学方程式___________ 。请设计实验方案验证气体产物___________ 。
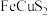 ,以
,以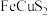 为原料实现如下转化:
为原料实现如下转化: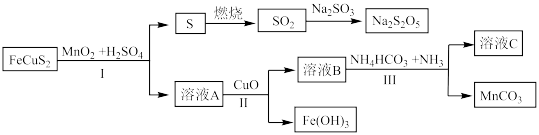
(1)写出溶液A中的所有阳离子
 的作用
的作用(2)下列说法正确的是___________。
| A.S单质存在于火山口或地壳的岩层中 |
B.溶液C含有 |
C. 的水溶液显碱性 的水溶液显碱性 |
D.依据转化关系可知: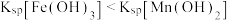 |
(3)
 等锰(Ⅱ)的化合物可制备
等锰(Ⅱ)的化合物可制备 。
。 隔绝空气受热分解生成
隔绝空气受热分解生成 ,产物中无单质,写出该反应的化学方程式
,产物中无单质,写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 五氧化二钒主要用作合金添加剂,含钒钢具有强度高,韧性大,耐磨性好等优良特性。工业上常用炼钢残渣(主要含 及少量铁粉、
及少量铁粉、 、
、 、
、 等杂质)为原料制取
等杂质)为原料制取 的一种工艺流程如图所示:
的一种工艺流程如图所示: 难溶于水,
难溶于水, 。
。
回答下列问题:
(1)基态钒原子的价层电子排布式为___________ 。
(2)“焙烧”时通入大量空气的作用是___________ 。
(3)“碱浸”所得滤渣的主要成分是___________ 。
(4)写出“沉硅、铝”反应的离子方程式:___________ 、___________ 。
(5)若滤液中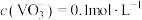 ,为使钒元素沉淀率达到
,为使钒元素沉淀率达到 ,应使“沉钒”后溶液中的
,应使“沉钒”后溶液中的 不低于
不低于___________ 。
(6)“沉钒”析出的 晶体需要洗涤,证明
晶体需要洗涤,证明 已洗涤干净的实验操作及现象为
已洗涤干净的实验操作及现象为___________ 。
(7)在空气中“煅烧”生成的气体可直接排放到空气中,写出反应的化学方程式:___________ 。
 及少量铁粉、
及少量铁粉、 、
、 、
、 等杂质)为原料制取
等杂质)为原料制取 的一种工艺流程如图所示:
的一种工艺流程如图所示: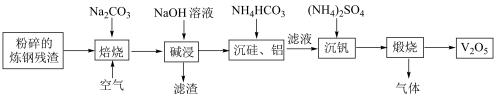
 难溶于水,
难溶于水, 。
。回答下列问题:
(1)基态钒原子的价层电子排布式为
(2)“焙烧”时通入大量空气的作用是
(3)“碱浸”所得滤渣的主要成分是
(4)写出“沉硅、铝”反应的离子方程式:
(5)若滤液中
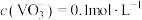 ,为使钒元素沉淀率达到
,为使钒元素沉淀率达到 ,应使“沉钒”后溶液中的
,应使“沉钒”后溶液中的 不低于
不低于(6)“沉钒”析出的
 晶体需要洗涤,证明
晶体需要洗涤,证明 已洗涤干净的实验操作及现象为
已洗涤干净的实验操作及现象为(7)在空气中“煅烧”生成的气体可直接排放到空气中,写出反应的化学方程式:
您最近一年使用:0次
解题方法
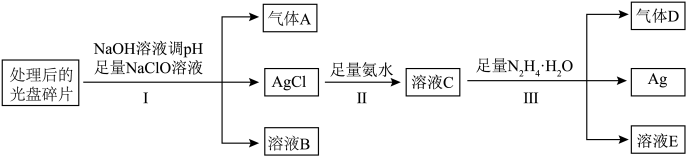
8 . 光盘金属层含有Ag(其它金属微量忽略不计),可以进行资源回收利用,下图为从光盘中提取Ag的工业流程:
②配离子的形成是分步进行的: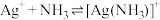
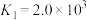 。
。
③AgCl的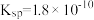 ,
,
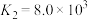 。
。
请回答:
(1)已知Ag位于周期表的第五周期IB族,Ag的原子序数为___________ ;气体A的化学式为___________ ,写出溶液C中所有的阳离子___________ 。
(2)反应Ⅲ的离子方程式为___________ 。
(3)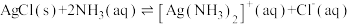 是一个可逆反应。
是一个可逆反应。
①结合相关数据说明上述反应是可逆反应___________ ;
②设计实验验证上述反应是可逆反应___________ 。
②配离子的形成是分步进行的:
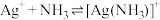
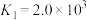 。
。③AgCl的
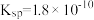 ,
,
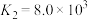 。
。请回答:
(1)已知Ag位于周期表的第五周期IB族,Ag的原子序数为
(2)反应Ⅲ的离子方程式为
(3)
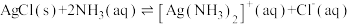 是一个可逆反应。
是一个可逆反应。①结合相关数据说明上述反应是可逆反应
②设计实验验证上述反应是可逆反应
您最近一年使用:0次
9 . 高铁酸钾( )是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾(
)是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾( )可用于自来水杀菌消毒和净化,一种由磁铁矿(主要成份为
)可用于自来水杀菌消毒和净化,一种由磁铁矿(主要成份为 ,还含有少量的MgO、
,还含有少量的MgO、 、
、 等)制备高铁酸钾的过程如下图所示:
等)制备高铁酸钾的过程如下图所示: )难溶于醇等有机溶剂。
)难溶于醇等有机溶剂。
②25℃部分难溶物的溶度积如下:
回答下列问题:
(1)酸溶后得到的滤渣的主要成分___________ 。
(2)加入 氧化过程主要发生的离子方程式
氧化过程主要发生的离子方程式___________ ,
 的用量远大于理论值,原因可能是
的用量远大于理论值,原因可能是___________ 。
(3)滤液1中含有的主要金属阳离子为___________ 。
(4)氧化过滤过程产生 ,写出该过程的离子方程式
,写出该过程的离子方程式___________ ,根据制备过程可知,该温度下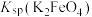
___________ 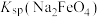 (填“<”或“>”)。
(填“<”或“>”)。
(5) 粗产品含有
粗产品含有 、KCl等杂质,用
、KCl等杂质,用___________ 方法进行分离提纯。其提纯步骤为:将一定量的 粗产品溶于冷的3 mol/L KOH溶液中过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用
粗产品溶于冷的3 mol/L KOH溶液中过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用___________ (填字母)。
a.蒸馏水 b.乙醇 c.氢氧化钠溶液
(6)产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:
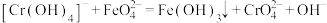


现称取a g高铁酸钾( )(摩尔质量为M g/mol)样品溶于过量的碱性亚铬酸盐
)(摩尔质量为M g/mol)样品溶于过量的碱性亚铬酸盐 溶液中,充分反应后过滤,滤液在250 mL容量瓶中定容,每次取25.00 mL于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c mol/L
溶液中,充分反应后过滤,滤液在250 mL容量瓶中定容,每次取25.00 mL于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c mol/L 标准溶液滴定至终点,消耗标准溶液V mL。该产品中高铁酸钾(
标准溶液滴定至终点,消耗标准溶液V mL。该产品中高铁酸钾( )的纯度为
)的纯度为___________ %。
 )是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾(
)是一种暗紫色固体,在低温和碱性环境中稳定存在,在中性或酸性溶液中易发生分解反应,释放出氧气,同时产生一种絮凝剂。高铁酸钾( )可用于自来水杀菌消毒和净化,一种由磁铁矿(主要成份为
)可用于自来水杀菌消毒和净化,一种由磁铁矿(主要成份为 ,还含有少量的MgO、
,还含有少量的MgO、 、
、 等)制备高铁酸钾的过程如下图所示:
等)制备高铁酸钾的过程如下图所示: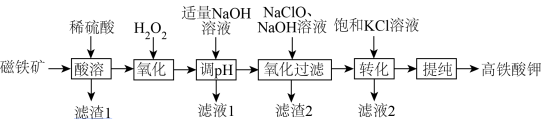
 )难溶于醇等有机溶剂。
)难溶于醇等有机溶剂。②25℃部分难溶物的溶度积如下:
 |  |  |  |
 |  |  |  |
(1)酸溶后得到的滤渣的主要成分
(2)加入
 氧化过程主要发生的离子方程式
氧化过程主要发生的离子方程式 的用量远大于理论值,原因可能是
的用量远大于理论值,原因可能是(3)滤液1中含有的主要金属阳离子为
(4)氧化过滤过程产生
 ,写出该过程的离子方程式
,写出该过程的离子方程式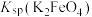
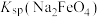 (填“<”或“>”)。
(填“<”或“>”)。(5)
 粗产品含有
粗产品含有 、KCl等杂质,用
、KCl等杂质,用 粗产品溶于冷的3 mol/L KOH溶液中过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用
粗产品溶于冷的3 mol/L KOH溶液中过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,洗涤2~3次,在真空干燥箱中干燥。洗涤过程中可以选用a.蒸馏水 b.乙醇 c.氢氧化钠溶液
(6)产品纯度测定,可采用亚铬酸盐滴定法,滴定时有关反应的离子方程式为:
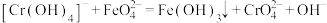


现称取a g高铁酸钾(
 )(摩尔质量为M g/mol)样品溶于过量的碱性亚铬酸盐
)(摩尔质量为M g/mol)样品溶于过量的碱性亚铬酸盐 溶液中,充分反应后过滤,滤液在250 mL容量瓶中定容,每次取25.00 mL于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c mol/L
溶液中,充分反应后过滤,滤液在250 mL容量瓶中定容,每次取25.00 mL于锥形瓶中加入稀硫酸酸化,滴入二苯胺磺酸钠做指示剂,用c mol/L 标准溶液滴定至终点,消耗标准溶液V mL。该产品中高铁酸钾(
标准溶液滴定至终点,消耗标准溶液V mL。该产品中高铁酸钾( )的纯度为
)的纯度为
您最近一年使用:0次
解题方法
10 . 某实验小组从某废旧锂离子电池正极活性材料(主要成分可表示为 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: 、
、 、
、 、
、 ;
;
②有关金属离子沉淀完全的 见下表:
见下表:
(1)丁二酮肟分子中 杂化的碳原子个数为
杂化的碳原子个数为______ ,二丁二酮肟镍中存在的化学键有______ (填序号)。
A. 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键
(2)“氧化”过程的操作为控制体系的 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式______ 。
(3)P507萃取剂(用HA表示)萃取 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为______ 。 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为______ 。
(5)将草酸钴晶体 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为______ 。 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出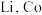 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为______ 。
 ,还含有少量
,还含有少量 、
、 的化合物)中分别回收处理金属元素,工艺流程如下图所示:
的化合物)中分别回收处理金属元素,工艺流程如下图所示: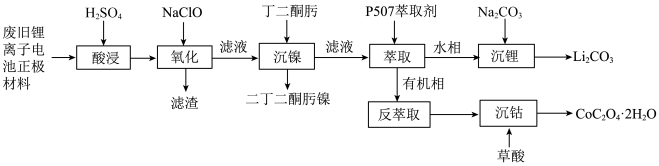
 、
、 、
、 、
、 ;
;②有关金属离子沉淀完全的
 见下表:
见下表:离子 |
|
|
|
|
| 9.3 | 3.2 | 9.0 | 8.9 |
③沉镍反应为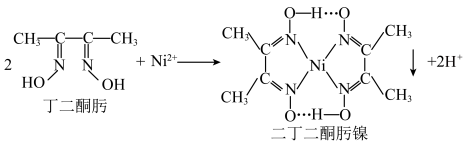
(1)丁二酮肟分子中
 杂化的碳原子个数为
杂化的碳原子个数为A.
 链 B.氢键 C.金属键 D.配位键
链 B.氢键 C.金属键 D.配位键(2)“氧化”过程的操作为控制体系的
 在
在 ,加入
,加入 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式(3)P507萃取剂(用HA表示)萃取
 的原理可表示为
的原理可表示为 的浸出与水相
的浸出与水相 的关系如图所示。分析
的关系如图所示。分析 较小时萃取率偏低的原因为
较小时萃取率偏低的原因为
 和
和 在空气氛围中焙烧可得到
在空气氛围中焙烧可得到 ,该反应化学方程式为
,该反应化学方程式为(5)将草酸钴晶体
 置于空气中加热,受热过程中固体残留率(
置于空气中加热,受热过程中固体残留率( )变化如下图所示,则C点固体物质的化学式为
)变化如下图所示,则C点固体物质的化学式为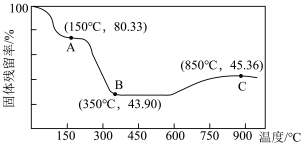
 的一种晶胞如图所示(仅标出
的一种晶胞如图所示(仅标出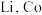 与
与 未标出)、该晶胞中占有O的个数为
未标出)、该晶胞中占有O的个数为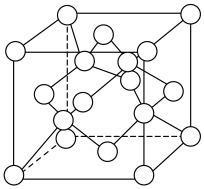
您最近一年使用:0次



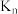 (常温)
(常温)