1 . 某同学对教材中铜与浓硫酸的实验作了如下改进。实验装置如图所示(加热和夹持装置已略去)。
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是____________________ 。
(2)仪器A的名称是_________________ ,仪器B的作用是_________________ ,仪器D中所盛药品是_________________ 。
(3)装置A中发生反应的化学方程式为_________________ 。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是_______________ 。
(5)实验后仪器A中有白色固体产生,将仪器A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是_____________ ,用所得溶液做焰色反应实验时,观察到的火焰颜色为___________ 。不可直接向仪器A中加水的原因是_________________ 。

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是
(2)仪器A的名称是
(3)装置A中发生反应的化学方程式为
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是
(5)实验后仪器A中有白色固体产生,将仪器A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是
您最近一年使用:0次
2 . 工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_____ 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在______ (填离子符号),检验溶液中还存在Fe2+的方法是 __________
(3)由泡铜冶炼粗铜的化学反应方程式为____________________ .
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为_____ g。

(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在
(3)由泡铜冶炼粗铜的化学反应方程式为
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为
您最近一年使用:0次
2016-12-09更新
|
624次组卷
|
3卷引用:2015-2016学年四川省成都树德中学高一下期末化学试卷
2015-2016学年四川省成都树德中学高一下期末化学试卷2017届湖南长沙一中高二上第一次月考(开学考试)化学卷(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
3 . 某学生研究小组欲探究CuSO4溶液与Na2CO3溶液混合产生的蓝绿色沉淀组成,小组进行下列实验探究。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
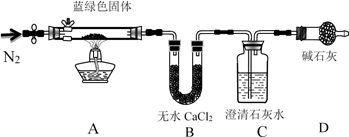
步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
(1)假设2中的沉淀为________________ 。
(2)假设1中沉淀为Cu(OH)2的理论依据是____________________________________ 。
(3)无水乙醇洗涤的目的_________________________ 。
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设__ (填写序号)成立。
(5)乙同学认为只要将上图中B装置的试剂改用____________ 试剂后,便可验证上述所有假设。
(6)乙同学更换B试剂后验证假设3成立的实验现象是_________________ 。
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为____________________ 。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为________
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。

步骤2:甲同学取一定量固体,用气密性良好的下图装置(夹持仪器未画出)进行定性实验。请回答下列问题:
(1)假设2中的沉淀为
(2)假设1中沉淀为Cu(OH)2的理论依据是
(3)无水乙醇洗涤的目的
(4)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设
(5)乙同学认为只要将上图中B装置的试剂改用
(6)乙同学更换B试剂后验证假设3成立的实验现象是
(7)在假设3成立的前提下,某同学考虑用Ba(OH)2代替Ca(OH)2,测定蓝绿色固体的化学式,若所取蓝绿色固体质量为27.1g,实验结束后装置B的质量增加2.7g,C中的产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为
您最近一年使用:0次
2016-12-09更新
|
232次组卷
|
7卷引用:2016届四川省雅安市三诊理综化学试卷
4 . 某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质。过程如下:
【提出问题】
①在元素周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、_________________________ (填试剂名称,一种或多种),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取 98 g Cu(OH)2固体,加热至80~100 ℃ 时,得到80 g黑色固体粉末,继续加热到1000 ℃ 以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为________________ 。向A中加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,则反应的离子方程式为______________________________________________ 。
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体,该气体的化学式为________ 。
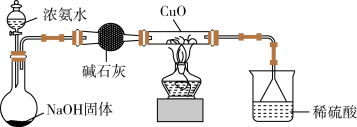
【实验结论】
(4)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是_________________________ 。
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:在高温时_________________ ;在酸性溶液中____________________________________________________________________ 。
(6)CuO能被NH3还原。有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A:______________________________________________________________________ 。
【提出问题】
①在元素周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、
(2)解决问题②的实验步骤和现象如下:取 98 g Cu(OH)2固体,加热至80~100 ℃ 时,得到80 g黑色固体粉末,继续加热到1000 ℃ 以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体,该气体的化学式为

【实验结论】
(4)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:在高温时
(6)CuO能被NH3还原。有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A:
您最近一年使用:0次
解题方法
5 . 现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
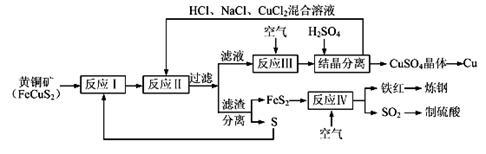
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是_____________ 、_____________ 。
(2)反应Ⅰ的产物为(填化学式)_____________ 。
(3)反应Ⅲ的离子方程式为_____________ 。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是_____________ 。
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是_____________ (填字母)。
(6)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2 + Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为_____________ 。
②反应Ⅳ所得气体中SO2的体积分数为_____________ 。

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是
(2)反应Ⅰ的产物为(填化学式)
(3)反应Ⅲ的离子方程式为
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是| A.反应中被还原的元素只有氧 |
| B.反应生成的SO2直接排放会污染环境 |
| C.SO2既是氧化产物又是还原产物 |
| D.当有8mol铜生成时,转移电子数目为100NA |
已知:Cr2
 + Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为
②反应Ⅳ所得气体中SO2的体积分数为
您最近一年使用:0次
名校
解题方法
6 . CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)⇌H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO42-+4H+
CuCl43﹣(aq)⇌CuCl(s)+3Cl﹣(aq)
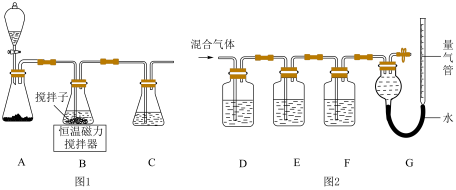
①装置C的作用是_____ .
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物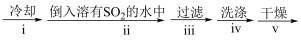 CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____ .
③实验室保存新制CuCl晶体的方法是_____ .
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____ .
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl•H2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____ 、_____ .
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____ .
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO42-+4H+
CuCl43﹣(aq)⇌CuCl(s)+3Cl﹣(aq)

①装置C的作用是
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物
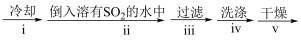 CuCl晶体
CuCl晶体操作ⅱ的主要目的是
操作ⅳ中最好选用的试剂是
③实验室保存新制CuCl晶体的方法是
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl•H2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
712次组卷
|
9卷引用:安徽省六安市第一中学2017届高三下学期第九次月考理综化学试题
12-13高三上·福建泉州·期中
真题
7 . 现拟用图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量

(1)制备一氧化碳的化学方程式是______ ;
(2)试验中,观察到反应管中发生的现象是______ ;尾气的主要成分是______ ;
(3)反应完成后,正确的操作顺序为______ (填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为______ ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节)______ ;
②写出有关反应的化学方程式______ 。

(1)制备一氧化碳的化学方程式是
(2)试验中,观察到反应管中发生的现象是
(3)反应完成后,正确的操作顺序为
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节)
②写出有关反应的化学方程式
您最近一年使用:0次
2014高三·全国·专题练习
8 . 某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
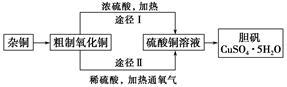
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于_______ 上(用以下所给仪器的编号填入,下同),取用坩埚应使用_______ ,灼烧后的坩埚应放在_______ 上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿b.石棉网c.泥三角d.表面皿e.坩埚钳f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是_______ 。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、_______ 、冷却结晶、_______ 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是_______ 、_______ 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行_______ 次。
(6)若测定结果x值偏高,可能的原因是_______ (填字母编号)。
a.加热温度过高b.胆矾晶体的颗粒较大c.加热后放在空气中冷却d.胆矾晶体部分风化

(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
实验所用仪器:a.蒸发皿b.石棉网c.泥三角d.表面皿e.坩埚钳f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行
(6)若测定结果x值偏高,可能的原因是
a.加热温度过高b.胆矾晶体的颗粒较大c.加热后放在空气中冷却d.胆矾晶体部分风化
您最近一年使用:0次
11-12高一上·浙江宁波·期中
解题方法
9 . 根据下图物质之间的转化关系,回答下列问题:
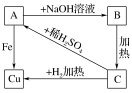
(1)写出A、B、C的化学式:
A________ 、B________ 、C________ 。
(2)写出有关的化学方程式:
A―→B__________________________ ;
A―→Cu_________________________ 。

(1)写出A、B、C的化学式:
A
(2)写出有关的化学方程式:
A―→B
A―→Cu
您最近一年使用:0次
10-11高三上·湖南长沙·阶段练习
名校
10 . 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为_______________________ ;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为____________________ 。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
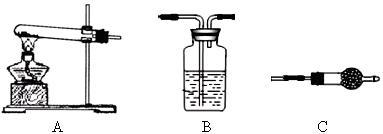
(1)各装置连接顺序为__________________________ 。
(2)能证明生成物中有CuCO3的实验现象是__________________ 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。
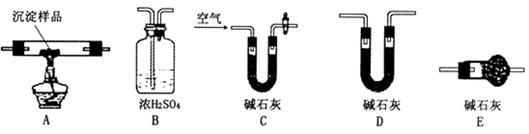

(1)装置C中碱石灰的作用是__________________ ,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是____________________________
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为___________ 。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

(1)各装置连接顺序为
(2)能证明生成物中有CuCO3的实验现象是
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。


(1)装置C中碱石灰的作用是
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为
您最近一年使用:0次
2016-12-09更新
|
532次组卷
|
4卷引用:2010年湖南省长沙一中高三上学期第三次月考化学试题
(已下线)2010年湖南省长沙一中高三上学期第三次月考化学试题(已下线)2011届广西河池高级中学高三第六次月考理综化学部分2020届高考化学二轮复习大题精准训练 ——定性分析探究实验题河南省商丘市第一高级中学2020届高三上学期期中考试化学试题



