1 . 已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:
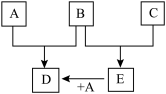
(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为___________ ,写出A+E→D的化学反应方程式___________ 。
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为___________ ,写出A+E→D的化学反应方程式___________ 。
(3)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为___________ ,写出A+E→D的化学反应方程式___________ 。

(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为
(3)若常温下B为气体,C为黑色固体,则构成金属A的原子结构示意图为
您最近一年使用:0次
2 . 某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出如下的问题,探究。请你协助该小组的同学完成下列研究。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、____ (填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为___ 。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
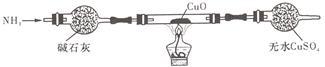
实验中观察到CuO变为红色物质,无水CuSO4变___ 色。同时生成一种对大气无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是_____ 。
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是____ 。
【问题讨论】
有同学认为NH3与CuO反应生成的红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质是Cu和A的混合物。
请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A___ 。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):

实验中观察到CuO变为红色物质,无水CuSO4变
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是
【问题讨论】
有同学认为NH3与CuO反应生成的红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质是Cu和A的混合物。
请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A
您最近一年使用:0次
2014高三·全国·专题练习
3 . 铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________ ;Y与过量浓硝酸反应后溶液中含有的盐的化学式为___________ 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___ 。
A.Mg2+B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
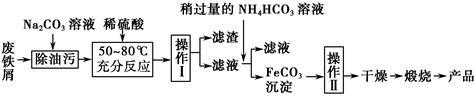
回答下列问题:
①操作Ⅰ的名称是________ ;操作Ⅱ的名称是________ ;操作Ⅱ的方法为_____________________ 。
②请写出生成FeCO3沉淀的离子方程式:____________________________ 。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是
A.Mg2+B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是
②请写出生成FeCO3沉淀的离子方程式:
您最近一年使用:0次
14-15高三上·陕西西安·阶段练习
名校
4 . 铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________ ;Y与过量浓硝酸反应后溶液中含有的盐的化学式为___________ 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___ 。
A.Mg2+B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是________ ;操作Ⅱ的名称是________ ;操作Ⅱ的方法为_____________________ 。
②请写出生成FeCO3沉淀的离子方程式:____________________________ 。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是
A.Mg2+B.Fe2+C.Al3+D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是
②请写出生成FeCO3沉淀的离子方程式:
您最近一年使用:0次
2016-12-08更新
|
536次组卷
|
5卷引用:2015届陕西省西安一中高三上学期第二次模考试化学试卷
12-13高三上·江苏南京·阶段练习
5 . 氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
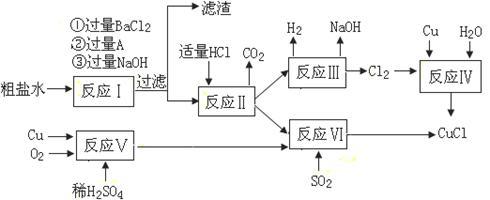
(1)A的化学式为__________________ 。
(2)写出反应V的化学方程式__________________________________________ 。
(3)写出反应VI的离子方程式为________________________________________ 。
(4)本工艺中可以循环利用的物质是(用化学式表示)______________ 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是_______ 、____________ 。

(1)A的化学式为
(2)写出反应V的化学方程式
(3)写出反应VI的离子方程式为
(4)本工艺中可以循环利用的物质是(用化学式表示)
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是
您最近一年使用:0次
2011·内蒙古呼伦贝尔·二模
解题方法
6 . 用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
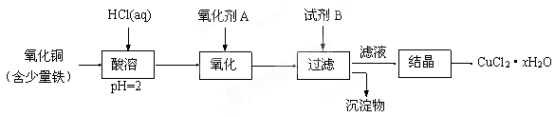
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
(1)加热酸溶过程中发生反应的化学方程式有:____________ 。
(2)氧化剂A可选用_________ (填编号,下同)。
A.KMnO4 B. HNO3 C. Cl2
(3)要得到较纯的产品,试剂B可选用_________ 。
A. NaOH B. CuO C.FeO
(4)试剂B的作用是__________ 。
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
(5)从滤液经过结晶得到氯化铜晶体的实验条件是___________ 。

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解。
(1)加热酸溶过程中发生反应的化学方程式有:
(2)氧化剂A可选用
A.KMnO4 B. HNO3 C. Cl2
(3)要得到较纯的产品,试剂B可选用
A. NaOH B. CuO C.FeO
(4)试剂B的作用是
A. 使Cu2+完全沉淀 B. 使Fe3+完全沉淀
C. 降低溶液的pH D. 提高溶液的pH
(5)从滤液经过结晶得到氯化铜晶体的实验条件是
您最近一年使用:0次
真题
名校
7 . 氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中得到的氧化产物是_________ ,溶解温度应控制在60~70度,原因是__________ 。
(2)写出步骤③中主要反应的离子方程式___________ 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是______________________________ 。
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有__________ (填字母)
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________ 。

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)写出步骤③中主要反应的离子方程式
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)步骤②、④、⑤、⑧都要进行固液分离。工业上常用的固液分离设备有
| A.分馏塔 | B.离心机 | C.反应釜 | D.框式压滤机 |
(6)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为
您最近一年使用:0次
2015-06-24更新
|
4975次组卷
|
6卷引用:2015年全国普通高等学校招生统一考试化学(新课标I卷)



