解题方法
1 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
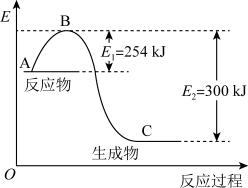
(1)如图是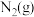 和
和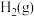 反应生成
反应生成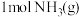 过程中能量的变化示意图,该化学反应属于
过程中能量的变化示意图,该化学反应属于___________ (放热或吸热)反应,正反应的活化能为___________ ,写出该反应的热化学方程式:___________ 。
(2)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为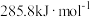 ,请写出氢气燃烧热的热化学方程式:
,请写出氢气燃烧热的热化学方程式:________ 。已知 转化成
转化成 吸收
吸收 的热量,
的热量,________ 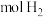 完全燃烧生成气态水可以放出
完全燃烧生成气态水可以放出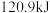 的热量(不可虑热量损失)。
的热量(不可虑热量损失)。

(1)如图是
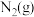 和
和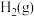 反应生成
反应生成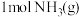 过程中能量的变化示意图,该化学反应属于
过程中能量的变化示意图,该化学反应属于(2)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为
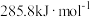 ,请写出氢气燃烧热的热化学方程式:
,请写出氢气燃烧热的热化学方程式: 转化成
转化成 吸收
吸收 的热量,
的热量,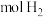 完全燃烧生成气态水可以放出
完全燃烧生成气态水可以放出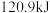 的热量(不可虑热量损失)。
的热量(不可虑热量损失)。
您最近一年使用:0次
2 . I、已知下列热化学方程式:
①2H2O(l)=2H2(g)+O2(g)△H=+570kJ/mol
②H2(g)+ O2(g)=H2O(l)△H=-285.6kJ/mol
O2(g)=H2O(l)△H=-285.6kJ/mol
③C(s)+ O2(g)=CO (g) △H=—110.5KJ/moL
O2(g)=CO (g) △H=—110.5KJ/moL
④C(s)+O2(g)=CO2(g) △H=—393.5KJ/moL。回答下列各问:
(1)上述反应中属于吸热反应的是_________________________ (填写对应序号)。
(2)H2的燃烧热△H=___ kJ/mol,C的燃烧热△H=_______ kJ/mol。
(3)燃烧10gH2生成液态水,放出的热量为____________ kJ。
(4)CO的燃烧热△H=__________ kJ/mol
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(5)图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______________________ 。
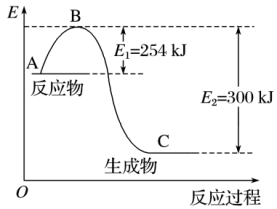
(6)该反应通常用铁触媒作催化剂,加铁触媒会使△H______ (填“变大”、“变小”或“不变”)
(7)若已知下列数据:
试根据表中及图中数据计算N—H的键能为_______ kJ/mol。
①2H2O(l)=2H2(g)+O2(g)△H=+570kJ/mol
②H2(g)+
 O2(g)=H2O(l)△H=-285.6kJ/mol
O2(g)=H2O(l)△H=-285.6kJ/mol ③C(s)+
 O2(g)=CO (g) △H=—110.5KJ/moL
O2(g)=CO (g) △H=—110.5KJ/moL ④C(s)+O2(g)=CO2(g) △H=—393.5KJ/moL。回答下列各问:
(1)上述反应中属于吸热反应的是
(2)H2的燃烧热△H=
(3)燃烧10gH2生成液态水,放出的热量为
(4)CO的燃烧热△H=
II、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(5)图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(6)该反应通常用铁触媒作催化剂,加铁触媒会使△H
(7)若已知下列数据:
| 化学键 | H—H | N≡N |
| 键能 (kJ/mol) | 435 | 943 |
试根据表中及图中数据计算N—H的键能为
您最近一年使用:0次
名校
3 . 请按照要求完成下列填空。
(1)在配制 的氯化钠溶液过程中,以下可能导致所配溶液浓度偏低的是
的氯化钠溶液过程中,以下可能导致所配溶液浓度偏低的是
(2)请写出实验室制乙炔的反应方程式___________ 制取的乙炔常含有硫化氢等杂质,用___________ 溶液除去。
(3)葡萄酒中通常要加 作为抗氧化剂和保鲜剂,为测定
作为抗氧化剂和保鲜剂,为测定 的含量通常用酸性高锰酸钾滴定的方法,请写出该反应原理的离子方程式:
的含量通常用酸性高锰酸钾滴定的方法,请写出该反应原理的离子方程式:___________
(4)漂白剂和洁厕灵(含盐酸)同时使用会使人中毒是什么原因呢?请用离子方程式解释:___________
(5)25℃,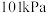 时,32g甲烷在足量的氧气中完全燃烧放出
时,32g甲烷在足量的氧气中完全燃烧放出 的热量,请写出甲烷燃烧热的热化学方程式:
的热量,请写出甲烷燃烧热的热化学方程式:___________
(1)在配制
 的氯化钠溶液过程中,以下可能导致所配溶液浓度偏低的是
的氯化钠溶液过程中,以下可能导致所配溶液浓度偏低的是| A.氯化钠固体不纯 | B.定容时仰视读数 |
| C.装瓶时有少量溶液洒出 | D.称量时砝码端忘垫质量相同的纸片 |
(3)葡萄酒中通常要加
 作为抗氧化剂和保鲜剂,为测定
作为抗氧化剂和保鲜剂,为测定 的含量通常用酸性高锰酸钾滴定的方法,请写出该反应原理的离子方程式:
的含量通常用酸性高锰酸钾滴定的方法,请写出该反应原理的离子方程式:(4)漂白剂和洁厕灵(含盐酸)同时使用会使人中毒是什么原因呢?请用离子方程式解释:
(5)25℃,
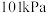 时,32g甲烷在足量的氧气中完全燃烧放出
时,32g甲烷在足量的氧气中完全燃烧放出 的热量,请写出甲烷燃烧热的热化学方程式:
的热量,请写出甲烷燃烧热的热化学方程式:
您最近一年使用:0次
名校
解题方法
4 . 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
则途径I放出的热量___________ (填“大于”“等于”或“小于”)途径II放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是___________ 。
(2)在25℃、101kPa下,2g甲醇完全燃料放热45.36kJ,写出甲醇燃烧热的热化学方程式___________ 。
(3)已知①CO(g)+ O2(g)=CO2(g) ∆H1=-283.0kJ/mol
O2(g)=CO2(g) ∆H1=-283.0kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=___________ 。
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g) ∆H1=+551kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ∆H3=-297kJ/mol
反应Ⅱ的热化学方程式:___________
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ④
则途径I放出的热量
(2)在25℃、101kPa下,2g甲醇完全燃料放热45.36kJ,写出甲醇燃烧热的热化学方程式
(3)已知①CO(g)+
 O2(g)=CO2(g) ∆H1=-283.0kJ/mol
O2(g)=CO2(g) ∆H1=-283.0kJ/mol②H2(g)+ O2(g)=H2O(l) ΔH2=-285.8kJ/mol
O2(g)=H2O(l) ΔH2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g) ∆H1=+551kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ∆H3=-297kJ/mol
反应Ⅱ的热化学方程式:
您最近一年使用:0次
2021-10-15更新
|
194次组卷
|
2卷引用:广东省梅州市梅江区梅州中学2021-2022学年高二上学期阶段性考试化学试题
名校
解题方法
5 . 纳米金属燃料已应用到生活和高科技领域中。一些原子序数较小的金属、非金属和常用燃料的单位质量燃烧热的比较如图所示。

回答下列问题:
(1)结合元素在地壳中的含量,在单位质量燃烧热大于汽油和氢单质的物质中,最具发展潜力的两种新型燃料可以是___________ (填元素符号)。这些物质作为燃料使用,除具有高燃烧热值外,还具有的优点是___________ (填一项)。
(2)金属在较低温度下燃烧的关键技术之一是将其制成纳米颗粒,使得燃烧更为容易和充分,其原因是___________ 。
(3)Be粉和MnO2粉末在高温下可以发生反应(类似铝热反应),每消耗1 g Be粉放出a kJ热量,写出该反应的热化学方程式:___________ 。
(4)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH3=___________ kJ·mol-1。

回答下列问题:
(1)结合元素在地壳中的含量,在单位质量燃烧热大于汽油和氢单质的物质中,最具发展潜力的两种新型燃料可以是
(2)金属在较低温度下燃烧的关键技术之一是将其制成纳米颗粒,使得燃烧更为容易和充分,其原因是
(3)Be粉和MnO2粉末在高温下可以发生反应(类似铝热反应),每消耗1 g Be粉放出a kJ热量,写出该反应的热化学方程式:
(4)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH3=
您最近一年使用:0次
6 . 在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的物质。
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJmol-1
②C和CO的燃烧热分别为393.5kJmol1和283kJmol1
则2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=_______ 。
(2)已知充分燃烧乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为_______ 。
(3)25℃,101kPa时,强酸与强碱的稀溶液反应时,每生成1molH2O(l)会放出57.3kJ的热量,写出表示氢氧化钠溶液和稀硫酸反应的中和热的热化学方程式为:_______
(4)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)⇌Y(g)Z(s)
(乙)A(s)2B(g)⇌C(g)D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是_______ ;能表明(乙)达到化学平衡状态是_______ 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJmol-1
②C和CO的燃烧热分别为393.5kJmol1和283kJmol1
则2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=
(2)已知充分燃烧乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为
(3)25℃,101kPa时,强酸与强碱的稀溶液反应时,每生成1molH2O(l)会放出57.3kJ的热量,写出表示氢氧化钠溶液和稀硫酸反应的中和热的热化学方程式为:
(4)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)⇌Y(g)Z(s)
(乙)A(s)2B(g)⇌C(g)D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
您最近一年使用:0次
名校
7 . 按要求完成下列问题。
(1)已知充分燃烧一定量的乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为_______ 。
(2)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应时,每生成 会放出
会放出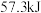 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:_______ 。
(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)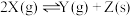
(乙)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是_______ ;能表明(乙)达到化学平衡状态是_______ 。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
(1)已知充分燃烧一定量的乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为
(2)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应时,每生成
 会放出
会放出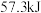 的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:
的热量,写出氢氧化钠溶液和稀硫酸反应的热化学方程式为:(3)在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)
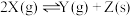
(乙)

当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
您最近一年使用:0次
2021-09-22更新
|
306次组卷
|
2卷引用:天津市新华中学2020-2021学年高二上学期第一次月考化学试题
解题方法
8 . 化学物质在汽车的动力、安全等方面有着极为重要的作用。
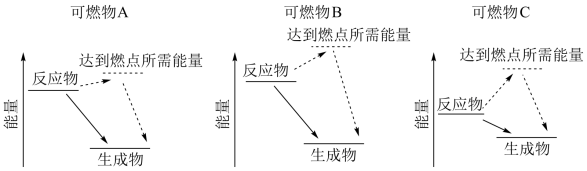
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物_______ (填“A”、“B”或“C”)更适合用作车用燃料。(已知:燃点是指在规定的条件下,应用外部热源使物质表面起火并持续燃烧一定时间所需的最低温度,燃点较低时存在安全隐患。)
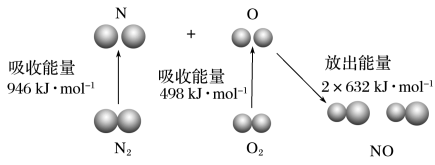
(2)汽车尾气中含有 、
、 等污染物。其中
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为_______ (填“吸热”或“放热”)反应。
(3)通过 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
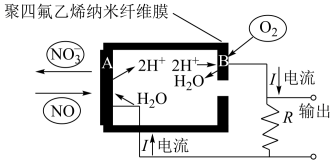
①A电极发生的是_______ 反应(填“氧化”或“还原”)。
②B电极反应为_______ 。
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为 。
。
①当有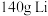 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为_______ 。
②根据①的计算思路,分析 做电极优于
做电极优于 的原因是
的原因是_______ 。
(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有 、
、 、
、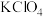 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。
①药剂中 做冷却剂原因是
做冷却剂原因是_______ 。
②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有_______ (填标号)。
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
(1)某同学根据所查阅的资料,绘制了三种可燃物在空气中发生燃烧反应的能量变化示意图。根据示意图,你认为可燃物

(2)汽车尾气中含有
 、
、 等污染物。其中
等污染物。其中 生成过程的能量变化如图,由该图数据计算可得,该反应为
生成过程的能量变化如图,由该图数据计算可得,该反应为
(3)通过
 传感器可监测汽车尾气中
传感器可监测汽车尾气中 的含量,其工作原理如图所示:
的含量,其工作原理如图所示:
①A电极发生的是
②B电极反应为
(4)电动汽车普遍使用锂离子电池。某锂离子电池反应为
 。
。①当有
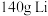 消耗时,电路中转移电子数目为
消耗时,电路中转移电子数目为②根据①的计算思路,分析
 做电极优于
做电极优于 的原因是
的原因是(5)安全性是汽车发展需要解决的重要问题。汽车受到强烈撞击时,预置在安全气囊内的化学药剂发生反应产生大量气体,气囊迅速弹出。某种产气药剂主要含有
 、
、 、
、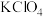 、
、 ,已知
,已知 在猛烈撞击时分解产生两种单质,并放出大量的热。
在猛烈撞击时分解产生两种单质,并放出大量的热。①药剂中
 做冷却剂原因是
做冷却剂原因是②根据产气药剂的组成,在设计气囊中所运用的化学反应时,需要考虑的角度有
A.固体反应物的颜色 B.气体产物的毒性 C.反应的快慢 D.反应的能量变化
您最近一年使用:0次
名校
解题方法
9 . 为了合理利用化学能确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得:5g液态甲醇(CH3OH)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5kJ的热量。试写出甲醇燃烧热的热化学方程式:___ 。
(2)合成甲醇的主要反应是2H2(g)+CO(g) CH3OH(g)ΔH=-90.8kJ·mol-1,t℃时,向2L的密闭容器中投入2molH2和mmolCO,反应10min后测得各组分的浓度如下:
CH3OH(g)ΔH=-90.8kJ·mol-1,t℃时,向2L的密闭容器中投入2molH2和mmolCO,反应10min后测得各组分的浓度如下:
则该时间段内反应速率v(H2)=___ ,m=___ mol。
(3)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
①若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=___ mol。
②反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为___ ,原混合气体中a:b=___ (写出最简整数比,下同)。
③达到平衡时,N2和H2的转化率之比α(N2):α(H2)=___ 。
(1)实验测得:5g液态甲醇(CH3OH)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出113.5kJ的热量。试写出甲醇燃烧热的热化学方程式:
(2)合成甲醇的主要反应是2H2(g)+CO(g)
 CH3OH(g)ΔH=-90.8kJ·mol-1,t℃时,向2L的密闭容器中投入2molH2和mmolCO,反应10min后测得各组分的浓度如下:
CH3OH(g)ΔH=-90.8kJ·mol-1,t℃时,向2L的密闭容器中投入2molH2和mmolCO,反应10min后测得各组分的浓度如下:| 物质 | H2 | CO | CH3OH |
| 浓度(mol·L-1) | 0.2 | 0.1 | 0.4 |
(3)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)
 2NH3(g)
2NH3(g)①若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=
②反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为
③达到平衡时,N2和H2的转化率之比α(N2):α(H2)=
您最近一年使用:0次
名校
解题方法
10 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。

(1)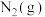 和
和 反应生成
反应生成 过程中能量的变化如图,该化学反应属于
过程中能量的变化如图,该化学反应属于_______ (放热或吸热)反应,一般来说反应使用催化剂后,会使图中 点升高还是降低?
点升高还是降低?_______ ; 点对应
点对应 的大小对该反应的反应热有无影响?
的大小对该反应的反应热有无影响?_______ 。
(2)请写出该反应的热化学方程式:_______ 。
(3)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为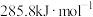 ,请写出氢气的燃烧热热化学方程式:
,请写出氢气的燃烧热热化学方程式:_______ 。

(1)
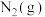 和
和 反应生成
反应生成 过程中能量的变化如图,该化学反应属于
过程中能量的变化如图,该化学反应属于 点升高还是降低?
点升高还是降低? 点对应
点对应 的大小对该反应的反应热有无影响?
的大小对该反应的反应热有无影响?(2)请写出该反应的热化学方程式:
(3)上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为
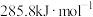 ,请写出氢气的燃烧热热化学方程式:
,请写出氢气的燃烧热热化学方程式:
您最近一年使用:0次



