名校
1 . 周期表中ⅡA族元素及其化合物应用广泛。铍的化合物性质与铝相似, 的熔点为
的熔点为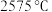 ,熔融时
,熔融时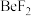 能导电,而
能导电,而 不能导电;
不能导电; 的燃烧热为
的燃烧热为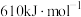 ,实验室中常用酸性
,实验室中常用酸性 测定物品中不溶性
测定物品中不溶性 的含量。铍镍合金可用于制造弹簧秤的弹簧,
的含量。铍镍合金可用于制造弹簧秤的弹簧, 可用作隔音材料,
可用作隔音材料, 可用作工业废气脱硫剂。下列化学反应表示正确的是
可用作工业废气脱硫剂。下列化学反应表示正确的是
 的熔点为
的熔点为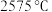 ,熔融时
,熔融时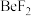 能导电,而
能导电,而 不能导电;
不能导电; 的燃烧热为
的燃烧热为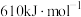 ,实验室中常用酸性
,实验室中常用酸性 测定物品中不溶性
测定物品中不溶性 的含量。铍镍合金可用于制造弹簧秤的弹簧,
的含量。铍镍合金可用于制造弹簧秤的弹簧, 可用作隔音材料,
可用作隔音材料, 可用作工业废气脱硫剂。下列化学反应表示正确的是
可用作工业废气脱硫剂。下列化学反应表示正确的是A. 与 与 溶液反应: 溶液反应: |
B.镁的燃烧:  |
C.向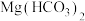 溶液中滴加足量 溶液中滴加足量 溶液: 溶液: |
D.用酸性 测定 测定 的含量: 的含量: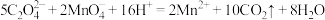 |
您最近一年使用:0次
2024-01-28更新
|
606次组卷
|
3卷引用:2024届江苏省连云港市高三第一次调研考试(一模)化学试题
2024届江苏省连云港市高三第一次调研考试(一模)化学试题河南省焦作市博爱县第一中学2023-2024学年高三下学期开学化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
2 . 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。[已知:2SO2(g)+O2(g) 2SO3(g) ΔH=﹣196.9kJ•mol﹣1]
2SO3(g) ΔH=﹣196.9kJ•mol﹣1]
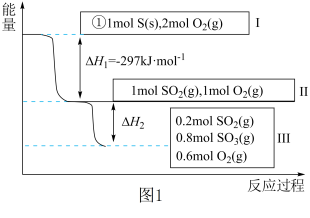
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:___________ 。
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有___________。
(3)恒温恒容时,1mol SO2和2mol O2充分反应,放出热量的数值比|ΔH2|___________ (填“大”、“小”或“相等”)。
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是___________ ;图中表示平衡混合物中SO3的含量最高的一段时间是___________ 。

 2SO3(g) ΔH=﹣196.9kJ•mol﹣1]
2SO3(g) ΔH=﹣196.9kJ•mol﹣1]
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有___________。
| A.升高温度 | B.充入He | C.再充入1mol SO2(g)和1mol O2(g) | D.使用催化剂 |
(3)恒温恒容时,1mol SO2和2mol O2充分反应,放出热量的数值比|ΔH2|
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是

您最近一年使用:0次
名校
3 . 已知X、Y、Z、W、R、M为原子序数依次增大的元素,其中X、Y、Z、W、R为短周期主族元素,且位于三个不同周期,Y的某种核素可用于测定文物的年代,W的最外层电子数是最内层的3倍,W与R同主族,元素M是地壳中含量排名第二的金属元素。回答下列问题:
(1)写出 的电子式:
的电子式:_____ 。
(2)W的简单氢化物的熔沸点比R的高,原因是_____ 。
(3)Y、Z、R的最高价氧化物对应水化物的酸性最弱的是_____ (填化学式)。
X、Y、Z、R组成的某种酸的水溶液可用于检测溶液中的 ,该酸的化学式为
,该酸的化学式为_____ 。
(4)X、Y、W组成的某种常见物质常用于制作消毒剂,该物质的燃烧热为1366.8 ,写出该物质燃烧的热化学方程式:
,写出该物质燃烧的热化学方程式:_____ 。
(5) 与
与 的反应是可逆反应,该反应的平衡常数的表达式为
的反应是可逆反应,该反应的平衡常数的表达式为_____ ;增加 的量,
的量, 的平衡转化率如何变化?
的平衡转化率如何变化?_____ 。
(1)写出
 的电子式:
的电子式:(2)W的简单氢化物的熔沸点比R的高,原因是
(3)Y、Z、R的最高价氧化物对应水化物的酸性最弱的是
X、Y、Z、R组成的某种酸的水溶液可用于检测溶液中的
 ,该酸的化学式为
,该酸的化学式为(4)X、Y、W组成的某种常见物质常用于制作消毒剂,该物质的燃烧热为1366.8
 ,写出该物质燃烧的热化学方程式:
,写出该物质燃烧的热化学方程式:(5)
 与
与 的反应是可逆反应,该反应的平衡常数的表达式为
的反应是可逆反应,该反应的平衡常数的表达式为 的量,
的量, 的平衡转化率如何变化?
的平衡转化率如何变化?
您最近一年使用:0次
名校
解题方法
4 . 甲醇是一种可再生能源,用途广泛。请回答下列问题:
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为________ 。
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
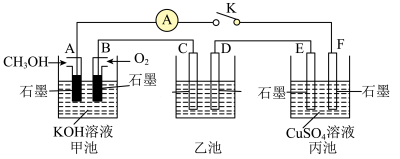
①A电极的电极反应式为________ ,C电极的电势________ (填“低于”或“高于”)D电极的电势。
②若在乙池中实现铁表面镀银,则D电极材料为________ ,乙池中的溶液为________ 。
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入________ (填字母)。
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是________ 。
(1)一种用CO2生产甲醇燃料的反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH=-akJ•mol-1。
已知:CH3OH(g)=CH3OH(l) ΔH=-bkJ•mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-ckJ•mol-1;
H2O(g)=H2O(l) ΔH=-dkJ•mol-1。
则表示CH3OH(l)摩尔燃烧焓的热化学方程式为
(2)用如图所示装置研究有关电化学问题,当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

①A电极的电极反应式为
②若在乙池中实现铁表面镀银,则D电极材料为
③丙池中装有200mL1mol•L-1硫酸铜溶液,若B电极消耗3.36L(标准状况)气体,若要使电解质溶液恢复到电解前的状态,应加入
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

根据图像分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
5 . 2020年东京奥运会火炬传递的火炬样式将采用樱花形状。奥运会火炬常用的燃料为丙烷、丁烷等。
已知:丙烷的燃烧热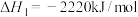 ;正丁烷的燃烧热
;正丁烷的燃烧热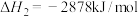 ,异丁烷的燃烧热
,异丁烷的燃烧热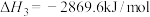 。
。
(1)写出丙烷燃烧热的热化学方程式:_______ 。
(2)下列有关说法不正确的是_______ (填标号)。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(3)已知A气体的燃烧热为30kJ/mol,B气体的燃烧热为500kJ/mol。现有6mol由A和B组成的混合气体,完全燃烧放出的热量是2000kJ,则该混合气体中气体A和气体B的物质的量之比是_______ 。
(4)Deacon直接氧化法可按下列催化过程进行:
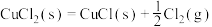
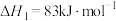
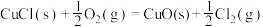


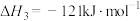
则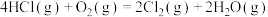 的
的
_______  。
。
(5)恒温恒容条件下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应: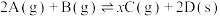 ,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为
,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为 。
。
①从开始反应至达到平衡状态,生成C的平均反应速率为_______ 。
②
_______ 。
③下列各项可作为该反应达到平衡状态的标志的是_______ (填字母)。
A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1 D.A的百分含量保持不变
已知:丙烷的燃烧热
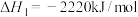 ;正丁烷的燃烧热
;正丁烷的燃烧热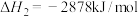 ,异丁烷的燃烧热
,异丁烷的燃烧热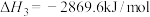 。
。(1)写出丙烷燃烧热的热化学方程式:
(2)下列有关说法不正确的是
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(3)已知A气体的燃烧热为30kJ/mol,B气体的燃烧热为500kJ/mol。现有6mol由A和B组成的混合气体,完全燃烧放出的热量是2000kJ,则该混合气体中气体A和气体B的物质的量之比是
(4)Deacon直接氧化法可按下列催化过程进行:
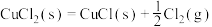
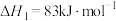
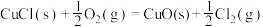


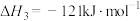
则
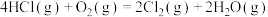 的
的
 。
。(5)恒温恒容条件下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:
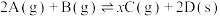 ,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为
,2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为 。
。①从开始反应至达到平衡状态,生成C的平均反应速率为
②

③下列各项可作为该反应达到平衡状态的标志的是
A.压强不再变化 B.气体密度不再变化
C.A的消耗速率与B的消耗速率之比为2∶1 D.A的百分含量保持不变
您最近一年使用:0次
10-11高二下·安徽马鞍山·期中
名校
解题方法
6 . 一些烷烃的燃烧热如下表:
下列说法正确的是
| 化合物 | ΔH/(kJ·mol-1) | 化合物 | ΔH/(kJ·mol-1) |
| 甲烷 | -891.0 | 正丁烷 | -2878.0 |
| 乙烷 | -1560.8 | 异丁烷 | -2869.6 |
| 丙烷 | -2221.5 | 2-甲基丁烷 | -3531.3 |
| A.正戊烷的燃烧热大约是3540 kJ·mol-1 |
| B.热稳定性:正丁烷>异丁烷 |
| C.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1560.8 kJ·mol-1 |
| D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
您最近一年使用:0次
2021-08-27更新
|
574次组卷
|
17卷引用:2010-2011学年安徽省马鞍山市第二中学高二下学期期中素质测试化学试卷
(已下线)2010-2011学年安徽省马鞍山市第二中学高二下学期期中素质测试化学试卷(已下线)2010—2011学年安徽省马鞍山二中高二下学期期中考试化学试卷(理科)江西省上饶市玉山县第一中学2015-2016学年高二下学期重点班第一次月考化学卷(已下线)2018年10月16日 《每日一题》人教选修4-燃烧热及表示燃烧热的热化学方程式(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点步步为赢 高二化学暑假作业:作业七 化学反应与能量黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题浙江省杭州市西湖高级中学2019-2020学年高二10月月考化学试题(已下线)考点08 化学反应中的能量变化——《备战2020年高考精选考点专项突破题集》宁夏银川一中2020-2021学年高二上学期期末考试化学试题河南省洛阳市豫西名校2020-2021学年高二下学期第一次联考化学试题第23届(2009年)全国高中学生化学竞赛(安徽赛区)初赛试题(已下线)1.1.3 能源的充分利用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1) 福建省龙岩市武平县第一中学2021-2022学年高二上学期9月月考化学试题(已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)河南省信阳市2021-2022学年高二上学期期中考试化学试题湖北省部分重点中学2022-2023学年高三下学期2月质量检测化学试题
名校
解题方法
7 . 为减小和消除过量 和
和 对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对
对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 和
和 创新利用的研究。
创新利用的研究。
(1)25℃、101KPa条件下充分燃烧一定量的丁烷气体放出热量为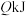 ,经测定,将生成的
,经测定,将生成的 通入足量澄清石灰水中产生40g白色沉淀,写出表示丁烷燃烧热的热化学方程式
通入足量澄清石灰水中产生40g白色沉淀,写出表示丁烷燃烧热的热化学方程式_______ 。
(2)用 催化还原
催化还原 还可以消除氮氧化物的污染。例如:
还可以消除氮氧化物的污染。例如:
 ;
;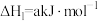
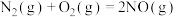 ;
;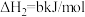
若用1mol 还原
还原 至
至 ,则该反应过程中的反应热
,则该反应过程中的反应热
___ 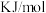 (用含a、b的式子表示)
(用含a、b的式子表示)
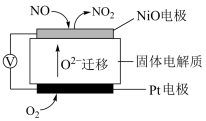
(3)通过 传感器可监测
传感器可监测 的含量,其工作原理示意图为:
的含量,其工作原理示意图为: 电极上发生的是
电极上发生的是_______ (填“氧化”或“还原”)反应。写出 电极的电极反应式
电极的电极反应式_______ 。
 和
和 对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对
对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 和
和 创新利用的研究。
创新利用的研究。(1)25℃、101KPa条件下充分燃烧一定量的丁烷气体放出热量为
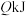 ,经测定,将生成的
,经测定,将生成的 通入足量澄清石灰水中产生40g白色沉淀,写出表示丁烷燃烧热的热化学方程式
通入足量澄清石灰水中产生40g白色沉淀,写出表示丁烷燃烧热的热化学方程式(2)用
 催化还原
催化还原 还可以消除氮氧化物的污染。例如:
还可以消除氮氧化物的污染。例如: ;
;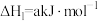
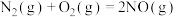 ;
;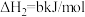
若用1mol
 还原
还原 至
至 ,则该反应过程中的反应热
,则该反应过程中的反应热
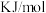 (用含a、b的式子表示)
(用含a、b的式子表示)(3)通过
 传感器可监测
传感器可监测 的含量,其工作原理示意图为:
的含量,其工作原理示意图为: 电极上发生的是
电极上发生的是 电极的电极反应式
电极的电极反应式
您最近一年使用:0次
名校
解题方法
8 . 下列热化学方程式正确的是
A.理论上1 kg黄铁矿(FeS2的含量为84%)完全燃烧放出的热量5950 kJ,则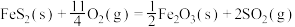 △H=-850 kJ/mol △H=-850 kJ/mol |
B.500℃、30 MPa下,将0.5 molN2(g)和1.5 molH2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为 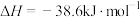 |
| C.稀盐酸和NaOH溶液反应的中和热△H=-57.3 kJ/mol,则稀H2SO4和Ba(OH)2溶液反应的中和热为2×57.3 kJ/mol |
D.甲烷的燃烧热△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: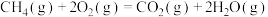 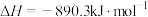 |
您最近一年使用:0次
解题方法
9 . 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量_______ (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是_______ 。
(2)在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式_______ 。
(3)已知①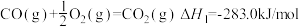
②H2(g)+ O2(g)=H2O(l) ΔH2=-285.8kJ/mol
O2(g)=H2O(l) ΔH2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=_______ 。
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量
(2)在25℃、101kPa下,1克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式
(3)已知①
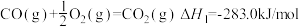
②H2(g)+
 O2(g)=H2O(l) ΔH2=-285.8kJ/mol
O2(g)=H2O(l) ΔH2=-285.8kJ/mol③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=
您最近一年使用:0次
解题方法
10 . 汽车等交通工具为出行、物流等带来方便。然而,燃油车排放的汽车尾气中含有大量的有害物质,会对人体健康和环境产生危害。
(1)汽油在不同空燃比(空气与燃油气的体积比)时尾气的主要成分不同,空燃比较小时的有毒气体主要是_______ (填化学式)
(2)辛烷(C8H18)是汽油的主要成分之一,已知辛烷的燃烧热 ,请写出表示辛烷燃烧热的热化学方程式
,请写出表示辛烷燃烧热的热化学方程式_______ 。
(3)空气中的氮气和氧气在汽车汽缸内的高温环境下,通过电火花放电生成有毒气体NO,反应的热化学方程式: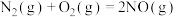
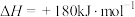 。已知:N2、O2分子中化学键的键能分别是946
。已知:N2、O2分子中化学键的键能分别是946 、497
、497 。请计算NO分子中化学键的键能为
。请计算NO分子中化学键的键能为_______  。
。
(4)为减轻污染,现在汽车上都安装三元催化转化器,可实现反应: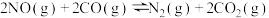
 。则该反应在
。则该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行。
(5)将NO和CO以一定的流速通过两种不同的催化剂进行反应,经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。
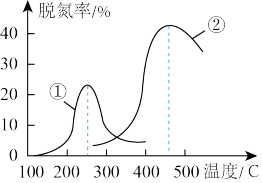
以下说法不正确的是_______。
(1)汽油在不同空燃比(空气与燃油气的体积比)时尾气的主要成分不同,空燃比较小时的有毒气体主要是
(2)辛烷(C8H18)是汽油的主要成分之一,已知辛烷的燃烧热
 ,请写出表示辛烷燃烧热的热化学方程式
,请写出表示辛烷燃烧热的热化学方程式(3)空气中的氮气和氧气在汽车汽缸内的高温环境下,通过电火花放电生成有毒气体NO,反应的热化学方程式:
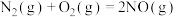
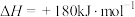 。已知:N2、O2分子中化学键的键能分别是946
。已知:N2、O2分子中化学键的键能分别是946 、497
、497 。请计算NO分子中化学键的键能为
。请计算NO分子中化学键的键能为 。
。(4)为减轻污染,现在汽车上都安装三元催化转化器,可实现反应:
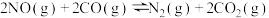
 。则该反应在
。则该反应在(5)将NO和CO以一定的流速通过两种不同的催化剂进行反应,经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。

以下说法不正确的是_______。
| A.曲线②中催化剂脱氮率比曲线①中的高 |
| B.曲线②中的催化剂适用于450℃左右脱氢 |
| C.曲线①、②最高点表示此时平衡转化率 |
| D.若低于200℃,图中曲线①脱氮率随温度升高而变化不大的主要原因是催化剂的活性不高 |
您最近一年使用:0次



