1 . 一些烷烃的燃烧热如下表:
已知:正戊烷与 互为同分异构体。下列说法正确的是
互为同分异构体。下列说法正确的是
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 |  | 正丁烷 | 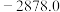 |
| 乙烷 |  | 异丁烷 |  |
| 丙烷 |  |  | 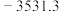 |
 互为同分异构体。下列说法正确的是
互为同分异构体。下列说法正确的是A.热稳定性: |
B.正戊烷的燃烧热 |
C.乙烷燃烧的热化学方程式为  |
| D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
您最近一年使用:0次
名校
2 . 一些烷烃的燃烧热如下表:
下列表达正确的是( )
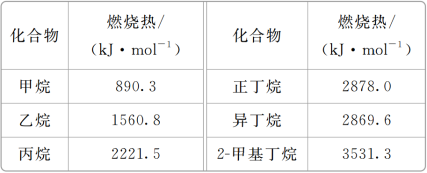
下列表达正确的是( )
| A.乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-1560.8 kJ·mol-1 |
| B.稳定性:正丁烷>异丁烷 |
| C.正戊烷的燃烧热大于3531.3 kJ·mol-1 |
| D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
您最近一年使用:0次
名校
解题方法
3 . 随着人类对环境问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视,目前工业上有一种方法可用CO2来生产燃料甲醇。
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,甲醇的燃烧热为:___ ;
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇。已知H2的燃烧热为:H=-285.8kJ/mol,又知:H2O(l)=H2O(g) H=+44kJ/mol,写出工业上以CO2、H2合成CH3OH和气态水的热化学方程式:____ ;
(3)该转化的积极意义是____ ;
(4)有人提出,可以设计反应CO2=C+O2(△H>0、△S<0)来消除CO2对环境的影响。请你判断是否可行并说出理由:___ 。
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,甲醇的燃烧热为:
(2)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇。已知H2的燃烧热为:H=-285.8kJ/mol,又知:H2O(l)=H2O(g) H=+44kJ/mol,写出工业上以CO2、H2合成CH3OH和气态水的热化学方程式:
(3)该转化的积极意义是
(4)有人提出,可以设计反应CO2=C+O2(△H>0、△S<0)来消除CO2对环境的影响。请你判断是否可行并说出理由:
您最近一年使用:0次
名校
4 . 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH = -196.6 kJ/mol。请回答下列问题:
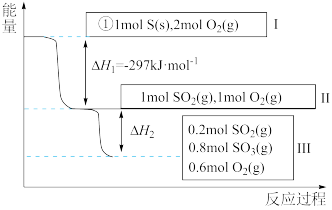
(1)写出能表示硫的燃烧热的热化学方程式:____ 。
(2)状态Ⅱ到状态Ⅲ放出的热量为____ 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣______ (填“大”、“小”或“相等”)。
(4)反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数表达式______ ;若状态Ⅲ处于平衡状态,保持温度不变,将容器体积迅速增大到原来2倍,则此时v(正)_____ v(逆)(填“>”、“<”或“=”)。
(5)恒容条件下,在状态Ⅱ时采取下列措施,能使n(SO3)/ n(SO2)增大的有___ 。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是______ ;图中表示平衡混合物中SO3的含量最高的一段时间是______ 。


(1)写出能表示硫的燃烧热的热化学方程式:
(2)状态Ⅱ到状态Ⅲ放出的热量为
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣
(4)反应2SO2(g)+O2(g)⇌2SO3(g)的平衡常数表达式
(5)恒容条件下,在状态Ⅱ时采取下列措施,能使n(SO3)/ n(SO2)增大的有
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是

您最近一年使用:0次
名校
解题方法
5 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请问该化学反应属于___ (放热或吸热)反应,请写出该反应的热化学方程式:___ 。

②上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为285.8kJ·mol-1,请写出氢气的燃烧热热化学方程式:___ 。
①如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请问该化学反应属于

②上述反应用到的氢气是一种清洁燃料,已知氢气的燃烧热为285.8kJ·mol-1,请写出氢气的燃烧热热化学方程式:
您最近一年使用:0次
2020-11-18更新
|
94次组卷
|
3卷引用:西藏自治区日喀则市第二高级中学2020-2021学年高二上学期期中考试化学试题
6 . I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
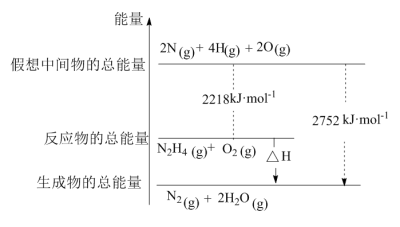
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________ ,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为 __________ 。
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________ 。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
则平衡时容器的体积V甲____________ V丙,平衡常数K丙_________ K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)⇌ H2NCOONH4(氨基甲酸铵)(l) △H1,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________ 。

(1)肼(N2H4)是一种高能燃料,写出肼的电子式

(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol•L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol•L-1•min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)⇌ H2NCOONH4(氨基甲酸铵)(l) △H1,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:

您最近一年使用:0次
18-19高一下·江西南昌·阶段练习
名校
7 . (1)煤燃烧的烟气(主要污染物SO2、NOx),经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)═NO2(g)+O2(g) △H=-200.9kJ•mol-1
NO(g)+ O2(g)═NO2(g) △H= -58.2kJ•mol-1
O2(g)═NO2(g) △H= -58.2kJ•mol-1
SO2(g)+O3(g)═SO3(g)+O2(g) △H=-241.6kJ•mol-1
(1)反应3NO(g)+O3(g)═3NO2(g)的△H=_______
(2)在标准状况下的11.2L甲烷完全燃烧生成 和液态水放出444.8 kJ•mol-1热量,能表示其燃烧热的热化学方程式的是
和液态水放出444.8 kJ•mol-1热量,能表示其燃烧热的热化学方程式的是____________
(3)中和热的测定是高中重要的定量实验,取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:

①从如图实验装置看,其中尚缺少的一种玻璃用品是______ ,除此之外,装置中的一个明显错误是______
②若0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=______ (取小数点后一位)。
NO(g)+O3(g)═NO2(g)+O2(g) △H=-200.9kJ•mol-1
NO(g)+
 O2(g)═NO2(g) △H= -58.2kJ•mol-1
O2(g)═NO2(g) △H= -58.2kJ•mol-1SO2(g)+O3(g)═SO3(g)+O2(g) △H=-241.6kJ•mol-1
(1)反应3NO(g)+O3(g)═3NO2(g)的△H=
(2)在标准状况下的11.2L甲烷完全燃烧生成
 和液态水放出444.8 kJ•mol-1热量,能表示其燃烧热的热化学方程式的是
和液态水放出444.8 kJ•mol-1热量,能表示其燃烧热的热化学方程式的是(3)中和热的测定是高中重要的定量实验,取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:

①从如图实验装置看,其中尚缺少的一种玻璃用品是
②若0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=
| 项目 | 反应起始温度T1(℃) | 终止温度T2(℃) | T2-T1 | ||
| HCl | NaOH | 平均温度 | |||
| 第1次 | 26.2 | 26.0 | 29.4 | ||
| 第2次 | 27.0 | 27.4 | 32.2 | ||
| 第3次 | 25.9 | 25.9 | 29.1 | ||
| 第4次 | 26.4 | 26.2 | 29.7 | ||
您最近一年使用:0次
8 . 为减少交通事故,新交规明令禁止酒后驾车并对酒后驾车行为予以重罚。为检验驾驶员是否酒后驾车,可采用的检验方法有多种。回答以下问题:
(1)早期曾经采用五氧化二碘和某种高分子化合物X的混合溶液来检测酒精的存在。理是:I2O5与CH3CH2OH先发生反应(I2O5+5CH3CH2OH=I2+5Y+5H2O),生成的I2与高分子化合物X作用而变蓝。交警依据此原理来检测驾驶员是否饮酒。则:X的化学式是_____________ ;Y的化学式是_________ ;
(2)已知:I2O5是白色固体,可用于检验并定量测定空气中CO;两者在常温条件下发生的反应为5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应);某同学设计如图实验装置完成上述目的。
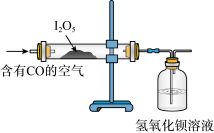
①指出能证明空气中有CO存在的现象:_____________ 。
②将上述反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗vmLcmol·L﹣1Na2S2O3溶液,则该空气样品中CO的体积分数是________ 。
③有同学提出只要依据参与反应的空气体积和洗气瓶中白色沉淀的质量也可求得空气中CO。此方案是否可行?_________ 。
(3)燃料电池酒精检测仪(该电池以硫酸溶液为电解质溶液)也是检测酒精含量的一种方法。总反应是:CH3CH2OH+O2=CH3COOH+H2O。该电池负极电极反应式是________________ 。
(4)酒精是一种较为环保的燃料,298K时,1g乙醇完全燃烧放出热量qkJ,写出乙醇燃烧的热化学方程式________ 。
(1)早期曾经采用五氧化二碘和某种高分子化合物X的混合溶液来检测酒精的存在。理是:I2O5与CH3CH2OH先发生反应(I2O5+5CH3CH2OH=I2+5Y+5H2O),生成的I2与高分子化合物X作用而变蓝。交警依据此原理来检测驾驶员是否饮酒。则:X的化学式是
(2)已知:I2O5是白色固体,可用于检验并定量测定空气中CO;两者在常温条件下发生的反应为5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应);某同学设计如图实验装置完成上述目的。

①指出能证明空气中有CO存在的现象:
②将上述反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗vmLcmol·L﹣1Na2S2O3溶液,则该空气样品中CO的体积分数是
③有同学提出只要依据参与反应的空气体积和洗气瓶中白色沉淀的质量也可求得空气中CO。此方案是否可行?
(3)燃料电池酒精检测仪(该电池以硫酸溶液为电解质溶液)也是检测酒精含量的一种方法。总反应是:CH3CH2OH+O2=CH3COOH+H2O。该电池负极电极反应式是
(4)酒精是一种较为环保的燃料,298K时,1g乙醇完全燃烧放出热量qkJ,写出乙醇燃烧的热化学方程式
您最近一年使用:0次
名校
解题方法
9 . 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) ΔH1<0①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0③
2H2(g)+O2(g)=2H2O(g) ΔH4<0④
则途径Ⅰ放出的热量___ (填“>”“=”或“<”),途径Ⅱ放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是___ 。
(2)甲醇(CH3OH)是一种可再生能源,具有开发和应用的广阔前景。在25℃、101kPa下,1g甲醇完全燃烧放热22.68kJ,写出甲醇燃烧热的热化学方程式:___ 。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2 TiCl4+2CO。
TiCl4+2CO。
已知:
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=___ 。
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ•mol-1。
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ•mol-1,当有2molO3完全反应转化为O2时,放出的热量为___ 。
(1)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g) ΔH1<0①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0③
2H2(g)+O2(g)=2H2O(g) ΔH4<0④
则途径Ⅰ放出的热量
(2)甲醇(CH3OH)是一种可再生能源,具有开发和应用的广阔前景。在25℃、101kPa下,1g甲醇完全燃烧放热22.68kJ,写出甲醇燃烧热的热化学方程式:
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2
 TiCl4+2CO。
TiCl4+2CO。已知:
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ•mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ•mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(4)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ•mol-1。
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ•mol-1,当有2molO3完全反应转化为O2时,放出的热量为
您最近一年使用:0次
10 . 把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)=CO2(g);ΔH1=-393.15kJ·mol-1 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g) +H2(g);ΔH2 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g);ΔH3=-566kJ·mol-1 ③
2H2(g)+O2(g)=2H2O(g);ΔH4=-484kJ·mol-1 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_______ (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH2=______ 。
(3)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减 少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1,NO(g)+ O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=
O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=________ 。
(4)在标准状况下的11.2L甲烷完全燃烧生成CO2和液态水放出444.8kJ热量(298K),能表示其燃烧热的热化学方程式是________ ;已知断裂1mol下列化学键需要吸收的能量分别为:C=O:745kJ;O=O键:496kJ;C-H键:414kJ,则断裂1molH-O键需要吸收的能量为_______ 。
途径Ⅰ:C(s)+O2(g)=CO2(g);ΔH1=-393.15kJ·mol-1 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g) +H2(g);ΔH2 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g);ΔH3=-566kJ·mol-1 ③
2H2(g)+O2(g)=2H2O(g);ΔH4=-484kJ·mol-1 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上
(2)ΔH2=
(3)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减 少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1,NO(g)+
 O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=
O2(g)=NO2(g) ΔH2=-58.2kJ·mol-1,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的ΔH=(4)在标准状况下的11.2L甲烷完全燃烧生成CO2和液态水放出444.8kJ热量(298K),能表示其燃烧热的热化学方程式是
您最近一年使用:0次
2019-11-06更新
|
248次组卷
|
2卷引用:四川省邻水实验学校2019-2020学年高二上学期第一次月考化学试题



