1 . 已知:2H2(g)+O2(g)=2H2O(g) ΔH1
3H2(g)+ Fe2O3(s)=2Fe(s)+ 3H2O(g) ΔH2
2Fe(s)+ 1.5O2(g)=Fe2O3(s) ΔH3
2Al(s)+ 1.5O2(g)=A12O3(S) ΔH4
2Al(s)+ Fe2O3(s)=Al2O3(s)+ 2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
3H2(g)+ Fe2O3(s)=2Fe(s)+ 3H2O(g) ΔH2
2Fe(s)+ 1.5O2(g)=Fe2O3(s) ΔH3
2Al(s)+ 1.5O2(g)=A12O3(S) ΔH4
2Al(s)+ Fe2O3(s)=Al2O3(s)+ 2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
| A.ΔH1<0,ΔH3>0 | B.ΔH5<0,ΔH4<ΔH3 |
| C.ΔH1=ΔH2+ΔH3 | D.ΔH3=ΔH4+ΔH5 |
您最近一年使用:0次
2022-05-10更新
|
3290次组卷
|
53卷引用:【校级联考】福建省闽侯二中五校教学联合体2017-2018学年高二上学期期中考试化学试题
【校级联考】福建省闽侯二中五校教学联合体2017-2018学年高二上学期期中考试化学试题福建省福州市八县(市、区)一中2021-2022学年高二上学期期中联考化学试题2015-2016学年陕西西藏民族学院附中高二下期末化学卷四川省成都石室中学2017-2018学年高二10月月考化学试题重庆市南开中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二上学期期中考试模拟化学试题湖南省儋州一中2018-2019学年高二上学期第一次月考化学试题【校级联考】浙江省“温州十五校联合体”2018-2019学年高二下学期期中考试化学试题湖南省衡阳市第一中学2019-2020学年高二上学期第一次月考化学试题江西省赣州市寻乌中学2019-2020学年高二上学期第二次段考化学试题(已下线)1.2.1 盖斯定律(练习)——2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)(已下线)1.3.2 反应热的计算(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第一章 化学反应与能量(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)1.3.2+反应热的计算-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)江苏省无锡市普通高中2018-2019学年高二下学期期末质量调研化学试题广东省揭阳市揭东区2021-2022学年高二上学期期末考试化学试题(已下线)化学反应的热效应——进阶学习(已下线)1.2 反应热的计算-同步学习必备知识江西省金溪县第一中学2022-2023年度高二上学期第一次月考化学试题吉林省九台龙成实验学校2022-2023学年高二上学期第一次月考化学试题作业(三) 反应焓变的计算宁夏回族自治区中宁县第一中学2022-2023学年高二上学期10月月考化学试题四川省什邡中学2023-2024学年高二上学期10月月考化学试题新疆乌鲁木齐市第八中学2023-2024学年高二上学期期中考试化学试题2015届江苏省连云港等四市高三一模化学试卷2016届江苏省泰州中学高三上学期第二次质检化学试卷2016届黑龙江省大庆一中高三下开学考试理综化学试卷2016届江西省宜春市丰城中学高三上学期第四次月考化学试卷2015-2016学年黑龙江大庆市铁人中学高一下期中化学试卷2017届黑龙江省哈尔滨六中高三上9月月考化学试卷黑龙江省青冈县一中2016-2017学年高一下学期期末考试化学试题(已下线)2018年9月16日 《每日一题》一轮复习- 每周一测(已下线)2019年9月11日《每日一题》2020年一轮复习—— 反应热的计算人教版高中化学必修2第二章《化学反应与能量》测试题2019-2020学年人教版高中化学高考基础复习专题8《水溶液中的离子平衡》测试卷【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】(已下线)专题6.1 化学能与热能(讲)——2020年高考化学一轮复习讲练测辽宁省瓦房店市高级中学2019-2020学年高一下学期期末考试化学试题辽宁师范大学附属中学2018-2019学年高一下学期期末考试化学试题(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第15讲 化学反应的热效应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向18 化学反应与能量变化-备战2022年高考化学一轮复习考点微专题(已下线)第14周 晚练题-备战2022年高考化学周测与晚练(新高考专用)广东省广州市广东华侨中学2021-2022学年高一下学期期中考试化学试题江苏省南京市金陵中学2021-2022学年高一下学期6月月考化学试题(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题六 化学反应与能量 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题十 化学能与热能-实战高考·二轮复习核心突破(已下线)专题15 反应热计算的几种类型-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第2讲 盖斯定律 反应热的计算
名校
解题方法
2 . O2对人类有着重要的作用。请回答下列问题:
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=___ 。
(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g) MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=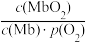 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
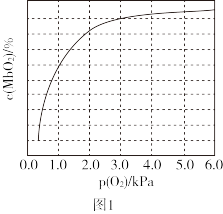
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=___ kPa。
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g) HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压___ (填“较高”或“较低”)有利于CO2排出体外。请你从平衡移动的角度解释原因___ 。
(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作析氯电极 ,本身不参与电解。已知:3NaClO+CO(NH2)2=3NaCl+2H2O+N2↑+CO2↑。

①氮原子的核外电子排布式___ 。
②电解过程中钌钛电极上发生反应为___ 。
③电解过程中不锈钢电极附近pH___ (填“降低”“升高”或“不变”)。
④标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目___ 。
(1)甲醇是一种绿色可再生能源,已知热化学方程式:
ⅰ.2CO(g)+O2(g)=2CO2(g) ΔH1=-566.0kJ•mol-1
ⅱ.2H2(g)+O2(g)=2H2O(g) ΔH2=-483.0kJ•mol-1
ⅲ.CO(g)+2H2(g)=CH3OH(g) ΔH3=-574.0kJ•mol-1
则计算CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g)的ΔH=
O2(g)=CO2(g)+2H2O(g)的ΔH=(2)人体内化学反应时刻需要O2参与,如肌肉中的肌红蛋白(Mb),具有结合O2的能力,可表示为Mb(aq)+O2(g)
 MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=
MbO2(aq)。肌红蛋白的结合度(即转化率α)与平衡时的氧气分压p(O2)密切相关,其变化曲线如图1。已知K=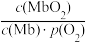 (气体和溶液中的溶质分别用分压和物质的量浓度表达)。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)。
①37℃时,已知平衡常数K=2,测得人正常呼吸时α的最大值为98%,则空气中氧气分压p(O2)=
②血红蛋白Hb结合O2形成动脉血,存在反应1:HbH+(aq)+O2(g)
 HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O
HbO2(aq)+H+(aq)。血液中还同时存在反应2:CO2+H2O H++HCO
H++HCO ,结合两个反应,肺部氧分压
,结合两个反应,肺部氧分压(3)游泳池水质普遍存在尿素[CO(NH2)2]超标现象,一种电化学除游泳池中尿素的实验装置如图2所示,其中钌钛常用作

①氮原子的核外电子排布式
②电解过程中钌钛电极上发生反应为
③电解过程中不锈钢电极附近pH
④标准状况下,电解过程中每逸出22.4L N2,电路中至少通过电子数目
您最近一年使用:0次
名校
3 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
则25℃时 和
和 (石墨,s)生成
(石墨,s)生成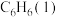 的热化学方程式为
的热化学方程式为_______ 。
(2)一氧化碳与氢气的反应历程如图,其中吸附在催化剂表面上的物种用*标注。
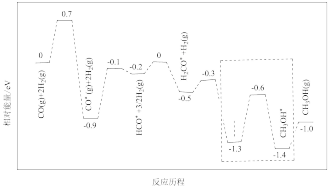
①该反应历程中控速步骤的能垒为_______ eV。
②写出虚线框内发生的化学反应方程式_______ 。
(3)105℃时,将足量的某碳酸氢盐(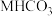 )固体置于真空恒容容器中,存在如下平衡:
)固体置于真空恒容容器中,存在如下平衡: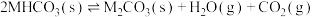 。上述反应达平衡时体系的总压为
。上述反应达平衡时体系的总压为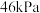 ,以分压表示的平衡常数
,以分压表示的平衡常数
_______  (注:分压=总压×物质的量分数);保持温度不变,开始时在体系中先通入一定量的
(注:分压=总压×物质的量分数);保持温度不变,开始时在体系中先通入一定量的 ,再加入足量
,再加入足量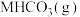 ,欲使平衡时体系中水蒸气的分压小于
,欲使平衡时体系中水蒸气的分压小于 ,
, 的初始压强应大于
的初始压强应大于_______  。
。
(4)我国科学家研究 电池,取得了重大科研成果,回答下列问题:
电池,取得了重大科研成果,回答下列问题:
 电池中,
电池中, 为单质锂片,则该电池中的
为单质锂片,则该电池中的 在
在_______ (填“正”或“负”)极发生电化学反应。研究表明,该电池总反应式为: ,且
,且 电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ. ;Ⅱ.
;Ⅱ.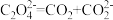 ;Ⅲ.
;Ⅲ._______ ;Ⅳ.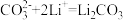
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
| 物质 |  |  (石墨,s) (石墨,s) | 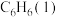 |
| 燃烧热△H(KJ/mol) | a | b | c |
 和
和 (石墨,s)生成
(石墨,s)生成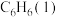 的热化学方程式为
的热化学方程式为(2)一氧化碳与氢气的反应历程如图,其中吸附在催化剂表面上的物种用*标注。

①该反应历程中控速步骤的能垒为
②写出虚线框内发生的化学反应方程式
(3)105℃时,将足量的某碳酸氢盐(
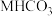 )固体置于真空恒容容器中,存在如下平衡:
)固体置于真空恒容容器中,存在如下平衡: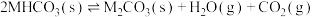 。上述反应达平衡时体系的总压为
。上述反应达平衡时体系的总压为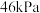 ,以分压表示的平衡常数
,以分压表示的平衡常数
 (注:分压=总压×物质的量分数);保持温度不变,开始时在体系中先通入一定量的
(注:分压=总压×物质的量分数);保持温度不变,开始时在体系中先通入一定量的 ,再加入足量
,再加入足量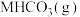 ,欲使平衡时体系中水蒸气的分压小于
,欲使平衡时体系中水蒸气的分压小于 ,
, 的初始压强应大于
的初始压强应大于 。
。(4)我国科学家研究
 电池,取得了重大科研成果,回答下列问题:
电池,取得了重大科研成果,回答下列问题: 电池中,
电池中, 为单质锂片,则该电池中的
为单质锂片,则该电池中的 在
在 ,且
,且 电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。Ⅰ.
 ;Ⅱ.
;Ⅱ.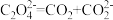 ;Ⅲ.
;Ⅲ.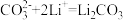
您最近一年使用:0次
名校
4 . Ⅰ.当今,世界多国相继规划了碳达峰、碳中和的时间节点,我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳的含量成为研究热点。近年我国大力加强温室气体 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:
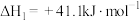

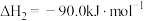
则 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:___________ 。
Ⅱ.工业上高炉炼铁中常见的反应为: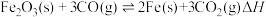
(2)某实验小组在实验室模拟上述反应。一定温皮下,在2L盛有 粉末的恒容密闭器中通入0.1mol
粉末的恒容密闭器中通入0.1mol ,5min时生成2.24gFe.0~5nin内用CO的浓度变化表示的平均反应速率是
,5min时生成2.24gFe.0~5nin内用CO的浓度变化表示的平均反应速率是___________  ;5min时
;5min时 的体积分数为
的体积分数为___________ 。
(3)上述反应的平衡常数表达式为K=___________ 。
(4)下列能说明该反应已经达到平衡状态的是___________ (填序号)。
a.容器内固体质量保持不变 b.容器中气体压强保持不变
c. d.
d.
(5)已知上述反应的平衡常数K与温度T(单位:K)之向的关系如图所示,其中直线的斜率为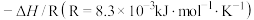 。
。
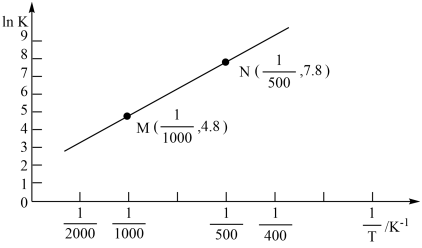
根据图象,试计算该反应的
___________  。
。
 催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。(1)已知:

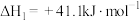

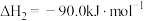
则
 催化氢化合成甲醇的热化学方程式:
催化氢化合成甲醇的热化学方程式:Ⅱ.工业上高炉炼铁中常见的反应为:
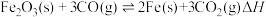
(2)某实验小组在实验室模拟上述反应。一定温皮下,在2L盛有
 粉末的恒容密闭器中通入0.1mol
粉末的恒容密闭器中通入0.1mol ,5min时生成2.24gFe.0~5nin内用CO的浓度变化表示的平均反应速率是
,5min时生成2.24gFe.0~5nin内用CO的浓度变化表示的平均反应速率是 ;5min时
;5min时 的体积分数为
的体积分数为(3)上述反应的平衡常数表达式为K=
(4)下列能说明该反应已经达到平衡状态的是
a.容器内固体质量保持不变 b.容器中气体压强保持不变
c.
 d.
d.
(5)已知上述反应的平衡常数K与温度T(单位:K)之向的关系如图所示,其中直线的斜率为
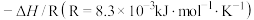 。
。
根据图象,试计算该反应的

 。
。
您最近一年使用:0次
5 . 根据题意解答
(1)已知甲醇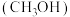 在常温下为液体,其热值为
在常温下为液体,其热值为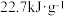 ,则甲醇的标准燃烧热的热化学方程式为
,则甲醇的标准燃烧热的热化学方程式为_______ 。
(2)发射卫星用 为燃料,
为燃料, 为氧化剂,两者反应生成
为氧化剂,两者反应生成 和水蒸气,已知
和水蒸气,已知
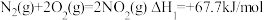
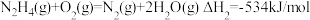
试写出 与
与 反应的热化学方程式
反应的热化学方程式_______ 。
(3)已知: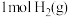 与
与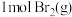 完全反应生成
完全反应生成 时放出
时放出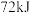 的热量,有关物质的相关数据如表,则表中a为
的热量,有关物质的相关数据如表,则表中a为_______
(4)将煤转化成水煤气的反应: 可有效提高能源利用率,若在上述反应体系中增大
可有效提高能源利用率,若在上述反应体系中增大 的浓度(其他条件保持不变),此反应的
的浓度(其他条件保持不变),此反应的
_______ (填“增大”、“减小”或“不变”)。
(5)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许_______ 离子通过,使用该离子交换膜的作用是_______ 。

(1)已知甲醇
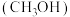 在常温下为液体,其热值为
在常温下为液体,其热值为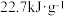 ,则甲醇的标准燃烧热的热化学方程式为
,则甲醇的标准燃烧热的热化学方程式为(2)发射卫星用
 为燃料,
为燃料, 为氧化剂,两者反应生成
为氧化剂,两者反应生成 和水蒸气,已知
和水蒸气,已知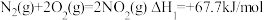
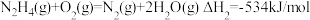
试写出
 与
与 反应的热化学方程式
反应的热化学方程式(3)已知:
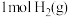 与
与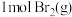 完全反应生成
完全反应生成 时放出
时放出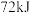 的热量,有关物质的相关数据如表,则表中a为
的热量,有关物质的相关数据如表,则表中a为| 化学键 |  | 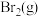 |  |
断裂 化学键需要吸收的能量/ 化学键需要吸收的能量/ | 436 | a | 369 |
 可有效提高能源利用率,若在上述反应体系中增大
可有效提高能源利用率,若在上述反应体系中增大 的浓度(其他条件保持不变),此反应的
的浓度(其他条件保持不变),此反应的
(5)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

您最近一年使用:0次
2022-03-20更新
|
108次组卷
|
2卷引用:福建省福州华侨中学2021-2022学年高二上学期期中考试化学试题
6 . 下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.放热反应不必加热就一定能发生 |
C.同温同压下, 在光照和点燃条件的 在光照和点燃条件的 不同 不同 |
| D.应用盖斯定律,可计算某些难以直接测量的反应的焓变 |
您最近一年使用:0次
2022-03-20更新
|
146次组卷
|
2卷引用:福建省福州华侨中学2021-2022学年高二上学期期中考试化学试题
解题方法
7 . 回答下列问题:
(1)在一 定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+C12(g) =2HCl(g) ΔH= - 184.6 kJ•mol-1;该反应属于___________ (填“热吸”或“放热”)反应 。
(2)常温常压下,1 mol乙醇完全燃烧生成CO2气体和液态水放出的热量为1367 kJ,写出乙醇燃烧热的热化学方程式:___________
(3)根据盖斯定律计算
P4(白磷,s)+5O2(g)=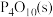 △H=-2983.2 kJ·mol-1 ①
△H=-2983.2 kJ·mol-1 ①
P(红磷,s)+ O2(g)=
O2(g)=
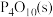 △H=-738.5 kJ·mol-1 ②
△H=-738.5 kJ·mol-1 ②
则白磷转化为红磷的热化学方程式为___________
(4)已知破坏1 mol H-H 键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ 。则由氢气和碘单质反应生成2molHI 需要放出___________ kJ 的热量。
(1)在一 定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+C12(g) =2HCl(g) ΔH= - 184.6 kJ•mol-1;该反应属于
(2)常温常压下,1 mol乙醇完全燃烧生成CO2气体和液态水放出的热量为1367 kJ,写出乙醇燃烧热的热化学方程式:
(3)根据盖斯定律计算
P4(白磷,s)+5O2(g)=
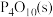 △H=-2983.2 kJ·mol-1 ①
△H=-2983.2 kJ·mol-1 ①P(红磷,s)+
 O2(g)=
O2(g)=
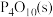 △H=-738.5 kJ·mol-1 ②
△H=-738.5 kJ·mol-1 ②则白磷转化为红磷的热化学方程式为
(4)已知破坏1 mol H-H 键、1 mol I-I键、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ 。则由氢气和碘单质反应生成2molHI 需要放出
您最近一年使用:0次
2022-03-19更新
|
980次组卷
|
2卷引用:福建省福州市协作体四校2021-2022学年高二上学期期中联考化学试题
名校
8 . 研究发现,NOx和SO2是雾霾的主要成分。
I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1
2CO(g)+O2(g) 2CO2(g) ΔH=-564kJ·mol-1
2CO2(g) ΔH=-564kJ·mol-1
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=
2CO2(g)+N2(g) ΔH=___ 。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中进行上题中的化学反应,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示。

①该反应的平衡常数表达式K=____ ;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将____ (填“向左”“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____ (填字母)。
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
II.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。已知:亚硫酸:Ka1=2.0×10-2,Ka2=6.0×10-7。
(3)请通过计算证明,NaHSO3溶液显酸性的原因(列出计算过程):____ 。
(4)如图所示的电解装置,酸性条件下,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____ ;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为____ g。

I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)
 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-12CO(g)+O2(g)
 2CO2(g) ΔH=-564kJ·mol-1
2CO2(g) ΔH=-564kJ·mol-1(1)2NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH=
2CO2(g)+N2(g) ΔH=(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中进行上题中的化学反应,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示。

①该反应的平衡常数表达式K=
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
II.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。已知:亚硫酸:Ka1=2.0×10-2,Ka2=6.0×10-7。
(3)请通过计算证明,NaHSO3溶液显酸性的原因(列出计算过程):
(4)如图所示的电解装置,酸性条件下,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为

您最近一年使用:0次
名校
解题方法
9 . 回答问题
(1) 分子可形成单斜硫和斜方硫,转化过程:S(s,单斜)
分子可形成单斜硫和斜方硫,转化过程:S(s,单斜) S(s,斜方)
S(s,斜方) 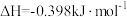 ,则S(单斜)、S(斜方)相比,较稳定的是
,则S(单斜)、S(斜方)相比,较稳定的是___________ (填“S(单斜)”或“S(斜方)”)。
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为 )
)
热化学方程式:
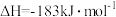 ,则
,则 的键能为
的键能为___________  。
。
(3)标准状况下,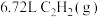 在O2(g)中完全燃烧生成
在O2(g)中完全燃烧生成 和
和 ,放出389.7kJ热量,请写出表示
,放出389.7kJ热量,请写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:___________
(4)已知:C(石墨)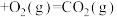
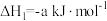
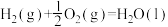
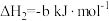

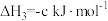
计算C(石墨)与 反应生成
反应生成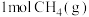 的
的 为
为___________  (用含a,b,c的式子表示)。
(用含a,b,c的式子表示)。
(5)由 和NO反应生成
和NO反应生成 和
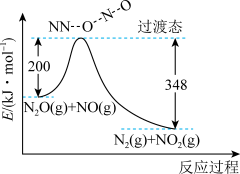
和 的能量变化如图所示。则反应过程中,每生成
的能量变化如图所示。则反应过程中,每生成 理论上放出的热量为
理论上放出的热量为___________ 。
(6)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图,请回答下列问题。
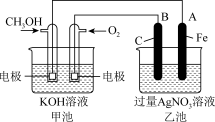
①乙池是___________ 装置(填“原电池”或“电解池”),A电极的名称是___________ ;B(石墨)电极的电极反应为:___________ 。
②甲池中通入 一极的电极反应式为:
一极的电极反应式为:___________ 。
(1)
 分子可形成单斜硫和斜方硫,转化过程:S(s,单斜)
分子可形成单斜硫和斜方硫,转化过程:S(s,单斜) S(s,斜方)
S(s,斜方) 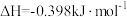 ,则S(单斜)、S(斜方)相比,较稳定的是
,则S(单斜)、S(斜方)相比,较稳定的是(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为
 )
)| 化学键 | H-H | H-Cl |
| 键能 | 436 | 431 |
热化学方程式:

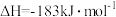 ,则
,则 的键能为
的键能为 。
。(3)标准状况下,
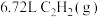 在O2(g)中完全燃烧生成
在O2(g)中完全燃烧生成 和
和 ,放出389.7kJ热量,请写出表示
,放出389.7kJ热量,请写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:(4)已知:C(石墨)
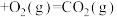
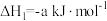
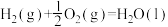
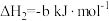

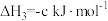
计算C(石墨)与
 反应生成
反应生成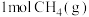 的
的 为
为 (用含a,b,c的式子表示)。
(用含a,b,c的式子表示)。(5)由
 和NO反应生成
和NO反应生成 和
和 的能量变化如图所示。则反应过程中,每生成
的能量变化如图所示。则反应过程中,每生成 理论上放出的热量为
理论上放出的热量为
(6)化学能与电能的相互转换有着重要的用途。如图是一个化学过程的示意图,请回答下列问题。

①乙池是
②甲池中通入
 一极的电极反应式为:
一极的电极反应式为:
您最近一年使用:0次
10 . 依据图示关系, 等于
等于
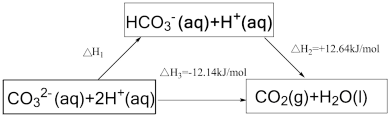
 等于
等于
A.+0.5 | B.-0.5 | C.+24.78 | D.-24.78 |
您最近一年使用:0次
2022-01-23更新
|
312次组卷
|
4卷引用:福建省福清市高中联合体2023-2024学年高二上学期期中考试化学试题



