1 . 乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
反应I(热裂解):CH3COOH(g) 2CO(g)+2H2(g)△H1
2CO(g)+2H2(g)△H1
反应II(脱羧基):CH3COOH(g) CH4(g)+CO2(g)△H2
CH4(g)+CO2(g)△H2
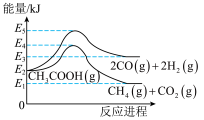
(1)△H1=___________ kJ/mol (用有关E的代数式表示);
(2)为提高H2的平衡产率,应选择的压强条件是_________ (填“高压”或“常压”);
(3)在不同温度下,向密闭容器中充入等量醋酸蒸汽,反应相同时间后,测得各气体的产率与温度的关系如图:
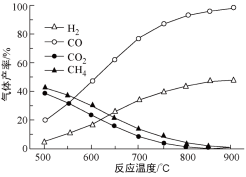
①约650℃之前,氢气产率低于甲烷的原因是;________________________________ ;
②约650℃之后,随着温度升高后,氢气产率高于甲烷的原因是:___________ ;(填编号)
a.反应II速率减慢
b.反应I速率加快的程度比反应II大
c.反应I正向移动,而反应II逆向移动
d.反应I正向移动的程度大于反应II正向移动的程度
③根据图像分析,该容器中一定发生了另外的副反应,理由是:______________ 。
(4)利用合适的催化剂使另外的副反应不发生。温度为TK,达到平衡时,总压强为PkPa,反应I消耗乙酸20%,反应II消耗乙酸50%,乙酸体积分数为__________ (计算结果保留l位小数,下同);反应II的平衡常数Kp为_________ (Kp为以分压表示的平衡常数,某物质分压=总压×该物质的体积分数)。
反应I(热裂解):CH3COOH(g)
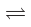 2CO(g)+2H2(g)△H1
2CO(g)+2H2(g)△H1反应II(脱羧基):CH3COOH(g)
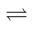 CH4(g)+CO2(g)△H2
CH4(g)+CO2(g)△H2
(1)△H1=
(2)为提高H2的平衡产率,应选择的压强条件是
(3)在不同温度下,向密闭容器中充入等量醋酸蒸汽,反应相同时间后,测得各气体的产率与温度的关系如图:

①约650℃之前,氢气产率低于甲烷的原因是;
②约650℃之后,随着温度升高后,氢气产率高于甲烷的原因是:
a.反应II速率减慢
b.反应I速率加快的程度比反应II大
c.反应I正向移动,而反应II逆向移动
d.反应I正向移动的程度大于反应II正向移动的程度
③根据图像分析,该容器中一定发生了另外的副反应,理由是:
(4)利用合适的催化剂使另外的副反应不发生。温度为TK,达到平衡时,总压强为PkPa,反应I消耗乙酸20%,反应II消耗乙酸50%,乙酸体积分数为
您最近一年使用:0次
2020-05-03更新
|
240次组卷
|
2卷引用:新疆乌鲁木齐市高级中学2024届高三上学期第一次模拟考试化学试题
名校
2 . 在“宏观——微观——符号”之间建立联系是化学学科特有的思维方式。如图是科研人员提出的HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程示意图(图中只画出了HAP的部分结构)。下列说法不正确的是
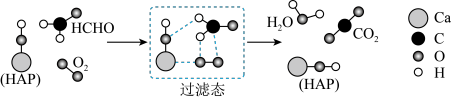

| A.HAP能降低HCHO与O2反应的活化能 |
B.该反应的化学方程式为HCHO+O2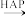 CO2+H2O CO2+H2O |
| C.反应过程中断裂或生成的的化学键类型均为极性共价键 |
| D.产物CO2分子中的氧原子不仅仅来源于O2 |
您最近一年使用:0次
2020-04-09更新
|
217次组卷
|
2卷引用:新疆乌鲁木齐市第八中学2020-2021学年高二上学期期末考试化学试题
解题方法
3 . 合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在10~30MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%~15%;最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成氨。下列有关说法中错误的是
| A.哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B.新法合成和哈伯法相比不需要在高温条件下,可节约大量能源 |
| C.新法合成能在常温下进行也需要断裂化学键 |
| D.新的催化剂降低了反应的活化能 |
您最近一年使用:0次
4 . 合成气用途非常广泛,可以煤、天然气等为原料生产。回答下列问题:
(1)用H2O(g)和O2重整CH4制合成气的热化学方程式如下:
(水蒸气重整)CH4(g)+ H2O(g)=CO(g)+3H2(g) ∆H=+ 206 kJ·mol-1
(氧气重整)CH4(g)+0.5O2(g)=CO(g)+2H2(g) ∆H=-36 kJ·mol-1
①2H2(g)+O2(g)=2H2O(g)的∆H=_______ kJ·mol-1。
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,理论上得到的合成气中n(CO): n(H2)=1 :____ (保留两位小数)。
③用水蒸气电催化重整甲烷的装置如图。装置工作时,O2-向_____ (填“A”或“B’)极迁移;阳极发生的电极反应为___________ 。_____ (填“大于”“等于”或“小于”)0。
②气体的总压强:a点_____ (填“大于”“等于”或“小于”)b点,理由是_________ 。
③c点时,反应C(s) +CO2(g) 2CO(g)的Kp=
2CO(g)的Kp=_____ (填数值)。
④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),图中d点处达到平衡时,CO的转化率为_______ ;达到平衡时,向容器中再充入0.5 mol CO、2 mol H2O(g),重新达到平衡时,CO的平衡转化率_______ (填“增大”“减小”或“不变”)。
(1)用H2O(g)和O2重整CH4制合成气的热化学方程式如下:
(水蒸气重整)CH4(g)+ H2O(g)=CO(g)+3H2(g) ∆H=+ 206 kJ·mol-1
(氧气重整)CH4(g)+0.5O2(g)=CO(g)+2H2(g) ∆H=-36 kJ·mol-1
①2H2(g)+O2(g)=2H2O(g)的∆H=
②为了保持热平衡,同时用两种方式重整,不考虑热量损失,理论上得到的合成气中n(CO): n(H2)=1 :
③用水蒸气电催化重整甲烷的装置如图。装置工作时,O2-向
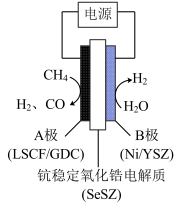

②气体的总压强:a点
③c点时,反应C(s) +CO2(g)
 2CO(g)的Kp=
2CO(g)的Kp=④在恒容密闭容器中充入0. 5 mol CO、2 mol H2O(g)只发生反应(II),图中d点处达到平衡时,CO的转化率为
您最近一年使用:0次
2020-03-27更新
|
100次组卷
|
2卷引用:新疆和田地区皮山县2022-2023学年高二上学期11月期中考试化学试题
19-20高二·浙江·期末
解题方法
5 . 亚硝酸钠( )是一种工业盐,以下为亚硝酸钠的生产流程:
)是一种工业盐,以下为亚硝酸钠的生产流程:
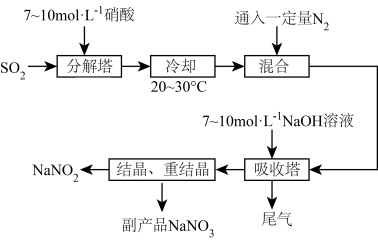
(1)在分解塔中 从塔底进入,硝酸从塔顶喷淋,其目的是
从塔底进入,硝酸从塔顶喷淋,其目的是_____________ 。
(2)按一定计量比在“分解塔”中通 和喷入硝酸,若反应后生成的NO与
和喷入硝酸,若反应后生成的NO与 物质的量之比恰好
物质的量之比恰好 ,则“分解塔”中发生反应的化学方程式为
,则“分解塔”中发生反应的化学方程式为________________
(3)试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因:_________________ 。
 )是一种工业盐,以下为亚硝酸钠的生产流程:
)是一种工业盐,以下为亚硝酸钠的生产流程:
(1)在分解塔中
 从塔底进入,硝酸从塔顶喷淋,其目的是
从塔底进入,硝酸从塔顶喷淋,其目的是(2)按一定计量比在“分解塔”中通
 和喷入硝酸,若反应后生成的NO与
和喷入硝酸,若反应后生成的NO与 物质的量之比恰好
物质的量之比恰好 ,则“分解塔”中发生反应的化学方程式为
,则“分解塔”中发生反应的化学方程式为(3)试从产物产率的角度分析该反应中硝酸的浓度不宜过大或过小的原因:
您最近一年使用:0次
6 . 在好氧菌和厌氧菌作用下,废液中 能转化为
能转化为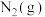 和
和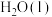 ,示意图如下:
,示意图如下:
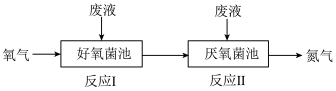
反应Ⅰ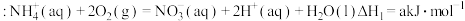
反应Ⅱ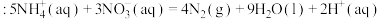

下列说法正确的是( )
 能转化为
能转化为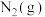 和
和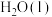 ,示意图如下:
,示意图如下: 
反应Ⅰ
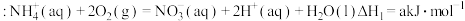
反应Ⅱ
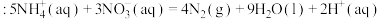

下列说法正确的是( )
| A.两池发生的反应中,氮元素只被氧化 |
B.两池中投放的废液体积相等时, 能完全转化为 能完全转化为 |
C.常温常压下,反应Ⅱ中生成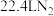 转移的电子数为 转移的电子数为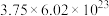 |
D.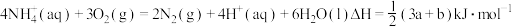 |
您最近一年使用:0次
2020-01-25更新
|
405次组卷
|
11卷引用:新疆乌鲁木齐市高级中学2023-2024学年高三上学期12月月考化学试题
新疆乌鲁木齐市高级中学2023-2024学年高三上学期12月月考化学试题新疆乌鲁木齐市高级中学2024届高三上学期12月月考化学江苏省南通、徐州、扬州、泰州、淮安、宿迁六市2018届高三第二次调研(二模)化学试题2020届高三化学二轮冲刺新题专练——盖斯定律的应用2(已下线)【新东方】 2020-11沪科版化学拓展性课程4《离子互换反应和氧化还原反应》测试题安徽省安庆市怀宁县怀宁中学2019-2020学年高一下学期期中考试化学试题安徽省淮南市第一中学2019-2020学年高一下学期期末考试化学试题江苏省启东中学2020-2021学年高二上学期第一次月考化学试题福建省福州市格致中学2022-2023学年高三上学期期中模拟测试化学试题重庆市松树桥中学校2023-2024学年高二上学期半期考试(期中)化学试题
名校
解题方法
7 . 下列过程中没有发生电子转移的是( )
| A.液氨作制冷剂 | B.合成氨 | C.大气固氮 | D.生物固氮 |
您最近一年使用:0次
2020-01-04更新
|
195次组卷
|
4卷引用:新疆乌鲁木齐市第十中学2024届高三下学期3月份第一次模拟考试化学试卷
名校
解题方法
8 . 课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g) 2NH3(g)△H<0,△S<0。
2NH3(g)△H<0,△S<0。
(1)下列关于工业合成氨的说法不正确的是___
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是___ 。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3 v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:
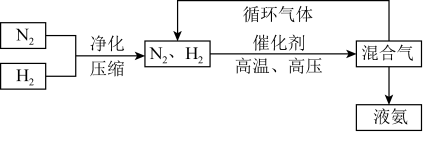
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因___ 。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2__ T1(填“>,<或=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是__ (填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①此条件下该反应的化学平衡常数K=__ 。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向___ 反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g) 2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为__ mol。
(6)已知:N2(g)+3H2(g) 2NH3(g)△H=-92kJ/mol
2NH3(g)△H=-92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式__ 。
 2NH3(g)△H<0,△S<0。
2NH3(g)△H<0,△S<0。(1)下列关于工业合成氨的说法不正确的是
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3 v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:

请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图像中T2和T1的关系是:T2
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向
③N2(g)+3H2(g)
 2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为
2NH3(g)△H=-92kJ/mol。在恒温恒容的密闭容器中充入1molN2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4kJ,容器内的压强变为原来的90%,则起始时充入的H2的物质的量为(6)已知:N2(g)+3H2(g)
 2NH3(g)△H=-92kJ/mol
2NH3(g)△H=-92kJ/molN2(g)+O2(g)=2NO(g) ΔH=+181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式
您最近一年使用:0次
名校
9 . 下列不能用勒沙特列原理解释的是
A.实验室用排饱和食盐水的方法收集 |
| B.硫酸工业中,使用过量的空气以提高二氧化硫的转化率 |
C.合成氨工业中,及时液化分离 ,并循环利用未反应完的 ,并循环利用未反应完的 和 和 |
| D.合成氨工业中,500℃比常温更有利于氨的合成 |
您最近一年使用:0次
2019-10-30更新
|
129次组卷
|
2卷引用:新疆乌鲁木齐市第四中学2019-2020学年高二上学期期中考试化学试题
名校
10 . 在合成氨工业中,能用勒夏特列原理解释的事实是
| A.催化剂使反应迅速达到平衡状态 | B.反应温度控制在500℃左右 |
| C.反应宜在高压下进行 | D.原料气需经过净化才能进入合成塔 |
您最近一年使用:0次
2019-10-24更新
|
326次组卷
|
4卷引用:新疆昌吉州教育共同体2020-2021学年高二上学期期末质量检测化学试题
新疆昌吉州教育共同体2020-2021学年高二上学期期末质量检测化学试题上海市金山中学2017-2018学年高二下学期期中考试(合格)化学试题上海市静安区2020届高三模拟化学试题(已下线)2.3.3 温度对化学平衡的影响(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)



