名校
解题方法
1 . 甲苯(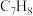 )和二甲苯(
)和二甲苯(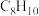 )是重要的化工原料。利用苯(
)是重要的化工原料。利用苯(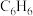 )和甲醇(
)和甲醇( )在催化剂作用下反应得到
)在催化剂作用下反应得到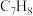 、
、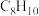 和副产物三甲苯(
和副产物三甲苯( ),发生的主要反应如下:
),发生的主要反应如下:
Ⅰ.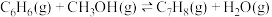
Ⅱ.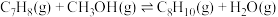
Ⅲ.
(1)500℃、0.18Mpa条件下,反应达到平衡时,结果如图所示。

①由图分析,随着投料比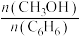 增加,
增加, 的平衡转化率
的平衡转化率_______ ,平衡时 的值
的值_______ 。(填“增大”、“减小”或“不变”)
②投料比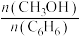 为1.0时,
为1.0时,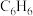 的平衡转化率为50%,产物中
的平衡转化率为50%,产物中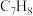 、
、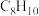 和
和 物质的量之比为6:3:1.
物质的量之比为6:3:1. 的平衡转化率为
的平衡转化率为_______ ,反应Ⅰ的平衡常数
_______ 。
(2)我国学者结合实验与计算机模拟结果,研究了反应Ⅰ在固体酸(HB)催化剂表面进行的反应历程如图所示。其中吸附在固体酸(HB)表面的物种用*标注。

①反应Ⅰ的
_______  。
。
②吸附 的焓变
的焓变_______ 吸附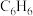 的焓变(填“>”或“<”)。
的焓变(填“>”或“<”)。
③在固体酸(HB)催化作用下,测得反应Ⅰ的速率方程为 (k为速率常数)。在刚性容器中发生反应Ⅰ,下列叙述正确的是
(k为速率常数)。在刚性容器中发生反应Ⅰ,下列叙述正确的是_______ (填标号)。
A.升高温度,平衡常数K和v均增大
B.增大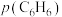 ,平衡常数K不变,v增大
,平衡常数K不变,v增大
C.降低温度,平衡常数K和v均减小
D.增大 ,平衡常数K不变,反应Ⅰ的
,平衡常数K不变,反应Ⅰ的 不变
不变
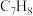 )和二甲苯(
)和二甲苯(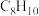 )是重要的化工原料。利用苯(
)是重要的化工原料。利用苯(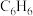 )和甲醇(
)和甲醇( )在催化剂作用下反应得到
)在催化剂作用下反应得到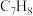 、
、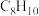 和副产物三甲苯(
和副产物三甲苯( ),发生的主要反应如下:
),发生的主要反应如下:Ⅰ.
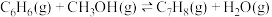
Ⅱ.
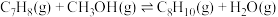
Ⅲ.

(1)500℃、0.18Mpa条件下,反应达到平衡时,结果如图所示。

①由图分析,随着投料比
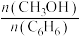 增加,
增加, 的平衡转化率
的平衡转化率 的值
的值②投料比
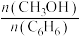 为1.0时,
为1.0时,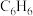 的平衡转化率为50%,产物中
的平衡转化率为50%,产物中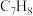 、
、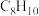 和
和 物质的量之比为6:3:1.
物质的量之比为6:3:1. 的平衡转化率为
的平衡转化率为
(2)我国学者结合实验与计算机模拟结果,研究了反应Ⅰ在固体酸(HB)催化剂表面进行的反应历程如图所示。其中吸附在固体酸(HB)表面的物种用*标注。

①反应Ⅰ的

 。
。②吸附
 的焓变
的焓变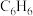 的焓变(填“>”或“<”)。
的焓变(填“>”或“<”)。③在固体酸(HB)催化作用下,测得反应Ⅰ的速率方程为
 (k为速率常数)。在刚性容器中发生反应Ⅰ,下列叙述正确的是
(k为速率常数)。在刚性容器中发生反应Ⅰ,下列叙述正确的是A.升高温度,平衡常数K和v均增大
B.增大
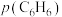 ,平衡常数K不变,v增大
,平衡常数K不变,v增大C.降低温度,平衡常数K和v均减小
D.增大
 ,平衡常数K不变,反应Ⅰ的
,平衡常数K不变,反应Ⅰ的 不变
不变
您最近一年使用:0次
2 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。硝基苯是一种具有稳定化学性质、高毒性、难生物降解的污染物。工业上采用吸附、还原、氧化等方法可有效降解废水中的硝基苯。
(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是:______________________ (请从平衡移动角度解释)。

(2)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。铁炭混合物中极小颗粒的炭分散在铁屑内,具有吸附作用,同时作正极材料构成原电池加快反应速率,还能防止铁屑结块。

①该物质转化示意图可以描述为:___________ 。
②酸性环境中,铁炭混合物处理硝基苯废水,难生物降解的硝基苯首先被还原为亚硝基苯( ),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:___________ 。
③其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图所示。pH越大,硝基苯的去除率越低的原因是:___________ 。

(3)研究发现, 在
在 作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含
作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含 和苯胺(
和苯胺( )的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:
)的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:___________ 。
(4)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液 时苯胺浓度大于
时苯胺浓度大于 时的原因是
时的原因是___________ 。[已知氧化性: ]
]

(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是:

(2)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。铁炭混合物中极小颗粒的炭分散在铁屑内,具有吸附作用,同时作正极材料构成原电池加快反应速率,还能防止铁屑结块。

①该物质转化示意图可以描述为:
②酸性环境中,铁炭混合物处理硝基苯废水,难生物降解的硝基苯首先被还原为亚硝基苯(
 ),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:③其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图所示。pH越大,硝基苯的去除率越低的原因是:

(3)研究发现,
 在
在 作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含
作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含 和苯胺(
和苯胺( )的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:
)的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:(4)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液
 时苯胺浓度大于
时苯胺浓度大于 时的原因是
时的原因是 ]
]
您最近一年使用:0次
3 . 氯化亚铜( )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下: 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。
(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是___________ 。
(2)步骤2是溶解过程,溶解时反应的离子方程式___________ 。
(3)步骤3为主反应, 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。___________ ;
②比较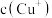 相对大小:A点
相对大小:A点___________ C点(填“>”、“<”或“=”);
③提高C点状态混合物中 沉淀率的措施是
沉淀率的措施是___________ ;
(4)步骤4进行的实验操作是___________ ;
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是___________ 。用乙醇洗涤的目的是___________ 。
(6)产品纯度测定:称取 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。
① 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是___________ 。
②产品中 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为___________ 。
 )广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产
)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产 的工艺如下:
的工艺如下:
 难溶于醇和水,溶于
难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是
(2)步骤2是溶解过程,溶解时反应的离子方程式
(3)步骤3为主反应,
 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示。
的量关系如图所示。
②比较
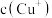 相对大小:A点
相对大小:A点③提高C点状态混合物中
 沉淀率的措施是
沉淀率的措施是(4)步骤4进行的实验操作是
(5)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是
(6)产品纯度测定:称取
 产品a g于锥形瓶中,加入足量的酸性
产品a g于锥形瓶中,加入足量的酸性 溶液使其充分溶解,然后用
溶液使其充分溶解,然后用
 标准溶液滴定
标准溶液滴定 ,消耗
,消耗 溶液b mL。(本实验中
溶液b mL。(本实验中 的被还原为
的被还原为 ,不与产品中杂质和
,不与产品中杂质和 反应)。
反应)。①
 溶于
溶于 溶液的离子方程式是
溶液的离子方程式是②产品中
 (摩尔质量为99g/mol)的质量分数为
(摩尔质量为99g/mol)的质量分数为
您最近一年使用:0次
2023-05-31更新
|
709次组卷
|
7卷引用:湖南师范大学附属中学2024届高三上学期月考(二) 化学试题
名校
4 . 一定温度下,对于反应: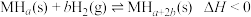 达到化学平衡时,下列有关叙述正确的是
达到化学平衡时,下列有关叙述正确的是
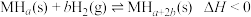 达到化学平衡时,下列有关叙述正确的是
达到化学平衡时,下列有关叙述正确的是| A.升高温度,再次达到平衡时,气体质量增大 |
| B.恒容反应器中通入Ar,平衡向正方向移动 |
C.压缩容器体积,重新达到平衡,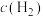 增大 增大 |
D.增加少量 的量,v(吸氢)>v(放氢) 的量,v(吸氢)>v(放氢) |
您最近一年使用:0次
名校
5 . 氨和硝酸是重要的化工原料,工业上常以N2为原料利用下列流程制备氨和硝酸。已知:“尾气处理”常用Na2CO3吸收含NOx尾气,发生的反应为:NO+NO2+Na2CO3=2NaNO2+CO2、2NO2+Na2CO3=NaNO2+NaNO3+CO2。下列说法正确的是
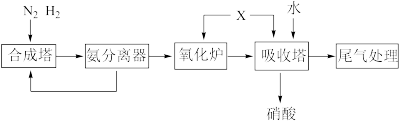

| A.氮元素在转化过程中均被氧化 |
| B.为提高“合成塔”平衡体系中NH3的百分含量,应选择高温、高压的条件 |
| C.HNO3中的氮原子采用的是sp3杂化形式 |
| D.将含NO和NO2共2mol的尾气通入Na2CO3溶液中,若NOx被完全吸收,则消耗的Na2CO3的物质的量为1mol |
您最近一年使用:0次
2023-05-18更新
|
204次组卷
|
2卷引用:湖南省新高考教学教研联盟(长郡十八校联盟)2022-2023学年高二下学期5月联考化学试题
名校
解题方法
6 . 下列有关速率与平衡的说法正确的是
| A.化学反应速率改变,平衡一定移动 | B.平衡发生移动,平衡常数一定变化 |
| C.增加某种反应物的量,平衡一定正向移动 | D.平衡正向移动,反应物的转化率不一定增大 |
您最近一年使用:0次
2023-05-16更新
|
467次组卷
|
3卷引用:山东省鄄城县第一中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
7 . 一定温度下,在恒容密闭容器中发生反应: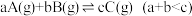 ,达平衡后将体积缩小为原来的一半,则C的体积分数
,达平衡后将体积缩小为原来的一半,则C的体积分数
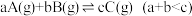 ,达平衡后将体积缩小为原来的一半,则C的体积分数
,达平衡后将体积缩小为原来的一半,则C的体积分数| A.变大 | B.变小 | C.不变 | D.无法判断 |
您最近一年使用:0次
2023-05-15更新
|
399次组卷
|
3卷引用:黑龙江省牡丹江市第三高级中学2023-2024学年高二上学期第一次月考化学试题
8 . 有机催化聚合反应有环境友好和储存容易等优点。一种有机催化聚合方法如下:

资料:KH是一种强碱。
下列说法中不正确的是

资料:KH是一种强碱。
下列说法中不正确的是
| A.反应①是取代反应 | B.KH可增大反应②中b的转化率 |
C.反应③中的另外一种产物可能是 | D. 为加聚反应 为加聚反应 |
您最近一年使用:0次
2023-05-07更新
|
213次组卷
|
2卷引用:北京市第五中学通州分校2023-2024学年高三上学期12月练习二化学试题
名校
9 . 关于反应
 ,下列说法正确的是
,下列说法正确的是

 ,下列说法正确的是
,下列说法正确的是| A.该反应在高温条件下可以自发进行 |
| B.向反应容器中加入催化剂,反应自发进行的临界温度会降低 |
| C.恒容条件下,通入He和Ar组成的混合气体,压强会增大,反应的速率会加快 |
D.恒容条件下,可通入过量的CO2气体来提高 转化率并增大生成物 转化率并增大生成物 的浓度 的浓度 |
您最近一年使用:0次
2023-05-05更新
|
359次组卷
|
7卷引用:陕西省西安市长安区第一中学2022-2023学年高一下学期第二次质量检测化学试题
陕西省西安市长安区第一中学2022-2023学年高一下学期第二次质量检测化学试题四川省绵竹中学2023-2024学年高二上学期第二次月考化学试题湖北省黄冈市黄梅国际育才高级中学2023-2024学年高二上学期12月月考化学试题陕西省西安市长安区第一中学2022-2023学年高二上学期期末考试(理科)化学试题新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期末考试化学试题云南省昆明市云南师范大学附属中学2023-2024学年高二上学期期中联考化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)
名校
解题方法
10 . 苯乙烯是一种重要的有机化工原料,可广泛用于合成橡胶,工程塑料及制药等。工业上可通过乙苯催化脱氢来制取苯乙烯,反应方程式如下:
___________ 。
(2)下列关于该反应的说法不正确的是___________。
(3)工业上通入过热水蒸气 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应
①反应中通入水蒸气的作用是___________
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为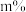 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
___________ (分压 总压
总压 物质的量分数)
物质的量分数)
(4)保持温度为 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应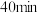 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线___________ 。

 ;
;

| 物质 | 乙苯 | 苯乙烯 | 氢气 |
燃烧热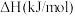 |  |  |  |
| A.高温、低压有利于该反应平衡正向进行 |
| B.高温恒压条件下,乙苯可能会裂解产生积碳覆盖在催化剂的表面,使催化效果下降 |
| C.恒温恒容条件下,反应达到平衡后,向体系中再充入乙苯蒸气,乙苯的转化率将增大 |
| D.选择合适的催化剂可以缩短达到平衡的时间,可使乙苯的平衡转化率变大 |
 ,在常压的条件下发生乙苯的催化脱氢反应
,在常压的条件下发生乙苯的催化脱氢反应①反应中通入水蒸气的作用是
②将乙苯和水蒸气通入反应器,其中乙苯的物质的量分数为
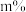 ,在温度t、压强p下进行反应。平衡时,乙苯的转化率为
,在温度t、压强p下进行反应。平衡时,乙苯的转化率为 ,该反应的平衡常数
,该反应的平衡常数
 总压
总压 物质的量分数)
物质的量分数)(4)保持温度为
 ,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应
,向体积不等的恒容密闭容器中加入一定量的乙苯发生反应,反应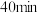 后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出
后测得各容器中乙苯的转化率与容器体积的关系如图所示,画出 之间乙苯的平衡转化率变化曲线
之间乙苯的平衡转化率变化曲线
您最近一年使用:0次
2023-04-27更新
|
165次组卷
|
2卷引用:浙江省海宁市高级中学2023-2024学年高二下学期3月月考化学试题



