22-23高二下·浙江·期中
解题方法
1 . 下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将溴乙烷、乙醇和烧碱的混合物加热,产生的气体经水洗后,再通入溴水中,溶液褪色 | 溴乙烷发生了消去反应 |
| B | 将盐酸酸化的CuCl2溶液加水稀释溶液的颜色由黄绿色变为绿色,最终变为蓝色 | 溶液中 浓度减小, 浓度减小, 浓度增大 浓度增大 |
| C | 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 | 铁锈中含有二价铁 |
| D | 液溴和苯在铁粉作用下剧烈放热,将产生的气体通入AgNO3溶液,产生淡黄色沉淀挥发 | 液溴与苯发生了取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
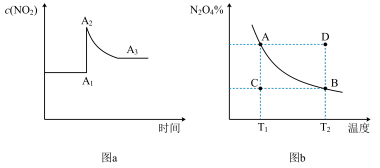
2 . 在密闭容器中发生反应 。图a表示恒温条件下
。图a表示恒温条件下 随时间的变化情况,图b表示恒压条件下,平衡体系中
随时间的变化情况,图b表示恒压条件下,平衡体系中 的质量分数随温度变化情况。下列说法不正确的是
的质量分数随温度变化情况。下列说法不正确的是
 。图a表示恒温条件下
。图a表示恒温条件下 随时间的变化情况,图b表示恒压条件下,平衡体系中
随时间的变化情况,图b表示恒压条件下,平衡体系中 的质量分数随温度变化情况。下列说法不正确的是
的质量分数随温度变化情况。下列说法不正确的是
A.图a中, 变化的原因可能是缩小体积 变化的原因可能是缩小体积 |
B.依据图b分析可知,该化学反应 |
| C.图b中,C→A所需的时间为x,D→B所需时间为y,则x<y |
D.若要测定 的相对分子质量,尽量选择低压、高温条件 的相对分子质量,尽量选择低压、高温条件 |
您最近一年使用:0次
解题方法
3 . 将一定量的氨基甲酸铵置于恒温恒容容器中,发生反应: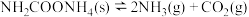 。下列说法不正确的是
。下列说法不正确的是
 。下列说法不正确的是
。下列说法不正确的是A.该反应的 |
B.平衡时通入少量 ,平衡向逆反应方向移动 ,平衡向逆反应方向移动 |
| C.氨气的体积分数不变,则说明反应已经达到平衡状态 |
| D.容器中总压强不变,则说明反应已经达到平衡状态 |
您最近一年使用:0次
4 . 下列描述能用勒夏特列原理解释的是
A. 晶体溶于浓盐酸配制 晶体溶于浓盐酸配制 溶液 溶液 |
B. 溶液中加入少量 溶液中加入少量 粉末后产生气泡速率变快 粉末后产生气泡速率变快 |
C. 、 、 、HI平衡混合气体加压后颜色加深 、HI平衡混合气体加压后颜色加深 |
| D.500℃左右的温度比室温更有利于合成氨反应 |
您最近一年使用:0次
2023-04-22更新
|
214次组卷
|
2卷引用:浙江省温州市2022-2023学年高一上学期期末教学质量统一检测(A卷)化学试题
解题方法
5 . 下列说法不正确 的是
| A.酸碱中和滴定操作实验中,可用pH计代替指示剂判断滴定终点 |
B.可用 溶液检验 溶液检验 ,其现象是产生蓝色沉淀 ,其现象是产生蓝色沉淀 |
C.向 (橙色)溶液和 (橙色)溶液和 (黄色)溶液的平衡体系中加入浓盐酸,溶液变橙色 (黄色)溶液的平衡体系中加入浓盐酸,溶液变橙色 |
| D.中和热测定实验中,迅速混合酸碱溶液,并立即盖上杯盖的目的是防止热量损失 |
您最近一年使用:0次
名校
6 . 一定条件下,密闭容器中发生反应:
 。达到平衡后,下列措施不能提高乙烷平衡转化率的是
。达到平衡后,下列措施不能提高乙烷平衡转化率的是

 。达到平衡后,下列措施不能提高乙烷平衡转化率的是
。达到平衡后,下列措施不能提高乙烷平衡转化率的是| A.升高反应的温度 | B.增大容器的容积 |
| C.恒容下通入氦气 | D.分离出部分乙烯 |
您最近一年使用:0次
2023-04-22更新
|
314次组卷
|
3卷引用:浙江省嘉兴市2022-2023学年高二上学期1月期末考试化学试题
浙江省嘉兴市2022-2023学年高二上学期1月期末考试化学试题(已下线)专题04 化学平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题
23-24高二上·浙江·期末
解题方法
7 . 为验证反应Fe3++Ag=Fe2++Ag+,利甩如图电池装置进行实验。
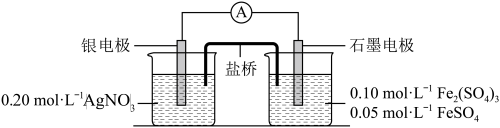
(1)由Fe2(SO4)3固体配制500 mL0.1 mol/LFe2(SO4)3溶液。在烧杯中溶解固体时,先加入一定体积的_______ 稀溶液,搅拌后再加入一定体积的水。
(2)电流表显示电流由银电极流向石墨电极。可知, 盐桥中的阳离子进入_______ 电极溶液中。
(3)根据(2)实验结果,可知石墨电极的电极反应式为_______ ,银电极的电极反应式为_______ 。因此,Fe3+氧化性小于_______ 。
(4)电池装置中,盐桥连接两电极电解质溶液。如果盐桥中电解质为KNO3,反应一段时间后,可以观察到电流表指针反转,原因是_______ 。

(1)由Fe2(SO4)3固体配制500 mL0.1 mol/LFe2(SO4)3溶液。在烧杯中溶解固体时,先加入一定体积的
(2)电流表显示电流由银电极流向石墨电极。可知, 盐桥中的阳离子进入
(3)根据(2)实验结果,可知石墨电极的电极反应式为
(4)电池装置中,盐桥连接两电极电解质溶液。如果盐桥中电解质为KNO3,反应一段时间后,可以观察到电流表指针反转,原因是
您最近一年使用:0次
23-24高二上·浙江·期末
名校
8 . 列实验方案设计、现象和结论都正确的是
| 目的 | 实验方案设计 | 现象和结论 | |
| A | 探究压强对平衡的影响 | 在针筒中充入一定量的NO2气体,压缩针筒,从针简顶部观察到气体颜色变浅 | 压强增大,平衡向气体体积减小的方向移动 |
| B | 探究浓度对平衡移动的影响 | 向K2Cr2O7溶液中缓慢滴加浓盐酸,黄色变为橙色 | 增大c(H+),平衡向生成 的方向移动 的方向移动 |
| C | 检验某溶液中是否含有Fe2+离子 | 向该溶液中滴加几滴新制氯水, 振荡,再加入少量KSCN溶液 | 溶液变为血红色,则该溶液中含有Fe2+离子 |
| D | 检验乙醇中是否含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 | 乙醇中含有水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-06更新
|
161次组卷
|
3卷引用:【2023】【高二上】【源清中学】【期末考】【高中化学】【廖汨平收集】
(已下线)【2023】【高二上】【源清中学】【期末考】【高中化学】【廖汨平收集】江西省宜丰中学创新部2023-2024学年高一上学期10月月考化学试题吉林省长春外国语学校2023-2024学年高二下学期开学化学试题
22-23高二上·浙江杭州·期中
9 . 下列实验方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 探究反应物浓度对化学反应速率的影响 | 分别取10mL 0.lmol/LNa2S2O3溶液和5mL 0. lmol/L Na2S2O3溶液、5mL蒸馏水于两支试管中,然后同时加入10mL 0.1mol/LH2SO4溶液 | 前者出现浑浊的时间更短,说明增大Na2S2O3浓度,可以加快反应速率 |
| B | 探究压强对化学反应速率的影响 | 在容积不变的密闭容器中发生反应:N2(g) +3H2(g) 2NH3(g) 向其中通入氩气,反应速率不变 2NH3(g) 向其中通入氩气,反应速率不变 | 化学反应速率不受压强影响 |
| C | 探究温度对化学反应速率的影响 | 将装有NO2和N2O4混合气体的连同球分别浸泡在冰水和热水中2NO2(g)(红棕色) N2O4(g)(无色),△H< 0 N2O4(g)(无色),△H< 0 | 热水中气体颜色浅,冰水中颜色深 |
| D | 探究KI与FeCl3反应的限度 | 取1mL.0.1mol/LKI溶液于试管中,加入5mL0.1mol/L FeCl3溶液,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI与FeCl3的反应有一定限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
21-22高二·浙江·期中
10 . 下列事实不能用勒夏特列原理解释的是
| A.工业生产硫酸的过程中使用适当过量的氧气,以提高二氧化硫的转化率 |
| B.红棕色的NO2加压后颜色先变深再变浅 |
| C.光照新制氯水时,溶液的pH逐渐减小 |
D.硫酸工业中的重要反应2SO2+O2 2SO3,工业上常加入V2O5做催化剂 2SO3,工业上常加入V2O5做催化剂 |
您最近一年使用:0次



