名校
解题方法
1 . 图中曲线分别表示相同温度下,压强为P1、P2条件下发生可逆反应:mX(g)+nY(g) 2Z(g)+W(s)的过程。下列说法不正确的是( )
2Z(g)+W(s)的过程。下列说法不正确的是( )
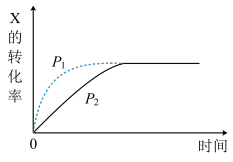
 2Z(g)+W(s)的过程。下列说法不正确的是( )
2Z(g)+W(s)的过程。下列说法不正确的是( )
| A.P1>P2 | B.m+n=2 |
| C.m+n=3 | D.P1、P2下平衡常数相同 |
您最近一年使用:0次
2020-06-06更新
|
98次组卷
|
4卷引用:河南省宋基信阳实验中学2021-2022学年高三上学期12月月考化学试题
2 . 已知反应: 。当反应达平衡时,
。当反应达平衡时,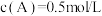 ,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得
,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得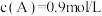 ,下列说法错误的是
,下列说法错误的是
 。当反应达平衡时,
。当反应达平衡时,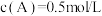 ,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得
,其他条件不变,若将容器体积缩小到原来的一半,重新达到平衡后测得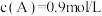 ,下列说法错误的是
,下列说法错误的是A. 的状态一定是气体 的状态一定是气体 | B.平衡常数不变 |
| C.平衡向逆反应方向移动 | D. |
您最近一年使用:0次
2021-02-06更新
|
208次组卷
|
2卷引用:四川省内江市2020-2021学年度第一学期高二期末检测化学试题
名校
3 . 工业上利用炭和水蒸气反应:C(s)+H2O(g)  CO(g)+H2(g)、CO(g)+H2O(g)
CO(g)+H2(g)、CO(g)+H2O(g)  CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO
CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO 能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。下列有关说法正确的是
能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。下列有关说法正确的是
 CO(g)+H2(g)、CO(g)+H2O(g)
CO(g)+H2(g)、CO(g)+H2O(g)  CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO
CO2(g)+H2(g)生成的H2为原料合成氨。在饱和食盐水中先通NH3,后通CO2,由于HCO 能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。下列有关说法正确的是
能形成多聚体,所以容易析出NaHCO3,过滤后热分解得纯碱。下列有关说法正确的是| A.增大压强有利于提高上述反应中焦炭的利用率 |
B.NaHCO3溶液中,HCO 能形成多聚体是因为氢键的作用 能形成多聚体是因为氢键的作用 |
| C.若反应体系中,c(CO)=a mol·L-1,c(CO2)=b mol·L-1,则c(H2)=(a+b) mol·L-1 |
| D.析出NaHCO3的反应属于氧化还原反应 |
您最近一年使用:0次
名校
4 . 在不同温度下,向 2 L密闭容器中加入1 mol NO(g)和1 mol活性炭(C),发生反应:2NO(g)+C(s) 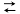 N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
下列说法不正确的是( )
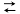 N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。温度/℃ | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
| A.上述信息可推知:t1<t2 |
B.t1℃ 时,该反应的平衡常数K=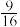 |
| C.t2℃ 时,若反应达平衡后再缩小容器的容积,c(N2)∶c(NO)不变 |
| D.t1℃ 时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小 |
您最近一年使用:0次
2019-12-09更新
|
147次组卷
|
14卷引用:江苏省扬州市高邮市临泽中学2021-2022学年高二9月阶段测试化学试卷
江苏省扬州市高邮市临泽中学2021-2022学年高二9月阶段测试化学试卷江苏省高邮市临泽镇高中2021-2022学年高二上学期9月阶段测试化学试题2015届北京市西城区高三上学期期末考试化学试卷2016届山东省枣庄三中高三上学期12月质检化学试卷2015-2016学年重庆市第一中学高二上学期期末化学试卷(已下线)北京市第四中学2016-2017学年高二上学期期末考试化学试题重庆市巴蜀中学2017-2018学年高二上学期期末考试化学试题北京师范大学附属中学2017-2018学年高二上学期期末考试化学试题四川成都外国语学校2017-2018学年高二下学期入学考化学试题广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题甘肃省张掖市山丹县第一中学2019-2020学年高二11月月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二11月月考化学试题北京市中国人民大学附属中学2019-2020学年高三下学期月考化学试题北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷
5 . NO与CO是燃油汽车尾气中的两种有害气体,已知:CO(g)+ NO(g)  CO2(g)+
CO2(g)+ N2(g) ΔH= -374.3 kJ·mol-1,平衡常数K为2.5×1060.有关该反应的说法不正确的是
N2(g) ΔH= -374.3 kJ·mol-1,平衡常数K为2.5×1060.有关该反应的说法不正确的是
 CO2(g)+
CO2(g)+ N2(g) ΔH= -374.3 kJ·mol-1,平衡常数K为2.5×1060.有关该反应的说法不正确的是
N2(g) ΔH= -374.3 kJ·mol-1,平衡常数K为2.5×1060.有关该反应的说法不正确的是| A.K很大,表明NO与CO能迅速反应 |
| B.在汽车排气管上安装”催化转化器”能够减小尾气对空气的污染 |
| C.升高温度,反应速率增大但K减小 |
| D.增大压强,平衡将向右移动 |
您最近一年使用:0次
6 . 反应2SO2(g)+O2(g)  2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是
2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是
 2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是
2SO3(g) △H<0是工业上合成硫酸过程中的一步反应,下列关于该反应的说法正确的是| A.反应物的总能量高于生成物的总能量 |
| B.催化剂可以降低硫氧键键能 |
| C.加压有利于SO3生成,所以工业上压强越高越好 |
| D.升高温度可以增大正反应速率,降低逆反应速率 |
您最近一年使用:0次
名校
解题方法
7 . 一定量的 与足量的碳在体积可变的恒压密闭容器中发生反应:
与足量的碳在体积可变的恒压密闭容器中发生反应: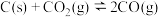 ,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法错误的是
,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法错误的是
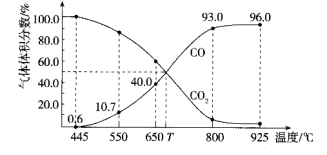
 与足量的碳在体积可变的恒压密闭容器中发生反应:
与足量的碳在体积可变的恒压密闭容器中发生反应: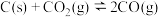 ,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法错误的是
,平衡时,体系中气体体积分数与温度的关系如图所示,下列说法错误的是
A.550℃时,若充入惰性气体, 、 、 均减小,平衡向正反应方向移动 均减小,平衡向正反应方向移动 |
B.650℃时, 的转化率为25% 的转化率为25% |
C. 时,若充入等体积的 时,若充入等体积的 和CO,平衡向逆反应方向移动 和CO,平衡向逆反应方向移动 |
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数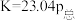 |
您最近一年使用:0次
2021-05-21更新
|
149次组卷
|
3卷引用:周末培优1 化学反应速率与化学平衡图像问题-2021-2022学年高二化学课后培优练(人教版选修4)
(已下线)周末培优1 化学反应速率与化学平衡图像问题-2021-2022学年高二化学课后培优练(人教版选修4)湖北省黄石二中2020届高三4月线上考试理综化学试题辽宁省大连市普兰店区第一中学2020-2021学年高二上学期第二阶段考试化学试题
8 .  与
与 在容积为
在容积为 的密闭容器中发生反应
的密闭容器中发生反应
 ,
, 、
、 时刻分别测得如下数据:
时刻分别测得如下数据:
下列说法不正确的是
 与
与 在容积为
在容积为 的密闭容器中发生反应
的密闭容器中发生反应
 ,
, 、
、 时刻分别测得如下数据:
时刻分别测得如下数据:时间/ | 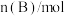 | 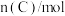 | 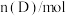 |
 | 0.12 | 0.06 | 0.10 |
 | 0.06 | 0.12 | 0.20 |
A. |
B.增大压强, 的平衡转化率减小 的平衡转化率减小 |
| C.某时刻反应达到平衡,升高体系温度平衡正向移动 |
D.若起始只投入了 和 和 ,则在 ,则在 时刻 时刻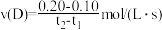 |
您最近一年使用:0次
名校
9 . 工业上利用CO和H2合成二甲醚:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g) ΔH。其它条件不变时,相同时间内CO的转化率随温度T的变化情况如图所示。下列说法不正确 的是
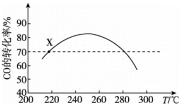

| A.ΔH<0 |
| B.状态X时,v消耗(CO)=v生成(CO) |
| C.相同温度时,增大压强,可以提高CO的转化率 |
| D.状态X时,选择合适催化剂,可以提高相同时间内CO的转化率 |
您最近一年使用:0次
2021-01-24更新
|
1071次组卷
|
11卷引用:北京市朝阳区2021届高三上学期期末考试化学试题
北京市朝阳区2021届高三上学期期末考试化学试题广东省华附、省实、广雅、深中四校2020-2021学年高二下学期期末联考化学试题(已下线)第1周 周测卷-备战2022年高考化学周测与晚练(新高考专用)北京一零一中学2021-2022学年高二上学期期中考试化学试题广东省揭阳华侨高级中学2021-2022学年高二上学期期中考试化学试题天津市南开区2021-2022学年高二上学期期末考试化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题天津市第二十五中学2022-2023 学年高二上学期期末阶段测试化学试题河南省信阳高级中学2022-2023学年高二上学期期末考试化学试题北京市八一学校2022-2023学年高二上学期期中考试化学试题广东省清远市阳山县南阳中学2023-2024学年高二上学期第二次月考(期中)化学试题
2010·北京丰台·一模
解题方法
10 . X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是( )


| A.该反应的热化学方程式为X(g) +3Y(g) ⇌ 2Z(g) △H= -(E2-E1)kJ |
| B.若图Ⅲ中甲表示压强,乙表示Z的含量,则其变化符合图Ⅲ中曲线 |
| C.该温度下,反应的平衡常数数值约为533,若升高温度,该反应的平衡常数减小,Y的转化率降低 |
| D.图Ⅱ中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线 |
您最近一年使用:0次
2019-11-28更新
|
403次组卷
|
4卷引用:广东省深圳市龙华区2020-2021学年高二上学期期末检测化学试题
广东省深圳市龙华区2020-2021学年高二上学期期末检测化学试题(已下线)北京市丰台区2010年高三一模(理科综合)化学部分辽宁省大连市2020届高三上学期第三次模拟考试理综化学试题2020届高三《新题速递·化学》12月第01期(考点01-06)



