名校
1 . 一定温度下将CaCO3放入密闭真空容器中,反应CaCO3(s) CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
 CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是
CaO(s)+CO2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法不正确的是| A.平衡向左移动 | B.压强不变 |
| C.平衡常数不变 | D.固体总质量不变 |
您最近一年使用:0次
2020-04-28更新
|
297次组卷
|
4卷引用:广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题
广东省汕头市金山中学2020-2021学年高二上学期期末考试化学试题(已下线)【浙江新东方】高中化学20210513-044【2021】【高二下】山东省日照市2018-2019学年高二上学期期末模块考试化学试题(已下线)2021年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷01
名校
2 . 一定温度下,在密闭容器中发生如下反应:2HI(g) H2(g)+ I2(g) △H>0,反应达到平衡时,下列说法错误的是( )
H2(g)+ I2(g) △H>0,反应达到平衡时,下列说法错误的是( )
 H2(g)+ I2(g) △H>0,反应达到平衡时,下列说法错误的是( )
H2(g)+ I2(g) △H>0,反应达到平衡时,下列说法错误的是( )| A.若体积不变,升高温度,活化分子的百分数增加,反应速率加快 |
| B.若缩小容器的体积,再次平衡时颜色变深,该现象不能用勒夏特列原理解释 |
| C.若压强不变,向容器中再加入一定量的HI时正反应速率增大,逆反应速率减小 |
| D.若体积不变,向容器中再加入一定量的HI,再次平衡时HI的转化率增大 |
您最近一年使用:0次
2020-01-17更新
|
214次组卷
|
4卷引用:湖北省沙市中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
3 . 反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确 的是
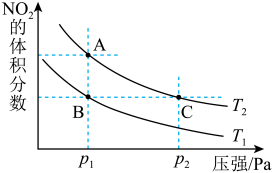
 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法
| A.A点的反应速率小于C点的反应速率 |
| B.A、C两点气体的颜色:A浅,C深 |
| C.由状态B到状态A,可以用降温的方法 |
| D.A、C两点气体的平均相对分子质量:A<C |
您最近一年使用:0次
2020-04-02更新
|
1051次组卷
|
9卷引用:黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题
黑龙江省大庆中学2020—2021学年高二上学期期末考试化学试题浙江省衢州市四校2019--2020学年上学期期中联考高二化学试题河北省沧州市河间市第四中学2019-2020学年高二下学期期末模拟考试化学试卷黑吉两省十校2020-2021学年高二上学期期中联考(吉雅2校用)化学试题湖南省常德市外国语学校2020-2021学年高二上学期第二次月考化学试题江西省吉安县立中学2020-2021学年高二上学期12月月考化学(B班)试题山东省新泰市第一中学2022-2023学年高二上学期期中考试化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题山东省泰安新泰市第一中学(实验部)2023-2024学年高二上学期第一次质量检测化学试题
名校
4 . 可逆反应aA(g)+bB(g)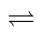 cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
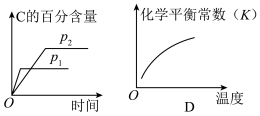
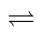 cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
cC(g)+dD(s)ΔH=QkJ·mol-1,反应过程中,当其他条件不变时,化学平衡常数(K)与温度,C的百分含量与时间的关系如图所示。据图分析,以下说法错误的是
| A.Q>0 |
| B.增大压强,B的转化率增大 |
| C.当反应达平衡时,混合气体的密度不再变化 |
| D.p1>p2,a+b<c |
您最近一年使用:0次
2020-05-10更新
|
105次组卷
|
2卷引用:河南省宋基信阳实验中学2021-2022学年高三上学期12月月考化学试题
名校
5 . 在不同温度下,向 2 L密闭容器中加入1 mol NO(g)和1 mol活性炭(C),发生反应:2NO(g)+C(s)  N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
下列说法不正确的是( )
 N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。温度/℃ | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
| A.上述信息可推知:t1<t2 |
B.t1℃ 时,该反应的平衡常数K=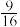 |
| C.t2℃ 时,若反应达平衡后再缩小容器的容积,c(N2)∶c(NO)不变 |
| D.t1℃ 时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小 |
您最近一年使用:0次
2019-12-09更新
|
147次组卷
|
14卷引用:江苏省扬州市高邮市临泽中学2021-2022学年高二9月阶段测试化学试卷
江苏省扬州市高邮市临泽中学2021-2022学年高二9月阶段测试化学试卷江苏省高邮市临泽镇高中2021-2022学年高二上学期9月阶段测试化学试题2015届北京市西城区高三上学期期末考试化学试卷2016届山东省枣庄三中高三上学期12月质检化学试卷2015-2016学年重庆市第一中学高二上学期期末化学试卷(已下线)北京市第四中学2016-2017学年高二上学期期末考试化学试题重庆市巴蜀中学2017-2018学年高二上学期期末考试化学试题北京师范大学附属中学2017-2018学年高二上学期期末考试化学试题四川成都外国语学校2017-2018学年高二下学期入学考化学试题广东省中山市第一中学2019-2020学年高二上学期第一次段考化学试题甘肃省张掖市山丹县第一中学2019-2020学年高二11月月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二11月月考化学试题北京市中国人民大学附属中学2019-2020学年高三下学期月考化学试题北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷
2010·北京丰台·一模
解题方法
6 . X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是( )


| A.该反应的热化学方程式为X(g) +3Y(g) ⇌ 2Z(g) △H= -(E2-E1)kJ |
| B.若图Ⅲ中甲表示压强,乙表示Z的含量,则其变化符合图Ⅲ中曲线 |
| C.该温度下,反应的平衡常数数值约为533,若升高温度,该反应的平衡常数减小,Y的转化率降低 |
| D.图Ⅱ中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线 |
您最近一年使用:0次
2019-11-28更新
|
403次组卷
|
4卷引用:广东省深圳市龙华区2020-2021学年高二上学期期末检测化学试题
广东省深圳市龙华区2020-2021学年高二上学期期末检测化学试题(已下线)北京市丰台区2010年高三一模(理科综合)化学部分辽宁省大连市2020届高三上学期第三次模拟考试理综化学试题2020届高三《新题速递·化学》12月第01期(考点01-06)
名校
7 . 温度T℃时,在初始体积为1L的两个密闭容器甲(恒容)、乙(恒压)中分别加入0.2molA和0.1molB,发生反应2A(g)+B(g)  x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是

 x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
x C(g),实验测得甲、乙容器中A的转化率随时间的变化关系如图所示。下列说法错误的是
| A.x可能为4 |
| B.M为容器甲 |
| C.容器乙达平衡时B的转化率为25% |
| D.M的平衡常数大于N |
您最近一年使用:0次
2019-09-04更新
|
247次组卷
|
3卷引用:四川省绵阳市南山中学双语学校2020-2021学年高二下学期6月月考化学试题
名校
8 . 在一密闭容器中加入一定物质的量的A气体,发生反应 a A(g) b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A) 变为原平衡的60%,下列说法不正确的是
b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A) 变为原平衡的60%,下列说法不正确的是
 b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A) 变为原平衡的60%,下列说法不正确的是
b B(g)+c C(g),达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时,c(A) 变为原平衡的60%,下列说法不正确的是| A.化学计量数之间的关系:a>b+c |
| B.平衡向正反应方向移动 |
| C.物质B的体积分数减小 |
| D.平衡移动过程中,与原平衡相比υ正减小、υ逆减小 |
您最近一年使用:0次
2019-10-18更新
|
60次组卷
|
2卷引用:江苏省盱眙中学2021-2022学年高二上学期第三次学情调研化学试题
名校
解题方法
9 . 已知反应A2(g) + 2B2(g) 2AB2(g) ΔH < 0,列说法正确的是
2AB2(g) ΔH < 0,列说法正确的是
 2AB2(g) ΔH < 0,列说法正确的是
2AB2(g) ΔH < 0,列说法正确的是 | A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
您最近一年使用:0次
2019-12-28更新
|
122次组卷
|
4卷引用:甘肃省庆阳市第六中学2021-2022学年高二上学期期中考试化学(理)试题
名校
10 . 在密闭容器中发生反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列说法不正确的是( )
2SO3(g) ΔH<0,下列说法不正确的是( )
 2SO3(g) ΔH<0,下列说法不正确的是( )
2SO3(g) ΔH<0,下列说法不正确的是( )| A.升温,正、逆反应速率均加快 | B.压缩容器增大压强,化学平衡正向移动 |
| C.充入O2,可提高SO2的转化率 | D.当气体总质量不变时,反应达平衡状态 |
您最近一年使用:0次
2019-11-28更新
|
109次组卷
|
3卷引用:安徽省滁州市定远县育才学校2021-2022学年高二上学期期中考试(实验班)化学试题



