名校
1 . 已知:
反应Ⅰ: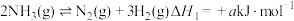
反应Ⅱ: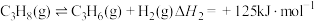
下列说法不正确 的是
| 化学键 |  |  |  |  |
键能/ | 946 | 436 | 391 | 416 |
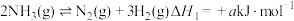
反应Ⅱ:
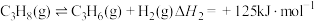
下列说法
A.通过反应Ⅰ计算: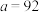 |
B.反应Ⅰ恒压时充入稀有气体: 分解率不变 分解率不变 |
| C.反应Ⅱ为气体分子数增加的反应:熵增加,在一定温度下可自发进行 |
D.通过反应Ⅱ可以计算生成1mol碳碳π键:放出能量 |
您最近一年使用:0次
2 . 工业合成氨的反应为: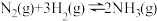 ,在
,在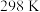 时,
时,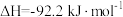 ,
,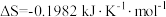 ,特定条件下的速率可表示为
,特定条件下的速率可表示为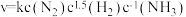 ,其中k为反应速率常数,下列叙述正确的是
,其中k为反应速率常数,下列叙述正确的是
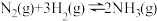 ,在
,在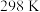 时,
时,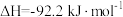 ,
,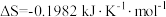 ,特定条件下的速率可表示为
,特定条件下的速率可表示为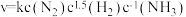 ,其中k为反应速率常数,下列叙述正确的是
,其中k为反应速率常数,下列叙述正确的是A.该反应在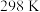 时不能正向自发进行 时不能正向自发进行 |
| B.升高温度、增大压强有利于化学平衡向生成氨的方向移动 |
C.反应体系的三种物质中, 的浓度对反应速率影响最大 的浓度对反应速率影响最大 |
D.反应达到一定转化率时将 从混合气中分离出去会降低反应速率 从混合气中分离出去会降低反应速率 |
您最近一年使用:0次
名校
3 . 下列说法正确的是
| A.放热反应一定是自发反应 | B.熵增的反应不一定是自发反应 |
| C.固体溶解一定是熵减小的过程 | D.非自发反应在任何条件下都不能发生 |
您最近一年使用:0次
2023-01-06更新
|
611次组卷
|
12卷引用:北京海淀区2022-2023学年高二上学期期末考试化学试题
北京海淀区2022-2023学年高二上学期期末考试化学试题北京一零一中学2022-2023高二上学期期末考试化学试题北京市丰台区2023-2024学年高二上学期期中联考(B卷)化学试题北京交通大学附属中学2023-2024学年高二上学期期中考试化学试题北京市中关村中学2023-2024学年高二上学期期中考试化学试题北京市清华大学附属中学朝阳学校2023-2024学年高二上学期期中考试化学试题北京市第三十五中学2023-2024学年高二上学期期中考试化学试题 (已下线)第07讲 化学反应的方向-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)辽宁省辽东南协作校2023-2024学年高二上学期10月月考化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)天津市南开区2023-2024学年高二上学期期末测试化学试题天津市部分区2023-2024学年高二上学期期末练习化学试题
名校
解题方法
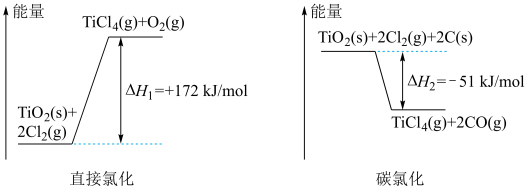
4 . 生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。 转化为
转化为 有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法不正确 的是
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。 转化为
转化为 有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
有直接氯化法和碳氯化法,相关能量示意图如下所示。下列说法
| A.将反应物固体粉碎可以加快直接氯化,碳氯化的反应速率 |
B.可推知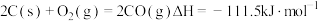 |
| C.判断直接氯化反应能否自发进行需要综合考虑体系的焓变和熵变 |
D.对于碳氯化反应,温度升高,平衡时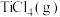 的产率变小 的产率变小 |
您最近一年使用:0次
2023-01-06更新
|
195次组卷
|
2卷引用:北京市朝阳区2022-2023学年高二上学期期末考试化学试题
5 . 下列反应在任何温度下一定能自发进行的是
A.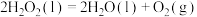  |
B.  |
C.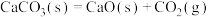  |
D.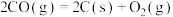  |
您最近一年使用:0次
2023-01-04更新
|
351次组卷
|
3卷引用:北京市清华大学附属中学2022-2023学年高二上学期期末化学试题
北京市清华大学附属中学2022-2023学年高二上学期期末化学试题(已下线)第07讲 化学反应的方向-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)四川省成都市教育科学研究院附属中学2023-2024学年高二上学期10月月考化学试题
6 . 2022北京冬奥会采用氢气作为火炬燃料,选择氢能汽车作为赛事交通服务用车,充分体现了绿色奥运的理念。已知
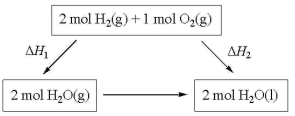
下列说法不正确 的是

下列说法
A. |
B. 的过程中, 的过程中, , , |
C.2mol 和1mol 和1mol 的总能量大于2mol 的总能量大于2mol 的总能量 的总能量 |
D.化学反应的 ,只与反应体系的始态和终态有关,与反应途径无关 ,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
名校
解题方法
7 . 下列说法正确的是
| A.凡是放热反应都是自发反应上 | B.自发反应都是熵增大的反应 |
| C.吸热反应可能是自发反应 | D.凡是需要加热才能发生的反应都是非自发进行的 |
您最近一年使用:0次
2022-12-29更新
|
264次组卷
|
5卷引用:北京市丰台区2022-2023学年高二上学期期中考试化学(A卷)试题
北京市丰台区2022-2023学年高二上学期期中考试化学(A卷)试题 北京市大兴区第一中学2023-2024学年高二上学期期中考试化学试题江西省宜春市八校2022-2023学年高二上学期12月联考化学试题(已下线)第07讲 化学反应的方向-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)江西省宜春市百树学校2023-2024学年高二上学期10月月考化学试卷
解题方法
8 . 钛是世界上具有战略意义的金属,被称为“第三金属”,其产品被应用于航空航天领域。工业上用钛铁矿【主要成分FeTiO3(含Fe2O3杂质)】经过处理,得到钛白粉(TiO2),进一步制备金属钛。
Ⅰ.酸浸法:(工艺流程如下)

(1)混合液中除H+、TiO2+之外,还存在的阳离子有____________ 。
(2)加入过量铁粉,发生反应的离子方程式为___________________ 。
(3)从钛白粉生产TiCl4的反应为:TiO2(s)+2Cl2=TiCl4(l)+O2(g) △H=+161.9kJ/mol,该反应在高温下_____ (填“能”或“不能”)自发进行。理由是:________________ 。
(4)酸浸过程中,在不同温度下,Ti元素的浸出率如图所示。请用化学原理解释温度超过80℃后,浸出率下降的原因________________ 。(浸出率指固体中某元素溶解于液体溶剂中的比例。)

Ⅱ.氯化法:工艺流程如下:
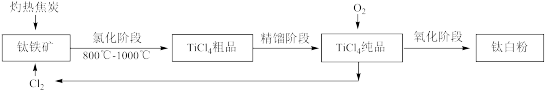
氯化阶段用氯气分解钛原料,使钛化合物转变为四氯化钛,反应方程式为:2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO,再冷却至136℃,精馏提纯,升温氧化(1300℃,氧化阶段产生的Cl2可以循环利用),得到钛白粉。
2FeCl3+2TiCl4+6CO,再冷却至136℃,精馏提纯,升温氧化(1300℃,氧化阶段产生的Cl2可以循环利用),得到钛白粉。
(5)用此方法生产160t纯TiO2,理论上需要消耗Cl2_______ t。【已知:M(TiO2)=80g/mol;M(Cl2)=71g/mol】
Ⅰ.酸浸法:(工艺流程如下)

(1)混合液中除H+、TiO2+之外,还存在的阳离子有
(2)加入过量铁粉,发生反应的离子方程式为
(3)从钛白粉生产TiCl4的反应为:TiO2(s)+2Cl2=TiCl4(l)+O2(g) △H=+161.9kJ/mol,该反应在高温下
(4)酸浸过程中,在不同温度下,Ti元素的浸出率如图所示。请用化学原理解释温度超过80℃后,浸出率下降的原因

Ⅱ.氯化法:工艺流程如下:

氯化阶段用氯气分解钛原料,使钛化合物转变为四氯化钛,反应方程式为:2FeTiO3+6C+7Cl2
 2FeCl3+2TiCl4+6CO,再冷却至136℃,精馏提纯,升温氧化(1300℃,氧化阶段产生的Cl2可以循环利用),得到钛白粉。
2FeCl3+2TiCl4+6CO,再冷却至136℃,精馏提纯,升温氧化(1300℃,氧化阶段产生的Cl2可以循环利用),得到钛白粉。(5)用此方法生产160t纯TiO2,理论上需要消耗Cl2
您最近一年使用:0次
名校
9 . 下列说法中,正确的是
| A.凡是放热反应都是自发反应 |
| B.不自发的化学反应就不能进行 |
| C.凡是熵增大的反应都是自发反应 |
| D.判断反应进行的方向,应综合考虑体系的焓变和熵变 |
您最近一年使用:0次
2022-12-04更新
|
168次组卷
|
4卷引用:北京市西城职业学校2021-2021学年高二上学期期中测试化学试题
名校
10 . 下列说法错误的是
| A.用综合判据来判断反应的自发性更合理 |
| B.△H<0,△S>0的反应在温度低时不能自发进行 |
| C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| D.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
您最近一年使用:0次
2022-11-17更新
|
209次组卷
|
2卷引用:北京师范大学附属昌平学校2023-2024学年高二上学期12月月考化学试题



