名校
1 . 下列说法正确的是
A.保持温度不变,向稀氨水中缓慢通入CO2,溶液中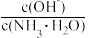 的值增大 的值增大 |
| B.用c(OH-)均为10-3mol/L的NaOH溶液和氨水分别中和等体积等物质的量浓度的盐酸,消耗氨水的体积更大 |
| C.用浓度均为10-2mol/L的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 |
D.常温下,向0.1 mol/L醋酸溶液中加水稀释,溶液中 的值增大 的值增大 |
您最近一年使用:0次
解题方法
2 . 从铜电解液中分离得到的粗硫酸镍晶体中含有大量的杂质元素(Cu、Fe、As、Ca、Zn等),我国科学家对粗硫酸镍进行精制提纯,其工艺流程如下。

已知:i.含镍溶液中的主要离子有:Ni2+、SO 、Cu2+、Fe2+、AsO
、Cu2+、Fe2+、AsO 、Ca2+和Zn2+
、Ca2+和Zn2+
ii.饱和H2S溶液中,c(H2S)≈0.1mol/L
ⅲ.部分物质的电离常数和溶度积常数如下表
(1)H2S是弱电解质,Ka1×Ka2=_______ [用c(H2S)、c(H+)和c(S2−)表示]=1.43×10−20。
(2)滤渣1中含有As2S3和S,写出生成As2S3和S的离子方程式_______ 。
(3)解释“氧化除杂”中析出Fe(OH)3的原因_______ 。
(4)“氟化除杂”中试剂a为_______ 。
(5)“P204萃取”水溶液的pH约为3.3,结合下图解释原因_______ 。

(6)理论上“硫化除杂”之后,溶液中c(Cu2+)=_______ mol/L[计算时c(H2S)取0.1mol/L,结果保留两位有效数字]。

已知:i.含镍溶液中的主要离子有:Ni2+、SO
 、Cu2+、Fe2+、AsO
、Cu2+、Fe2+、AsO 、Ca2+和Zn2+
、Ca2+和Zn2+ii.饱和H2S溶液中,c(H2S)≈0.1mol/L
ⅲ.部分物质的电离常数和溶度积常数如下表
| 物质 | 电离常数 | 物质 | 溶度积常数 | 物质 | 溶度积常数 |
| H2S | Ka1=1.1×10−7 Ka2=1.3×10−13 | CuS | 6.3×10−36 | FeS | 6.3×10−18 |
| NiS | 3.2×10−19 | Ni(OH)2 | 5.5×10−16 | ||
| CaF2 | 4×10−11 | Fe(OH)3 | 2.8×10−39 |
(2)滤渣1中含有As2S3和S,写出生成As2S3和S的离子方程式
(3)解释“氧化除杂”中析出Fe(OH)3的原因
(4)“氟化除杂”中试剂a为
(5)“P204萃取”水溶液的pH约为3.3,结合下图解释原因

(6)理论上“硫化除杂”之后,溶液中c(Cu2+)=
您最近一年使用:0次
2022-04-02更新
|
388次组卷
|
2卷引用:陕西省宝鸡实验高级中学2023-2024学年高三上学期12月联考理科综合试题
名校
3 . 下列图示与对应的叙述相符的是




| A.图甲表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线I为盐酸,且b点溶液的导电性比a点弱 |
| B.图乙所示,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,调节pH在4左右 |
C.图丙表示恒温恒容条件下,2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
| D.图丁为KNO3和NaCl溶解度曲线,若除去NaCl中少量的KNO3,可在较高温度下制得浓溶液后,再冷却结晶、过滤、洗涤、干燥得纯净NaCl |
您最近一年使用:0次
4 . 25 ℃时,按下表配制两份溶液。
下列说法错误的是
| 一元弱酸溶液 | 加入的NaOH溶液 | 混合后所得溶液 |
| HA10.0mL0.20mol·L-1 | 5.0mL0.20mol·L-1 | 溶液I pH=5.0 |
| HB10.0mL0.20mol·L-1 | 5.0mL0.20mol·L-1 | 溶液II pH=4.0 |
| A.溶液Ⅰ中,c(A-)>c(Na+)>c(H+)>c(OH-) |
B.Ⅰ和Ⅱ的pH相差1.0,说明 =10 =10 |
| C.混合Ⅰ和Ⅱ:c(Na+)+c(H+)=c(A-)+c(B-)+c(OH-) |
| D.混合Ⅰ和Ⅱ:c(HA)>c(HB) |
您最近一年使用:0次
2022-03-31更新
|
520次组卷
|
12卷引用:云南省普洱市第一中学2021-2022学年高二下学期3月份考试化学试题
云南省普洱市第一中学2021-2022学年高二下学期3月份考试化学试题湖北省2021年普通高中学业水平选择考适应性测试化学试题(已下线)【绍兴新东方】绍兴高中化学00011(已下线)难点7 溶液稀释与酸碱中和滴定曲线分析-2021年高考化学【热点·重点·难点】专练(新高考)选择性必修1(SJ)专题3专题培优专练(已下线)专题13 水溶液中的离子平衡-2022年高考化学二轮复习重点专题常考点突破练云南省丘北县第一中学校2021-2022学年高二下学期开学考试化学试题湖北省恩施州高中教育联盟2021-2022学年高二上学期期末考试化学试题(已下线)第23讲 盐类水解 (练)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省大连市滨城高中联盟2022-2023学年高二上学期期中考试化学试题(已下线)第八章 水溶液中的离子反应与平衡 第50讲 溶液中“粒子”浓度关系(已下线)微专题 溶液中“粒子”浓度关系
名校
解题方法
5 . 草酸( )是一种常见的二元弱酸,常温下的电离常数为
)是一种常见的二元弱酸,常温下的电离常数为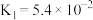 ,
,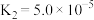 ,其盐草酸钠(
,其盐草酸钠( )可作血液抗凝剂。请回答下列问题。(已知
)可作血液抗凝剂。请回答下列问题。(已知 )
)
(1)常温下,向0.1 mol/L的 溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示,图中Y点对应的pH为
溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示,图中Y点对应的pH为_______ 。

(2)常温下HF的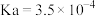 ,等体积的1 mol/L HF与0.5 mol/L
,等体积的1 mol/L HF与0.5 mol/L 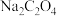 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为_______ 。
(3)在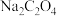 溶液中,下列关系正确的是_______。
溶液中,下列关系正确的是_______。
(4)现有一瓶含草酸钠的血液抗凝剂样品,某化学课外兴趣小组设计如下实验方案测定样品中草酸钠的含量(假设杂质都不与酸性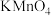 溶液反应)。
溶液反应)。
①样品溶液配制:准确称取4.00 g样品,加入10 mL蒸馏水和30 mL 4 mol/L硫酸溶液溶解,冷却后转入250 mL容量瓶中,定容;
②滴定:准确量取25.00 mL样品溶液于锥形瓶中,利用0.020 mol/L酸性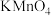 溶液进行滴定、达到滴定终点时,记录相关数据。重复滴定操作两次;
溶液进行滴定、达到滴定终点时,记录相关数据。重复滴定操作两次;
③计算:相关实验数据如下表:
①酸性高锰酸钾与草酸钠反应的离子方程式为_______ 。
②此样品中草酸钠的质量分数为_______ 。
 )是一种常见的二元弱酸,常温下的电离常数为
)是一种常见的二元弱酸,常温下的电离常数为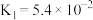 ,
,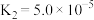 ,其盐草酸钠(
,其盐草酸钠(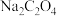 )可作血液抗凝剂。请回答下列问题。(已知
)可作血液抗凝剂。请回答下列问题。(已知 )
)(1)常温下,向0.1 mol/L的
 溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示,图中Y点对应的pH为
溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示,图中Y点对应的pH为
(2)常温下HF的
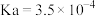 ,等体积的1 mol/L HF与0.5 mol/L
,等体积的1 mol/L HF与0.5 mol/L 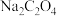 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为(3)在
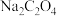 溶液中,下列关系正确的是_______。
溶液中,下列关系正确的是_______。A.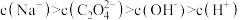 |
B.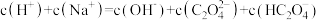 |
C.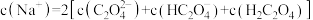 |
D.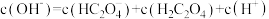 |
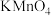 溶液反应)。
溶液反应)。①样品溶液配制:准确称取4.00 g样品,加入10 mL蒸馏水和30 mL 4 mol/L硫酸溶液溶解,冷却后转入250 mL容量瓶中,定容;
②滴定:准确量取25.00 mL样品溶液于锥形瓶中,利用0.020 mol/L酸性
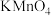 溶液进行滴定、达到滴定终点时,记录相关数据。重复滴定操作两次;
溶液进行滴定、达到滴定终点时,记录相关数据。重复滴定操作两次;③计算:相关实验数据如下表:
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.10 | 20.00 |
| 2 | 1.20 | 21.30 |
| 3 | 0.40 | 18.90 |
②此样品中草酸钠的质量分数为
您最近一年使用:0次
名校
6 . 现有常温下的4种溶液:①
 溶液;②
溶液;② HCl溶液;③
HCl溶液;③ 的氨水:④
的氨水:④ 的NaOH溶液。回答下列问题:
的NaOH溶液。回答下列问题:
(1)在25℃时,若用④滴定未知浓度的 应选用
应选用___________ 作指示剂。
(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是___________ 。
(3)若将①④混合后所得溶液中的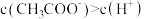 ,则下列说法正确的是___________(填序号)
,则下列说法正确的是___________(填序号)
(4)若将②③混合后所得溶液的 ,则消耗溶液的体积:②
,则消耗溶液的体积:②___________ ③(填“>”“<”或“=”)。
(5)若将②④混合后所得溶液的 ,则消耗②和④溶液的体积比:
,则消耗②和④溶液的体积比:
___________ 。
(6)在25℃时,将bmol/L的KCN溶液与②等体积混合,反应达到平衡时,测得溶液 ,则KCN溶液的物质的量浓度b
,则KCN溶液的物质的量浓度b___________ 0.01 mol/L(填“>”、“<”或“=”);用含b的代数式表示HCN的电离常数
___________ 。

 溶液;②
溶液;② HCl溶液;③
HCl溶液;③ 的氨水:④
的氨水:④ 的NaOH溶液。回答下列问题:
的NaOH溶液。回答下列问题:(1)在25℃时,若用④滴定未知浓度的
 应选用
应选用(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是
(3)若将①④混合后所得溶液中的
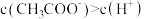 ,则下列说法正确的是___________(填序号)
,则下列说法正确的是___________(填序号)| A.溶液一定呈酸性 | B.溶液一定呈碱性 |
| C.溶液一定呈中性 | D.溶液可能呈酸性、中性或碱性 |
 ,则消耗溶液的体积:②
,则消耗溶液的体积:②(5)若将②④混合后所得溶液的
 ,则消耗②和④溶液的体积比:
,则消耗②和④溶液的体积比:
(6)在25℃时,将bmol/L的KCN溶液与②等体积混合,反应达到平衡时,测得溶液
 ,则KCN溶液的物质的量浓度b
,则KCN溶液的物质的量浓度b
您最近一年使用:0次
名校
解题方法
7 . 下列操作、现象和结论都正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将 的氨水稀释成 的氨水稀释成 ,测量稀释前后溶液pH,发现稀释后pH减小 ,测量稀释前后溶液pH,发现稀释后pH减小 | 稀释后 电离程度减小 电离程度减小 |
| B | 向含有酚酞的 溶液中加入少量 溶液中加入少量 固体,观察到溶液红色变浅 固体,观察到溶液红色变浅 | 证明 溶液中存在水解平衡 溶液中存在水解平衡 |
| C | 25℃时用pH试纸测得: 溶液的pH约为8, 溶液的pH约为8, 溶液的pH约为9 溶液的pH约为9 |  电离出 电离出 的能力比 的能力比 的弱 的弱 |
| D | 在一支50mL酸式滴定管中装入盐酸,液面恰好在10mL刻度处,把管内液体全部放出盛入量筒内 | 量筒内所得液体体积是40.0mL |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-30更新
|
91次组卷
|
2卷引用:四川省资阳中学2021-2022学年高二下学期3月月考化学试题
名校
8 . 用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.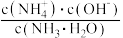 | B.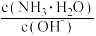 |
C. 和 和 的乘积 的乘积 | D. 的物质的量 的物质的量 |
您最近一年使用:0次
名校
9 . 室温下,通过下列实验探究NaHSO3溶液的性质。
实验1:用pH试纸测量0.1mol·L-1NaHSO3溶液的pH,测得pH约为5。
实验2:向10mL0.1mol·L-1NaHSO3溶液中加入等体积0.1mol·L-1氨水溶液,充分混合,溶液pH约为9。
实验3:向10mL0.1mol·L-1Na2CO3溶液中滴加几滴0.1mol·L-1NaHSO3溶液,无明显现象。
实验4:向10mL0.1mol·L-1NaHSO3溶液中加入10mL0.05mol·L-1Ba(ClO)2溶液,产生白色沉淀。
下列有关说法正确的是
实验1:用pH试纸测量0.1mol·L-1NaHSO3溶液的pH,测得pH约为5。
实验2:向10mL0.1mol·L-1NaHSO3溶液中加入等体积0.1mol·L-1氨水溶液,充分混合,溶液pH约为9。
实验3:向10mL0.1mol·L-1Na2CO3溶液中滴加几滴0.1mol·L-1NaHSO3溶液,无明显现象。
实验4:向10mL0.1mol·L-1NaHSO3溶液中加入10mL0.05mol·L-1Ba(ClO)2溶液,产生白色沉淀。
下列有关说法正确的是
| A.实验1可得出:Ka1(H2SO3)·Ka2(H2SO3)<Kw |
B.实验2所得溶液中存在:c(H+)+2c(H2SO3)+c( )=c(OH-)+c(NH3·H2O) )=c(OH-)+c(NH3·H2O) |
| C.实验3可得出:Ka2(H2SO3)<Ka1(H2CO3) |
D.实验4所发生反应的离子方程式为 +Ba2++ClO-=BaSO3↓+HClO +Ba2++ClO-=BaSO3↓+HClO |
您最近一年使用:0次
2022-03-29更新
|
363次组卷
|
2卷引用:江苏省响水中学2021-2022学年高二下学期第二次学情分析考试化学试题
10 . 下列说法不正确的是
| A.将水逐滴加入冰醋酸中,溶液的导电性和醋酸的电离度均先增大后减小 |
B.常温下, 均为9的醋酸钠和氢氧化钠溶液混合后 均为9的醋酸钠和氢氧化钠溶液混合后 不变 不变 |
C.常温下, 溶液和 溶液和 溶液的离子总数不相同 溶液的离子总数不相同 |
D.常温下,中和 和体积均相等的 和体积均相等的 溶液, 溶液, 溶液消耗 溶液消耗 的物质的量更多 的物质的量更多 |
您最近一年使用:0次
2022-03-29更新
|
151次组卷
|
3卷引用:浙江省普通高中强基联盟2021-2022学年高三下学期3月统测化学试题



