1 . 次硫酸氢钠甲醛(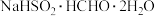 ,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓
,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓 、
、 、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
(1)制备 :实验室常用
:实验室常用 与浓
与浓 反应制取
反应制取 。
。
① 分子的空间结构为
分子的空间结构为___________ 。
②工业生产中常用氨水处理废气中 ,写出足量氨水吸收
,写出足量氨水吸收 的离子方程式:
的离子方程式:___________ 。
(2)制备 溶液:在三颈烧瓶中加入一定量
溶液:在三颈烧瓶中加入一定量 固体和
固体和 ,搅拌溶解,再缓慢通入
,搅拌溶解,再缓慢通入 ,实验装置如图所示(夹持仪器已省略)。
,实验装置如图所示(夹持仪器已省略)。 溶液吸收
溶液吸收 的过程中,
的过程中,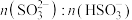 及
及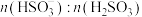 等于1时,溶液的pH分别为7.2、2。
等于1时,溶液的pH分别为7.2、2。
①装置E的作用是___________ ,装置X的名称为___________ 。
②常温下,当溶液中 时,溶液的pH为
时,溶液的pH为___________ 。
(3)制备次硫酸氢钠甲醛:(2)中充分反应后,将装置D中导气管换成橡皮塞,向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
①生成 [副产物为
[副产物为 ]时发生反应的化学方程式为
]时发生反应的化学方程式为___________ 。
②将上述抽滤所得的滤液经___________ 步骤,过滤得到产品。
(4)测定产品的纯度:准确称取8.0 g产品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知 不能氧化甲醛,S元素转化为
不能氧化甲醛,S元素转化为 ,杂质不反应),加入
,杂质不反应),加入 溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为
溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为___________ 。
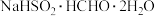 ,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓
,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓 、
、 、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:(1)制备
 :实验室常用
:实验室常用 与浓
与浓 反应制取
反应制取 。
。①
 分子的空间结构为
分子的空间结构为②工业生产中常用氨水处理废气中
 ,写出足量氨水吸收
,写出足量氨水吸收 的离子方程式:
的离子方程式:(2)制备
 溶液:在三颈烧瓶中加入一定量
溶液:在三颈烧瓶中加入一定量 固体和
固体和 ,搅拌溶解,再缓慢通入
,搅拌溶解,再缓慢通入 ,实验装置如图所示(夹持仪器已省略)。
,实验装置如图所示(夹持仪器已省略)。
 溶液吸收
溶液吸收 的过程中,
的过程中,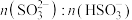 及
及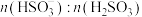 等于1时,溶液的pH分别为7.2、2。
等于1时,溶液的pH分别为7.2、2。①装置E的作用是
②常温下,当溶液中
 时,溶液的pH为
时,溶液的pH为(3)制备次硫酸氢钠甲醛:(2)中充分反应后,将装置D中导气管换成橡皮塞,向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
①生成
 [副产物为
[副产物为 ]时发生反应的化学方程式为
]时发生反应的化学方程式为②将上述抽滤所得的滤液经
(4)测定产品的纯度:准确称取8.0 g产品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知
 不能氧化甲醛,S元素转化为
不能氧化甲醛,S元素转化为 ,杂质不反应),加入
,杂质不反应),加入 溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为
溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为
您最近一年使用:0次
名校
解题方法
2 . 一种锂离子电池的工作原理: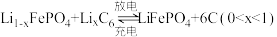 。从废旧电池再生
。从废旧电池再生 的一种流程如下,
的一种流程如下,
负极: 。
。
正极:_______ 。
(2)为保证正极材料在空气中充分反应,可采取的措施是_______ (答一条即可)。
(3)向浸出液中加入氨水调节溶液pH,有沉淀生成。pH对沉淀中Fe和P的物质的量之比 的影响如图所示。
的影响如图所示。 分别与
分别与 、
、 、
、 形成的化合物均难溶于水。
形成的化合物均难溶于水。
ii. 体系中含磷粒子的物质的量分数与pH的关系如图所示。
体系中含磷粒子的物质的量分数与pH的关系如图所示。 沉淀的最佳
沉淀的最佳 在
在_______ 左右。
②当 时,沉淀中一定有的含铁物质是
时,沉淀中一定有的含铁物质是 和
和_______ (填化学式)。
③若向 的浊液中继续加入氨水至
的浊液中继续加入氨水至 ,会导致
,会导致 的值增大,主要反应的化学方程式是
的值增大,主要反应的化学方程式是_______ 。
(4)下列关于该流程的说法正确的是_______(填序号)。
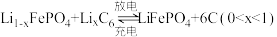 。从废旧电池再生
。从废旧电池再生 的一种流程如下,
的一种流程如下,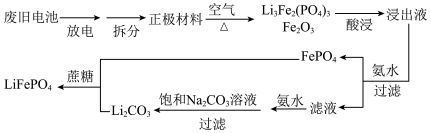
负极:
 。
。正极:
(2)为保证正极材料在空气中充分反应,可采取的措施是
(3)向浸出液中加入氨水调节溶液pH,有沉淀生成。pH对沉淀中Fe和P的物质的量之比
 的影响如图所示。
的影响如图所示。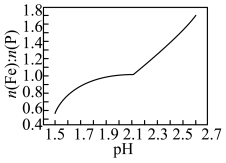
 分别与
分别与 、
、 、
、 形成的化合物均难溶于水。
形成的化合物均难溶于水。ii.
 体系中含磷粒子的物质的量分数与pH的关系如图所示。
体系中含磷粒子的物质的量分数与pH的关系如图所示。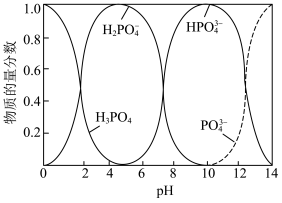
 沉淀的最佳
沉淀的最佳 在
在②当
 时,沉淀中一定有的含铁物质是
时,沉淀中一定有的含铁物质是 和
和③若向
 的浊液中继续加入氨水至
的浊液中继续加入氨水至 ,会导致
,会导致 的值增大,主要反应的化学方程式是
的值增大,主要反应的化学方程式是(4)下列关于该流程的说法正确的是_______(填序号)。
A.正极材料在空气中加热,理论上生成的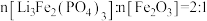 |
B.当浸出液的pH从0增大为2时,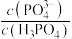 的值增大了 的值增大了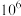 倍 倍 |
C.向滤液中加入氨水,可减少饱和 溶液的用量 溶液的用量 |
D.由 和 和 再生 再生 时,所加的蔗糖作氧化剂 时,所加的蔗糖作氧化剂 |
您最近一年使用:0次
3 . 研究弱电解质的电离及盐的水解,有重要的实际意义。
(1)醋酸的电离方程式为_______ 。
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
(3)某些弱酸在25℃时的电离常数(Ka)如表:
①同浓度的 CH3COOH、H2CO3、HClO 溶液的 pH 最大的是_______ 。
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______ (填字母序号,下同)。
A.c(H⁺) B.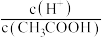 C.
C.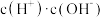 D.
D. E.
E. 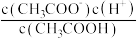
③若该溶液升高温度,上述5种表达式的数据减小的是_______ 。
④下列反应可以发生的是_______ (填标号)。
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式_______ 。
(5)已知 。
。 属于
属于_______ (填“一”“二”或“三”)元酸, 属于
属于_______ (填“正盐”或“酸式盐”)。
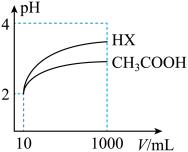
(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数_______ (填“大于”、“等于”或“小于”)醋酸的平衡常数。 稀释后,HX 溶液中有水电离出来的c(H⁺)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中有水电离出来的c(H⁺),理由是_______ 。
(1)醋酸的电离方程式为
(2)下列事实不能说明CH3COOH是弱电解质的是_______(填标号)。
| A.相同温度下,浓度均为1mol/L的盐酸和醋酸的导电性对比:盐酸明显大于醋酸 |
| B.1mol/LCH3COONa溶液能使紫色石蕊试液变蓝 |
| C.25℃时,1 mol/LCH3COOH溶液的pH约为2 |
| D.10 mL1mol/L的CH3COOH溶液恰好与10 mL 1 mol/LNaOH溶液完全反应 |
(3)某些弱酸在25℃时的电离常数(Ka)如表:
| 化学式 | CH3COOH | HCN | HClO | H2CO3 |
| 电离常数(Ka) | 1.8×10-5 | 4.9×10 -10 | 3.0×10-8 | Ka1=4.4×10-7,Ka2=4.7×10-11 |
②常温下 0.1mol/L的 CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H⁺) B.
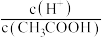 C.
C.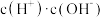 D.
D. E.
E. 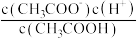
③若该溶液升高温度,上述5种表达式的数据减小的是
④下列反应可以发生的是
A. CH3COOH+ Na2CO3=NaHCO3 +CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
D. NaHCO3+HCN=NaCN+H2O+CO2↑
(4)肼(N2H4)是一种二元弱碱,在水中的电离方式与NH3相似,写出第一步电离的离子方程式
(5)已知
 。
。 属于
属于 属于
属于(6)体积为 10mL pH=2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至1000mL, 稀释过程pH变化如图:则HX的电离平衡常数
您最近一年使用:0次
4 . 硫酸盐(含 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: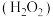 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。
① 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生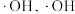 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:
反应Ⅰ: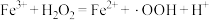 (慢反应);
(慢反应);
反应Ⅱ: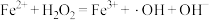 (快反应).
(快反应).
下列说法正确的是________ (填选项字母)。
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气, 氧化
氧化 的反应速率加快
的反应速率加快
D.与 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高
②研究表明 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:
Ⅰ.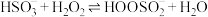 ;
;
Ⅱ.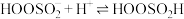 ;
;
Ⅲ.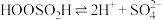 。
。
由此可判断,该条件下的 值为
值为__________ (填“ ”“
”“ ”或“
”或“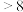 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:____________ 。
(2) 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
Ⅰ.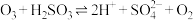 ;
;
Ⅱ. ;
;
Ⅲ.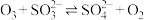 。
。
在含硫微粒总的物质的量为 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得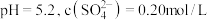 ,则
,则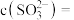
____________ (保留两位有效数字,请写出计算过程)。
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示: 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠________________ 形成;写出 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:____________________ 。
②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是________________ 。
 )气溶胶是雾霾的主要成分,主要通过
)气溶胶是雾霾的主要成分,主要通过 转化产生。不同
转化产生。不同 条件下
条件下 在水溶液中的主要存在形态及其对应的物质的量分数如图所示:
在水溶液中的主要存在形态及其对应的物质的量分数如图所示: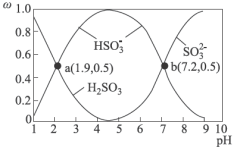
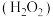 是大气中重要的氧化剂,其有多种途径将
是大气中重要的氧化剂,其有多种途径将 氧化成硫酸盐。
氧化成硫酸盐。①
 可在催化剂
可在催化剂 或
或 的作用下产生
的作用下产生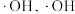 能将
能将 氧化。
氧化。 产生的机理如下:
产生的机理如下:反应Ⅰ:
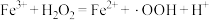 (慢反应);
(慢反应);反应Ⅱ:
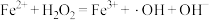 (快反应).
(快反应).下列说法正确的是
A.反应涉及非极性键的断裂与形成
B.反应Ⅰ的活化能大于反应Ⅱ
C.向固定容积的反应体系中充入氦气,
 氧化
氧化 的反应速率加快
的反应速率加快D.与
 作催化剂相比,相同条件下
作催化剂相比,相同条件下 作催化剂时
作催化剂时 氧化效率可能更高
氧化效率可能更高②研究表明
 与
与 水溶液的反应机理如下:
水溶液的反应机理如下:Ⅰ.
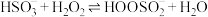 ;
;Ⅱ.
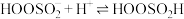 ;
;Ⅲ.
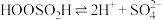 。
。由此可判断,该条件下的
 值为
值为 ”“
”“ ”或“
”或“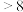 ”);请写出该过程中
”);请写出该过程中 与
与 总反应的离子方程式:
总反应的离子方程式:(2)
 与
与 水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:
水溶液的反应是硫酸盐产生的另一个重要途径.主要反应如下:Ⅰ.
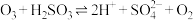 ;
;Ⅱ.
 ;
;Ⅲ.
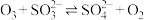 。
。在含硫微粒总的物质的量为
 的
的 水溶液中加入适量
水溶液中加入适量 固体,再通入
固体,再通入 ,反应一段时间后,测得
,反应一段时间后,测得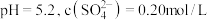 ,则
,则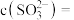
(3)科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制,如图所示:
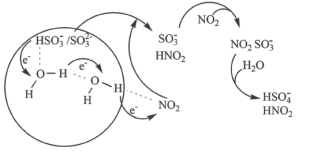
 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水分子桥”主要靠
分子。观察图示可知“水分子桥”主要靠 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:②事实上,上述机理只能解释酸雨等现象的形成,却不能解释雾霾中固体硫酸盐小颗粒的存在。进一步研究发现,氨气在雾霾的形成过程中也起到了重要作用,其作用可能是
您最近一年使用:0次
2024-05-24更新
|
126次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
解题方法
5 . 二氧化硫是一种使人们爱恨交加的物质,爱其作为一种化工原料,为人类提供物质基础,恨其有毒,对人类即环境的危害。联系工业生产中用碱液吸收含 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: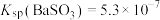 。
。
(1)利用85%的浓硫酸和 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。
(2) 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。
某同学查阅资料:常温时, ,
,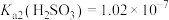 。
。
某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是________ (填微粒化学式)。
(3)“性质实验装置”中将 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀:________________ ;有同学结合“性质实验”反应物的组成及性质推断该沉淀为 ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是________________ 。请你设计实验探究该反应的生成物是 ,而不是
,而不是 :
:________________ 。
(4)在“性质实验装置”中制备少量硫代硫酸钠( ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为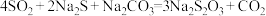 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中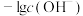 、
、 的质量变化关系如下图:
的质量变化关系如下图: 的生成量曲线为
的生成量曲线为________ (填“甲”或“乙”),曲线乙Q点后出现急剧下降的原因是________ 。
(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用________ 。
 制的尾气,某同学对实验室中
制的尾气,某同学对实验室中 制备与性质实验的尾气采用
制备与性质实验的尾气采用 溶液吸收,装置如下:
溶液吸收,装置如下: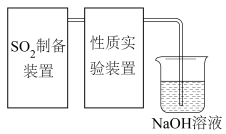
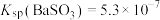 。
。(1)利用85%的浓硫酸和
 ,固体反应制备
,固体反应制备 ,下述“
,下述“ 制备装置”合理的是________。
制备装置”合理的是________。A.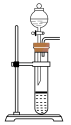 | B. | C.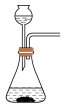 | D.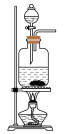 |
(2)
 溶液吸收
溶液吸收 后生成物与反应物的量有关,能生成
后生成物与反应物的量有关,能生成 或
或 。
。某同学查阅资料:常温时,
 ,
,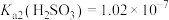 。
。某次实验结束后,该同学通过数字实验,用pH传感器测得吸收液的
 (常温),则该混合液中含硫物种物质的量浓度最大的是
(常温),则该混合液中含硫物种物质的量浓度最大的是(3)“性质实验装置”中将
 通入到
通入到 的
的 溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是
溶液中,生成白色沉淀,通过化学平衡常数计算,确定该沉淀不是 沉淀:
沉淀: ,若忽略空气中
,若忽略空气中 的影响,则该性质实验中生成
的影响,则该性质实验中生成 的离子方程式是
的离子方程式是 ,而不是
,而不是 :
:(4)在“性质实验装置”中制备少量硫代硫酸钠(
 ),该装置中装有
),该装置中装有 、
、 混合液,发生的反应为
混合液,发生的反应为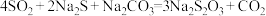 ,通入
,通入 的过程中,数字传感器测得溶液中
的过程中,数字传感器测得溶液中 、
、 的质量变化关系如下图:
的质量变化关系如下图: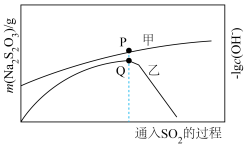
 的生成量曲线为
的生成量曲线为(5)化学反应速率不仅影响生产,还影响人们的生活质量,写出生活中减缓化学反应速率的一种应用
您最近一年使用:0次
6 . Ⅰ.太空很神秘,水的世界也深不可测,从水作溶剂、水分子运动到水的电离、水与活泼金属反应等等。结合书本知识,回答下列问题:
(1)标准状况下,0.01 的NaOH溶液的pH
的NaOH溶液的pH_______ (填“>”“<”或“=”,下同)12,该温度下,水的离子积常数
_______  。
。
(2)T℃下,水的离子积曲线如图所示。_______ (填字母)。
a.T℃小于25℃
b.A点溶液pH=8
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将 L pH=a NaOH溶液与
L pH=a NaOH溶液与 L
L 硫酸混合。
硫酸混合。
若所得混合溶液呈中性,且a=12,b=1,则
_______ ;若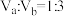 ,且a=11,b=3,则所得混合溶液的pH=
,且a=11,b=3,则所得混合溶液的pH=_______ 。
(3)现有以下五种电解质溶液,回答下列问题:
① ②NaOH ③
②NaOH ③ ④
④ ⑤
⑤
①浓度均为0.1 的五种溶液中导电能力最强的是
的五种溶液中导电能力最强的是_______ (填序号)。
②浓度均为0.1 的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为
的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为_______ (填序号)。
Ⅱ. 、
、 、
、 是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
回答下列问题:
(4)常温下,下列事实能说明 是弱电解质的是
是弱电解质的是_______ (填写序号)
① 与水能以任意比互溶
与水能以任意比互溶
②0.1mol/L 溶液导电能力比0.1mol/L盐酸弱
溶液导电能力比0.1mol/L盐酸弱
③常温下pH=3的 溶液稀释十倍后pH<4
溶液稀释十倍后pH<4
④ 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大
⑥大小相同的锌片与同体积同浓度的盐酸和 反应,产生
反应,产生 的物质的量相同
的物质的量相同
(5)已知 ,则常温下
,则常温下
 溶液的pH=
溶液的pH=_______ 。用水缓慢稀释该氨水的过程中,溶液中随着水量的增加,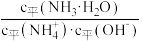
_______ 。(填“增大”“减小”或“不变”)
(1)标准状况下,0.01
 的NaOH溶液的pH
的NaOH溶液的pH
 。
。(2)T℃下,水的离子积曲线如图所示。
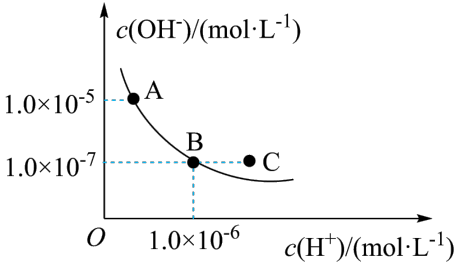
a.T℃小于25℃
b.A点溶液pH=8
c.B点溶液呈碱性
d.保持温度不变,加入少量的酸可以实现从B点到C点的变化
②该温度下,将
 L pH=a NaOH溶液与
L pH=a NaOH溶液与 L
L 硫酸混合。
硫酸混合。若所得混合溶液呈中性,且a=12,b=1,则

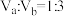 ,且a=11,b=3,则所得混合溶液的pH=
,且a=11,b=3,则所得混合溶液的pH=(3)现有以下五种电解质溶液,回答下列问题:
①
 ②NaOH ③
②NaOH ③ ④
④ ⑤
⑤
①浓度均为0.1
 的五种溶液中导电能力最强的是
的五种溶液中导电能力最强的是②浓度均为0.1
 的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为
的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为Ⅱ.
 、
、 、
、 是中学化学中常见的物质,常温下,有关物质的电离常数如下表:
是中学化学中常见的物质,常温下,有关物质的电离常数如下表:| 物质 |  |  |  |
| 电离常数 | 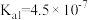 , ,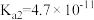 | 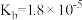 |  |
(4)常温下,下列事实能说明
 是弱电解质的是
是弱电解质的是①
 与水能以任意比互溶
与水能以任意比互溶②0.1mol/L
 溶液导电能力比0.1mol/L盐酸弱
溶液导电能力比0.1mol/L盐酸弱③常温下pH=3的
 溶液稀释十倍后pH<4
溶液稀释十倍后pH<4④
 溶液能与
溶液能与 溶液反应放出
溶液反应放出
⑤向
 溶液中加入
溶液中加入 固体,溶液pH增大
固体,溶液pH增大⑥大小相同的锌片与同体积同浓度的盐酸和
 反应,产生
反应,产生 的物质的量相同
的物质的量相同(5)已知
 ,则常温下
,则常温下
 溶液的pH=
溶液的pH=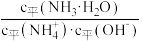
您最近一年使用:0次
解题方法
7 . 全球大气 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知25℃时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:
①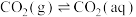

②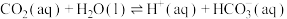

过程①的混合平衡常数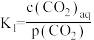 ,其中
,其中 表示溶液中的
表示溶液中的 浓度,
浓度,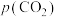 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
_______ (填“增大”或“减小”);当大气压强为akPa,溶液中的 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为_______ 。
(2)由 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应 。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。_______ ,有催化剂时决速步骤的活化能为_______ eV。
(3) 催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为
催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为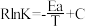 (其中Ea为活化能,K为速率常数,R和C为常数)。
(其中Ea为活化能,K为速率常数,R和C为常数)。
①该反应的活化能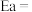
_______ kJ/mol;
②当使用更高效的催化剂时,在图中画出Rlnk与 关系的示意图
关系的示意图_______ 。 催化加氢制甲醇过程中也存在竞争反应
催化加氢制甲醇过程中也存在竞争反应
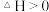 ,在恒温密闭容器中,维持压强和投料比不变,将
,在恒温密闭容器中,维持压强和投料比不变,将 和
和 按一定流速通过反应器,
按一定流速通过反应器, 转化率和甲醇选择性
转化率和甲醇选择性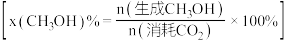 随温度变化关系如下图所示:
随温度变化关系如下图所示:_______ 。
②在压强为P的恒温恒压密闭容器中,加入 和
和 反应并达到平衡状态
反应并达到平衡状态 平衡转化率为20%,甲醇的选择性为50%,计算
平衡转化率为20%,甲醇的选择性为50%,计算 ,在该温度下的平衡常数
,在该温度下的平衡常数
_______ (列出计算式)。
 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:(1)已知25℃时,大气中的
 溶于水存在以下过程:
溶于水存在以下过程:①
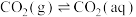

②
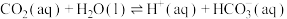

过程①的混合平衡常数
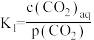 ,其中
,其中 表示溶液中的
表示溶液中的 浓度,
浓度,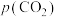 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为(2)由
 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应 。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
。在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。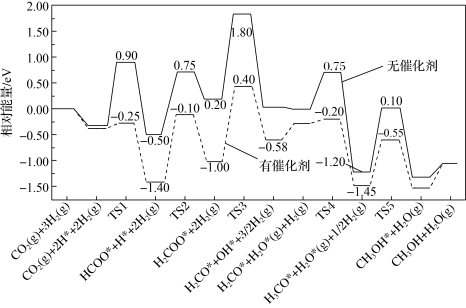
(3)
 催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为
催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图所示,已知Arthenius经验公式为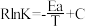 (其中Ea为活化能,K为速率常数,R和C为常数)。
(其中Ea为活化能,K为速率常数,R和C为常数)。①该反应的活化能
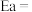
②当使用更高效的催化剂时,在图中画出Rlnk与
 关系的示意图
关系的示意图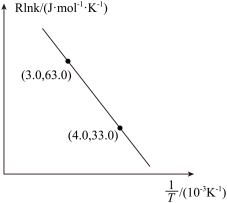
 催化加氢制甲醇过程中也存在竞争反应
催化加氢制甲醇过程中也存在竞争反应
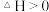 ,在恒温密闭容器中,维持压强和投料比不变,将
,在恒温密闭容器中,维持压强和投料比不变,将 和
和 按一定流速通过反应器,
按一定流速通过反应器, 转化率和甲醇选择性
转化率和甲醇选择性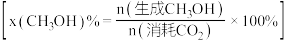 随温度变化关系如下图所示:
随温度变化关系如下图所示: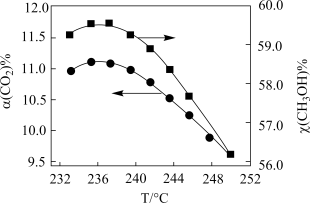
②在压强为P的恒温恒压密闭容器中,加入
 和
和 反应并达到平衡状态
反应并达到平衡状态 平衡转化率为20%,甲醇的选择性为50%,计算
平衡转化率为20%,甲醇的选择性为50%,计算 ,在该温度下的平衡常数
,在该温度下的平衡常数
您最近一年使用:0次
8 . 在菠菜等植物中含有丰富的草酸,草酸对生命活动有重要影响。
 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数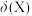 随pH的变化如图所示:
随pH的变化如图所示: )在水中的电离方程式:
)在水中的电离方程式:___________ 。
(2)要使溶液中草酸的电离程度增大,采取的措施为___________ 。(写两点)
(3)草酸溶液中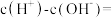
___________ 。(用含碳微粒表示)
(4)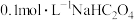 溶液中
溶液中
___________  。(填“<”“>”“=”)
。(填“<”“>”“=”)
(5) 时,
时,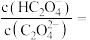
___________ 。

 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 的物质的量分数
的物质的量分数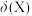 随pH的变化如图所示:
随pH的变化如图所示: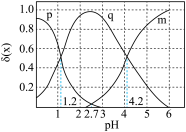
 )在水中的电离方程式:
)在水中的电离方程式:(2)要使溶液中草酸的电离程度增大,采取的措施为
(3)草酸溶液中
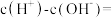
(4)
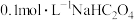 溶液中
溶液中
 。(填“<”“>”“=”)
。(填“<”“>”“=”)(5)
 时,
时,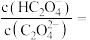
您最近一年使用:0次
解题方法
9 . 硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①
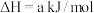
②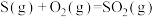
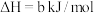
写出H2S(g)完全燃烧的热化学方程式_______ 。
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是_______ 。_______ ;
②若无能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。_______ 7(填“<”或“>”或“=”)。
②Na2HPO3其水解平衡常数
_______ (填数值)。
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为_______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①

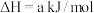
②
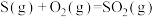
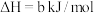
写出H2S(g)完全燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是


②若无能量损失,相同条件下,SO2和NO的体积比为
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数(
 )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
②Na2HPO3其水解平衡常数

(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为
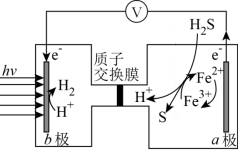
您最近一年使用:0次
名校
10 . 电离平衡常数和电离度(电离度是指已电离的电解质分子数占原来总分子数的百分比)均可衡量弱电解质的电离,下表是常温下几种弱酸的电离平衡常数( )和弱碱的电离平衡常数(
)和弱碱的电离平衡常数( ),回答下列问题∶
),回答下列问题∶
(1) 的水溶液呈
的水溶液呈______ (填“酸性”、“中性”或“碱性”),理由是______ 。
(2)现测得溶解了 的某盐酸的pH=4,则该溶液中
的某盐酸的pH=4,则该溶液中 的电离度约为
的电离度约为______ 。
(3)常温下,浓度相同的三种溶液NaF、 、
、 ,pH由大到小的顺序是
,pH由大到小的顺序是______ 。
(4)将过量 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为______ 。
 )和弱碱的电离平衡常数(
)和弱碱的电离平衡常数( ),回答下列问题∶
),回答下列问题∶| 弱酸或弱碱 | HF |  |  |  |  |
| 电离平衡常数 | 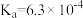 |  | 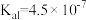 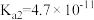 |  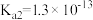 | 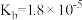 |
 的水溶液呈
的水溶液呈(2)现测得溶解了
 的某盐酸的pH=4,则该溶液中
的某盐酸的pH=4,则该溶液中 的电离度约为
的电离度约为(3)常温下,浓度相同的三种溶液NaF、
 、
、 ,pH由大到小的顺序是
,pH由大到小的顺序是(4)将过量
 通入
通入 溶液中,反应的离子方程式为
溶液中,反应的离子方程式为
您最近一年使用:0次



