名校
1 .  是大气的主要污染物。研究消除
是大气的主要污染物。研究消除 的方法和机理一直是环境专家不断追求的目标。
的方法和机理一直是环境专家不断追求的目标。
I二氧化硫在 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。
(1)二氧化硫在 催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
①
②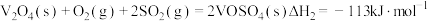
③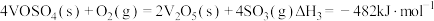
则
_______ 。
(2)硫酸生产中, 催化氧化生成
催化氧化生成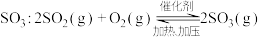 。某温度下,
。某温度下, 的平衡转化率(
的平衡转化率( )与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
)与体系总压强(p)的关系如下图所示。根据图示回答下列问题: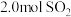 和
和 置于10L密闭容器中,反应达平衡后,体系总压强为
置于10L密闭容器中,反应达平衡后,体系总压强为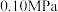 。该反应的平衡常数等于
。该反应的平衡常数等于_______ 。
②平衡状态由A变到B时,平衡常数
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅱ.二氧化硫在一定条件下可以发生如下反应:
 。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定
进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率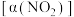 。部分实验结果如图所示:
。部分实验结果如图所示:_______ 。
(4)若A点对应实验中,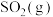 的起始浓度为
的起始浓度为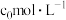 ,经过
,经过 达到平衡状态,则该时段化学反应速率
达到平衡状态,则该时段化学反应速率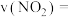
_______  。
。
(5)图中C、D两点对应的实验温度分别为 和
和 ,通过计算判断:
,通过计算判断:
_______  (填或“<” “=”或“<”)。
(填或“<” “=”或“<”)。
Ⅲ.东南大学化工团队在酸性的条件下,以电化学原理消除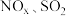 ,同时又变废为宝。
,同时又变废为宝。
(6)写出 转化的电极反应方程式:
转化的电极反应方程式: _______ 。
 。
。 的稀硫酸中,
的稀硫酸中,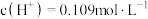 ,求硫酸第二步电离的电离常数:
,求硫酸第二步电离的电离常数:_______ (结果保留三位有效数字)。
 是大气的主要污染物。研究消除
是大气的主要污染物。研究消除 的方法和机理一直是环境专家不断追求的目标。
的方法和机理一直是环境专家不断追求的目标。I二氧化硫在
 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。(1)二氧化硫在
 催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:①

②
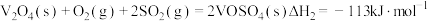
③
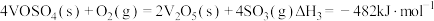
则

(2)硫酸生产中,
 催化氧化生成
催化氧化生成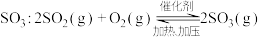 。某温度下,
。某温度下, 的平衡转化率(
的平衡转化率( )与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
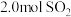 和
和 置于10L密闭容器中,反应达平衡后,体系总压强为
置于10L密闭容器中,反应达平衡后,体系总压强为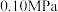 。该反应的平衡常数等于
。该反应的平衡常数等于②平衡状态由A变到B时,平衡常数

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。Ⅱ.二氧化硫在一定条件下可以发生如下反应:
 。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定
进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率 。部分实验结果如图所示:
。部分实验结果如图所示: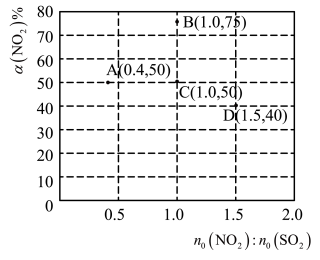
(4)若A点对应实验中,
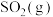 的起始浓度为
的起始浓度为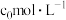 ,经过
,经过 达到平衡状态,则该时段化学反应速率
达到平衡状态,则该时段化学反应速率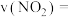
 。
。(5)图中C、D两点对应的实验温度分别为
 和
和 ,通过计算判断:
,通过计算判断:
 (填或“<” “=”或“<”)。
(填或“<” “=”或“<”)。Ⅲ.东南大学化工团队在酸性的条件下,以电化学原理消除
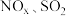 ,同时又变废为宝。
,同时又变废为宝。(6)写出
 转化的电极反应方程式:
转化的电极反应方程式: 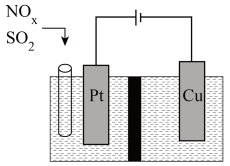

 。
。 的稀硫酸中,
的稀硫酸中,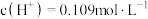 ,求硫酸第二步电离的电离常数:
,求硫酸第二步电离的电离常数:
您最近一年使用:0次
名校
解题方法
2 . Ⅰ、按要求回答下列问题:
(1)常温下,有关下列四种溶液的说法正确的是___________。
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=___________ mol·L−1。
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g) CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:___________ (填“>”“<”或“=”)0。
②写出一条可同时提高反应速率和H2平衡转化率的措施:___________ 。
③保证该压强不变,向T1温度下, =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡___________ (填“正向”“逆向”或“不”)移动。
(1)常温下,有关下列四种溶液的说法正确的是___________。
| ① | ② | ③ | ④ |
| 0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
| A.由水电离出的c(H+):③>① |
| B.①稀释到原来的100倍,pH与②相同 |
C.①与③混合,若溶液pH=7,则溶液中c(NH )>c(Cl-) )>c(Cl-) |
| D.②与④等体积混合,混合溶液的pH>7 |
(3)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=Ⅱ、氢气可以用于合成甲醇的反应为CO(g)+2H2(g)
 CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示:
CH3OH(g) ΔH4,在恒压条件下测得H2的平衡转化率与温度和投料比关系如图所示: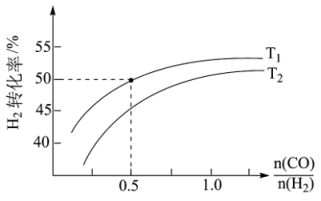
②写出一条可同时提高反应速率和H2平衡转化率的措施:
③保证该压强不变,向T1温度下,
 =0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
=0.5的平衡体系中再加入2molCO、4molH2、2molCH3OH,则化学平衡
您最近一年使用:0次
名校
解题方法
3 . 化学上的缓冲溶液就是外加少量酸、碱后而pH值基本不变的溶液。
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式___________ 、___________ 。
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为___________ ,反应后溶液中c(H+)=___________ mol/L。
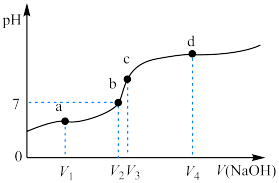
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为___________ ;c点恰好完全反应,该处溶液呈碱性的原因为___________ 。
4.CO2的电子式为___________ ,其分子极性为___________ ;电负性C___________ Si(填“>”“=”或者“<”)。
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是___________ 。
a.代谢产生的H+被 结合形成H2CO3
结合形成H2CO3
b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为
4.CO2的电子式为
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是
a.代谢产生的H+被
 结合形成H2CO3
结合形成H2CO3b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
您最近一年使用:0次
4 . 已知25℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为物质
(1)碳酸一级电离的平衡常数表达式为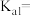
_______ 。
(2)下列四种离子结合 能力最强的是_______。
能力最强的是_______。
(3)酸性强弱:醋酸_______ 次氯酸(填“>”或“<”,下同);经测定,常温下0.1 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,_______ (填“能”或“不能”)说明两者的酸性强弱关系。
(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
(5) 和
和 的混合溶液中,
的混合溶液中,
_______ (用微粒符号表示)。
(6)25℃时,pH=1的硫酸与0.02
 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为_______ 。
| 物质 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 |  |  | 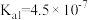 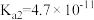 | 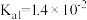 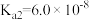 |
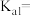
(2)下列四种离子结合
 能力最强的是_______。
能力最强的是_______。A. | B. | C. | D. |
 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
A. | B. | C.醋酸的电离平衡常数 | D.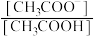 |
 和
和 的混合溶液中,
的混合溶液中,
(6)25℃时,pH=1的硫酸与0.02

 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为
您最近一年使用:0次
5 . 按要求填空
(1)NaHCO3的水溶液呈___________ (填“酸”、“中”、“碱”)性,实验室保存NaHCO3溶液的试剂瓶应用___________ 塞,原因___________ (写出有关的离子方程式,下同);Al2(SO4)3显酸性,溶液蒸干最后得到的固体产物是___________ 。
(2)常温下,下列溶液中,c(H+)由小到大的排列顺序是___________ 。
①0.1mol/LHCl溶液 ②0.1mol/LH2SO4溶液 ③0.1mol/LNaOH溶液 ④0.1mol/LCH3COOH溶液。
(3)25℃时,有 的盐酸和
的盐酸和 的
的 溶液中由水电离出的c(H+)之比为
溶液中由水电离出的c(H+)之比为___________ 。
(4)已知: :
: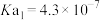 ;
; ,
, :
: 。
。
①相同条件下,试比较 、
、 、
、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为___________ 。
②则将 气体通入足量的
气体通入足量的 溶液中的离子反应方程式为
溶液中的离子反应方程式为___________ 。
(1)NaHCO3的水溶液呈
(2)常温下,下列溶液中,c(H+)由小到大的排列顺序是
①0.1mol/LHCl溶液 ②0.1mol/LH2SO4溶液 ③0.1mol/LNaOH溶液 ④0.1mol/LCH3COOH溶液。
(3)25℃时,有
 的盐酸和
的盐酸和 的
的 溶液中由水电离出的c(H+)之比为
溶液中由水电离出的c(H+)之比为(4)已知:
 :
: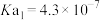 ;
; ,
, :
: 。
。①相同条件下,试比较
 、
、 、
、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为②则将
 气体通入足量的
气体通入足量的 溶液中的离子反应方程式为
溶液中的离子反应方程式为
您最近一年使用:0次
名校
解题方法
6 . 推动 的综合利用实现碳中和是党中央作出的重大战略决策。
的综合利用实现碳中和是党中央作出的重大战略决策。
Ⅰ. 催化加氢法:以下是
催化加氢法:以下是 催化加氢合成二甲醚发生的两个主要反应:
催化加氢合成二甲醚发生的两个主要反应:
反应Ⅰ:
反应Ⅱ:
(1)反应
___________ 。
(2)在恒压、 和
和 起始量一定的条件下,
起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中: 的选择性
的选择性
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是___________ 。
②220℃时,在催化剂作用下 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为:
的选择性为: (图中
(图中 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高 选择性的措施有:
选择性的措施有:___________ 。(答1点即可)
Ⅱ. 催化加氢法:高炉气中捕集
催化加氢法:高炉气中捕集 制
制 的综合利用示意图如图所示。
的综合利用示意图如图所示。 。
。
(3)T℃时,当吸收池中溶液的 时,此时该溶液中
时,此时该溶液中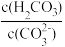 =
=___________ 。
(4)电解池中 电催化还原为
电催化还原为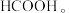
① 在铂电极反应方程式为
在铂电极反应方程式为___________ 。
②铂电极上的副反应除析氢外,没有其它放电过程。若生成 的电解效率
的电解效率 ,当电路中转移
,当电路中转移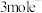 时,阴极室溶液的质量增加
时,阴极室溶液的质量增加___________  。定义:
。定义: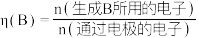
 的综合利用实现碳中和是党中央作出的重大战略决策。
的综合利用实现碳中和是党中央作出的重大战略决策。Ⅰ.
 催化加氢法:以下是
催化加氢法:以下是 催化加氢合成二甲醚发生的两个主要反应:
催化加氢合成二甲醚发生的两个主要反应:反应Ⅰ:

反应Ⅱ:

(1)反应

(2)在恒压、
 和
和 起始量一定的条件下,
起始量一定的条件下, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图。其中:
的选择性随温度的变化如图。其中: 的选择性
的选择性
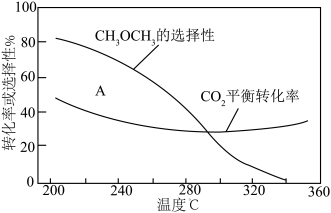
 平衡转化率随温度升高而上升的原因是
平衡转化率随温度升高而上升的原因是②220℃时,在催化剂作用下
 与
与 反应一段时间后,测得
反应一段时间后,测得 的选择性为:
的选择性为: (图中
(图中 点)。不改变反应时间和温度,一定能提高
点)。不改变反应时间和温度,一定能提高 选择性的措施有:
选择性的措施有:Ⅱ.
 催化加氢法:高炉气中捕集
催化加氢法:高炉气中捕集 制
制 的综合利用示意图如图所示。
的综合利用示意图如图所示。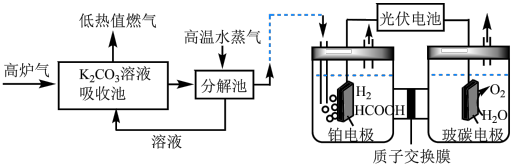
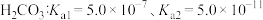 。
。(3)T℃时,当吸收池中溶液的
 时,此时该溶液中
时,此时该溶液中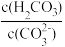 =
=(4)电解池中
 电催化还原为
电催化还原为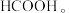
①
 在铂电极反应方程式为
在铂电极反应方程式为②铂电极上的副反应除析氢外,没有其它放电过程。若生成
 的电解效率
的电解效率 ,当电路中转移
,当电路中转移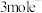 时,阴极室溶液的质量增加
时,阴极室溶液的质量增加 。定义:
。定义: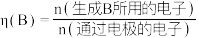
您最近一年使用:0次
7 . 联氨(N2H4)又称“肼”,具高吸湿性、沸点386.5K、毒性强、还原性强等特性,燃烧释放出大量的热,常用于做火箭的燃料以及分析试剂中的还原剂。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式___________ ;此反应中,被氧化的元素是_____ 。每生成1mol肼,转移的电子数为________ 。
Ⅱ .联氨的结构
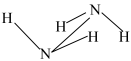
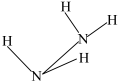
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是________ 。
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是_____ 。
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是_____ 。
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是_____ (填写化学式)。实验发现0.1mol·L-1N2H6SO4溶液显酸性,原因是_____ (用离子方程式表示),溶液中各种含氮微粒存在关系c(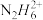 )+c(N2H6OH+)
)+c(N2H6OH+)____ 0.1-c(N2H4·2H2O)(选填“>”,“<”或“=”)。
(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是_______ 。肼有剧毒,但目前仍被普遍用作火箭的燃料,原因是________ 。
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
室温下,则同浓度的HNO2和HN3,其pH值:HNO2____ HN3(选填“>”、“<”或“=”),  反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为_________ 。
(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
并已知1molN2H4(l)→N2H4(g)与2molH2O2(l)→H2O2(g)共吸热23.76kJ,据此估算化学反应N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)的焓变ΔH=_______ kJ·mol-1,反应的熵变ΔS _____ 0(选填“>”、“<”)。研究小组利用此反应设计出如下电池,负极电极反应式:N2H4+4OH-−4e-=N2+4H2O。则正极电极反应式:________ 。
I.联氨的制备
(1)联氨可用次氯酸钠溶液氧化过量的氨气制得,写出此反应得离子方程式
Ⅱ .联氨的结构
(2)联氨具强极性,推测下列结构最接近联氨分子真实结构的是
|
|
| A. 反式结构 | B. 顺式结构 |
Ⅲ .联氨的性质
(3)①一定条件下, 联氨与二氯化钴(CoCl2)溶液能形成配位化合物Co(N2H4)6Cl2,关于此配位化合物的下列说法中不正确的是
A.中心离子是Co2+ B.配位数是8
C.配位原子是N原子 D.向此配合物的溶液中滴入硝酸银,会产生白色沉淀
②联氨具高吸湿性,原因是
③联氨水溶液与氨水类性质相似,将联氨溶于一定浓度的稀硫酸中,除形成N2H6SO4外,还可以生成的盐是
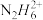 )+c(N2H6OH+)
)+c(N2H6OH+)(4)1mol液态联氨在空气中完全燃烧生成氮气和水蒸气放出621.74KJ的热量,此反应的热化学方程式是
(5)联氨在一定条件下被亚硝酸氧化为叠氮酸(HN3),室温下亚硝酸、叠氮酸的电离平衡常数如表所示:
| 酸名 | 亚硝酸(HNO2) | 叠氮酸(HN3) |
| 电离平衡常数 | 5.1 x 10-4 | 1.8 x 10-5 |
 反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为
反应性能类似卤素离子,则难溶物AgN3的Ksp表达式为(6)某研究小组研究联氨和双氧水反应,查阅相关键能数据
| 化学键 | N-H | O-H | O-O | N-N | N≡N |
| 键能(kJ·mol-1) | 391 | 467 | 138 | 159 | 945 |
您最近一年使用:0次
名校
8 . Ⅰ.盐类水解知识。
(1)氯化铁水溶液呈___________ 性,原因是用离子方程式表示:___________ ;把 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是___________ ;普通泡沫灭火器是利用溶液跟溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是:_________ 。
Ⅱ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(2)物质的量浓度均为0.1 的四种溶液:pH由小到大排列的顺序是
的四种溶液:pH由小到大排列的顺序是___________ (用编号填写)
a. b.
b. c.NaClO d.
c.NaClO d.
(3)常温下,0.1
 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是________
A. B.
B. C.
C.
D. E.
E.
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(5)25℃时,将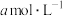 的醋酸与
的醋酸与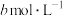 氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为___________ 。
(1)氯化铁水溶液呈
 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是Ⅱ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 |  |  | HClO |
| 电离平衡常数 |  |   |  |
 的四种溶液:pH由小到大排列的顺序是
的四种溶液:pH由小到大排列的顺序是a.
 b.
b. c.NaClO d.
c.NaClO d.
(3)常温下,0.1

 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是A.
 B.
B. C.
C.
D.
 E.
E.
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(5)25℃时,将
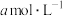 的醋酸与
的醋酸与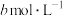 氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
您最近一年使用:0次
2023-11-11更新
|
222次组卷
|
2卷引用:广西玉林市2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
9 . 了解电解质在水溶液中的存在形式及其行为,有助于从微观角度认识水溶液中离子反应的本质和规律,有助于感悟电解质溶液中各微粒间相互依存,相互制约的辩证关系。
Ⅰ. 是实验室常见的电解质,根据要求回答下列问题:
是实验室常见的电解质,根据要求回答下列问题:
(1)下列物质中,与醋酸同属弱电解质的是_______
(2)下列能说明醋酸溶液一定呈酸性的是_______
(3)25℃时,1mol/L醋酸加水稀释至0.01mol/L,下列说法正确的是_______
(4)盐酸与过量铁粉的反应,若有适量 介入,则有_______
介入,则有_______
Ⅱ.将一定浓度的醋酸稀释10倍并配成 溶液,取
溶液,取 稀释后的溶液,用
稀释后的溶液,用 标准溶液滴定。
标准溶液滴定。
(5)实验中需要的定量仪器除了移液管,还需要___________ 。实验选用___________ (填“酚酞”或“甲基橙”)做指示剂,当___________ 时,说明滴定至终点。如图所示滴定管的读数为___________ mL。

(6)下列相关操作会造成所测定醋酸的浓度偏高的有___________。
(7)根据表计算稀释前的醋酸溶液的物质的量浓度为___________ 。(保留2位小数)
Ⅲ.将等体积的 溶液和
溶液和 溶液分别加水稀释,
溶液分别加水稀释, 随加水稀释倍数的变化如图所示。
随加水稀释倍数的变化如图所示。

(8)比较电离平衡常数: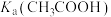
___________ 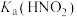 。(填“>、<或=”下同)
。(填“>、<或=”下同)
(9)a点由水电离的
___________  ,比较a、b、c三点水的电离程度大小顺序为
,比较a、b、c三点水的电离程度大小顺序为___________ ,c、d两点时的溶液分别与 恰好中和,溶液中
恰好中和,溶液中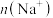 :d点
:d点___________ c点。
(10)已知:25℃时 和
和 (亚磷酸)的电离平衡常数:
(亚磷酸)的电离平衡常数:
① 与足量
与足量 反应的化学方程式
反应的化学方程式___________ 。
②书写 溶液中加入足量醋酸的离子方程式:
溶液中加入足量醋酸的离子方程式:___________ 。
Ⅰ.
 是实验室常见的电解质,根据要求回答下列问题:
是实验室常见的电解质,根据要求回答下列问题:(1)下列物质中,与醋酸同属弱电解质的是_______
| A.氯化氢 | B.醋酸铵 | C.一水合氨 | D.二氧化碳 |
A.含 的溶液 的溶液 | B.能使酚酞呈无色的溶液 |
C. 的溶液 的溶液 | D. |
A.溶液中 的值增大 的值增大 | B. 增大2个单位 增大2个单位 |
C.溶液中 减小 减小 | D. 减小 减小 |
 介入,则有_______
介入,则有_______| A.反应速率减缓 | B.产生氢气的总量不变 |
C.溶液的 减小 减小 | D.溶液中 减小 减小 |
Ⅱ.将一定浓度的醋酸稀释10倍并配成
 溶液,取
溶液,取 稀释后的溶液,用
稀释后的溶液,用 标准溶液滴定。
标准溶液滴定。(5)实验中需要的定量仪器除了移液管,还需要

(6)下列相关操作会造成所测定醋酸的浓度偏高的有___________。
| A.用待测液洗锥形瓶 | B.没有用标准液润洗碱式滴定管 |
| C.滴定结束时,俯视刻度读数 | D.滴定开始时锥形瓶中有水 |
| 实验次数 | ||||
 | 19.82 | 19.80 | 22.00 | 19.78 |
Ⅲ.将等体积的
 溶液和
溶液和 溶液分别加水稀释,
溶液分别加水稀释, 随加水稀释倍数的变化如图所示。
随加水稀释倍数的变化如图所示。
(8)比较电离平衡常数:
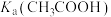
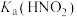 。(填“>、<或=”下同)
。(填“>、<或=”下同)(9)a点由水电离的

 ,比较a、b、c三点水的电离程度大小顺序为
,比较a、b、c三点水的电离程度大小顺序为 恰好中和,溶液中
恰好中和,溶液中 :d点
:d点(10)已知:25℃时
 和
和 (亚磷酸)的电离平衡常数:
(亚磷酸)的电离平衡常数:| 化学式 |  |  (亚磷酸) (亚磷酸) |
电离平衡常数 |  |  , , |
①
 与足量
与足量 反应的化学方程式
反应的化学方程式②书写
 溶液中加入足量醋酸的离子方程式:
溶液中加入足量醋酸的离子方程式:
您最近一年使用:0次
名校
解题方法
10 . 含铬化合物在生产生活中有着广泛的用途。利用含铬废液(主要含 、
、 、
、 、
、 等)可制备强氧化剂
等)可制备强氧化剂 。
。

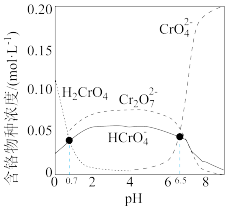
已知:室温下 总浓度为
总浓度为 溶液中,含铬物种浓度随
溶液中,含铬物种浓度随 的分布如图所示。
的分布如图所示。
(1)写出含铬废液中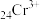 的电子排布式
的电子排布式_______ 。
(2)混合时温度为什么不宜过高_______ 。
(3)写出调节 约为12时
约为12时 氧化为
氧化为 的离子方程式
的离子方程式_______ 。
(4)利用 制备
制备 ,向密闭反应釜中加入
,向密闭反应釜中加入

 溶液,再加入蔗糖
溶液,再加入蔗糖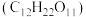 充分反应生成
充分反应生成 、
、 和
和 。熔烧
。熔烧 得到
得到 ,理论上需要向反应釜中加入蔗糖的物质的量为
,理论上需要向反应釜中加入蔗糖的物质的量为_______ mol。
(5)纳米零价铁可将水体中 还原为
还原为 ,再将
,再将 转化为
转化为 (两性氢氧化物)从水体中除去。
(两性氢氧化物)从水体中除去。
① 的
的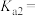
_______ 。
②调节溶液 ,可使
,可使 转化为
转化为 沉淀而被除去。当
沉淀而被除去。当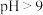 时,铬的去除率却降低,其原因是
时,铬的去除率却降低,其原因是_______ 。
 、
、 、
、 、
、 等)可制备强氧化剂
等)可制备强氧化剂 。
。
已知:室温下
 总浓度为
总浓度为 溶液中,含铬物种浓度随
溶液中,含铬物种浓度随 的分布如图所示。
的分布如图所示。
(1)写出含铬废液中
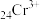 的电子排布式
的电子排布式(2)混合时温度为什么不宜过高
(3)写出调节
 约为12时
约为12时 氧化为
氧化为 的离子方程式
的离子方程式(4)利用
 制备
制备 ,向密闭反应釜中加入
,向密闭反应釜中加入

 溶液,再加入蔗糖
溶液,再加入蔗糖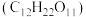 充分反应生成
充分反应生成 、
、 和
和 。熔烧
。熔烧 得到
得到 ,理论上需要向反应釜中加入蔗糖的物质的量为
,理论上需要向反应釜中加入蔗糖的物质的量为(5)纳米零价铁可将水体中
 还原为
还原为 ,再将
,再将 转化为
转化为 (两性氢氧化物)从水体中除去。
(两性氢氧化物)从水体中除去。①
 的
的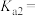
②调节溶液
 ,可使
,可使 转化为
转化为 沉淀而被除去。当
沉淀而被除去。当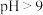 时,铬的去除率却降低,其原因是
时,铬的去除率却降低,其原因是
您最近一年使用:0次