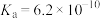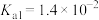名校
1 . 下列实验操作及现象与对应结论匹配的是
| 选项 | 实验操作及现象 | 结论 |
| A | 将 固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 固体粉末加入过量NaOH溶液中,充分搅拌,溶解得到无色溶液 |  既体现碱性又体现酸性 既体现碱性又体现酸性 |
| B | 向硫酸铜溶液中滴加氨水至过量,溶液由蓝色变为深蓝色 |  转化为 转化为 |
| C | 相同温度下,分别测定NaNO2和CH3COONa溶液的pH,NaNO2溶液的pH约为8,CH3COONa溶液的pH约为9 | 相同温度下,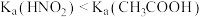 |
| D | 向5mL0.1mol/LNaOH稀溶液中滴加5滴0.1mol/L的MgCl2溶液,出现白色沉淀,再滴加5滴0.1mol/L的CuSO4溶液,出现蓝色沉淀 | 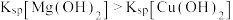 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 常温下,下列各组离子一定能大量共存的是
A.0.1mol/L的AlCl3溶液中:K+、Na+、 、 、 |
B.使甲基橙变红的溶液中:Ba2+、 、 、 、Fe2+ 、Fe2+ |
| C.0.1mol/L的NH3·H2O溶液中:Ba2+、K+、Cl-、I- |
D.由水电离出的 的溶液中:Na+、 的溶液中:Na+、 、 、 、 、 |
您最近一年使用:0次
名校
3 . I.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)CO 的空间结构是
的空间结构是_______ 。
(2) 溶液呈
溶液呈_______ (填“酸性”“碱性”或“中性”)。
(3)物质的量浓度均为0.1mol·L−1的下列四种溶液:pH由小到大 排列的顺序是_______ 。(填序号)
①CH3COONa②Na2CO3③NaClO④NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_______ 。
II.为实现“双碳”目标,用二氧化碳制备甲醇可实现二氧化碳资源化利用、降低碳排放。回答下列问题:
已知:反应1:

反应2:
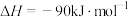
(5)则反应3: 催化加氢制取
催化加氢制取 的热化学方程式为
的热化学方程式为_______ 。
(6)反应2的反应历程如下图所示,其中吸附在催化剂表面的物种用*标注。_______ 。
III.为了探究电解池的工作原理,某研究性学习小组用下图所示的装置进行实验。实验时该小组同学发现两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根( )在溶液中呈紫红色。
)在溶液中呈紫红色。
(7)电解过程中,Y极发生的电极反应为_______ 、_______ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.810−5 | Kal=4.310−7、Ka2=5.610−11 | Ka=3.010−8 |
 的空间结构是
的空间结构是(2)
 溶液呈
溶液呈(3)物质的量浓度均为0.1mol·L−1的下列四种溶液:pH
①CH3COONa②Na2CO3③NaClO④NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
II.为实现“双碳”目标,用二氧化碳制备甲醇可实现二氧化碳资源化利用、降低碳排放。回答下列问题:
已知:反应1:


反应2:

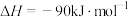
(5)则反应3:
 催化加氢制取
催化加氢制取 的热化学方程式为
的热化学方程式为(6)反应2的反应历程如下图所示,其中吸附在催化剂表面的物种用*标注。
III.为了探究电解池的工作原理,某研究性学习小组用下图所示的装置进行实验。实验时该小组同学发现两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(
 )在溶液中呈紫红色。
)在溶液中呈紫红色。
(7)电解过程中,Y极发生的电极反应为
您最近一年使用:0次
4 . 已知25℃时,部分物质的电离常数如下表所示。
(1)根据表中数据,将 的下列三种酸溶液分别稀释100倍,pH变化最小的是
的下列三种酸溶液分别稀释100倍,pH变化最小的是________ 。
a. b.HCN C.
b.HCN C.
(2)常温下,0.1mol/L的 溶液和0.1mol/LHCOONa溶液相比.
溶液和0.1mol/LHCOONa溶液相比.

________ 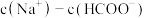 (填“<”“<”=或“>”)。
(填“<”“<”=或“>”)。
(3)下列说法正确的是________。
(4)已知常温下0.1mol/L的 和
和 的pH分别为8.9和8.3,而水解常数
的pH分别为8.9和8.3,而水解常数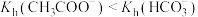 ,则
,则 溶液pH更小的原因是
溶液pH更小的原因是________ 。
HCOOH |
| HCN |
|
|
|
|
|
|
|
 的下列三种酸溶液分别稀释100倍,pH变化最小的是
的下列三种酸溶液分别稀释100倍,pH变化最小的是a.
 b.HCN C.
b.HCN C.
(2)常温下,0.1mol/L的
 溶液和0.1mol/LHCOONa溶液相比.
溶液和0.1mol/LHCOONa溶液相比.
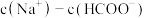 (填“<”“<”=或“>”)。
(填“<”“<”=或“>”)。(3)下列说法正确的是________。
A. 溶液中加入少量水,则溶液中 溶液中加入少量水,则溶液中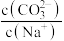 将减小 将减小 |
B.等物质的量浓度的 与 与 混合液中, 混合液中, |
C.向KCN溶液中通入少量 气体发生反应的离子方程式为: 气体发生反应的离子方程式为: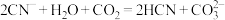 |
D.常温下,将 通入NaOH溶液中,当 通入NaOH溶液中,当 降至 降至 时,溶液中的 时,溶液中的 |
 和
和 的pH分别为8.9和8.3,而水解常数
的pH分别为8.9和8.3,而水解常数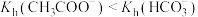 ,则
,则 溶液pH更小的原因是
溶液pH更小的原因是
您最近一年使用:0次
5 . 某化学小组同学对FeCl3溶液与Na2SO3溶液的反应进行探究
(1)请用离子方程式表示Na2SO3溶液显碱性的原因___________ 。
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为___________ ,取反应后的溶液中加入K3[Fe(CN)6]溶液,观察到___________ (填现象),证实了此结论。
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因___________ 。
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入___________ ,观察到___________ (填实验现象),证实此浓度下的FeCl3溶液与Na2SO3溶液可以发生氧化还原反应。 可形成难电离的红色配合物:
可形成难电离的红色配合物: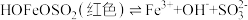 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因___________ 。
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受___________ 因素影响(至少写出两项)。
| 实验操作 | 现象 | |
| ① |
| 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,溶液变为淡黄色,始终无沉淀生成。 |
② |
| 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,生成红褐色沉淀,上层清液为无色。 |
(1)请用离子方程式表示Na2SO3溶液显碱性的原因
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入
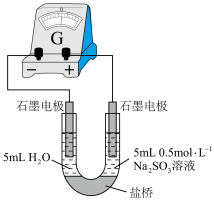
 可形成难电离的红色配合物:
可形成难电离的红色配合物: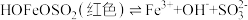 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受
您最近一年使用:0次
名校
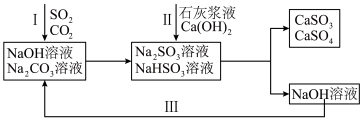
6 . 双碱法是一种用于燃煤尾气脱硫的工艺,其具有脱硫效率高、成本低等优点,以下是一种脱硫工艺简要流程。 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。
1.等浓度的 和
和 溶液,
溶液,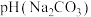
___________ 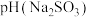 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:___________ 。
2.过程I中, 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数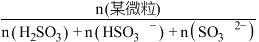 与pH的关系如图所示。
与pH的关系如图所示。___________ 。
②等浓度 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是___________ 。
A.
B.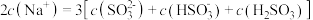
C.
D.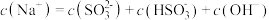
3.生成的 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:___________ 。
4.工业上也可以用氨水吸收尾气中的 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。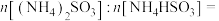
___________ 。
 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。 |  |
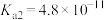 | |
 |  |
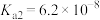 |
1.等浓度的
 和
和 溶液,
溶液,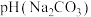
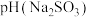 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:2.过程I中,
 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数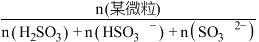 与pH的关系如图所示。
与pH的关系如图所示。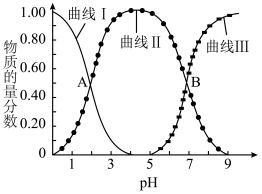
②等浓度
 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是A.

B.
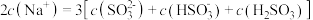
C.

D.
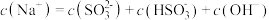
3.生成的
 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:4.工业上也可以用氨水吸收尾气中的
 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。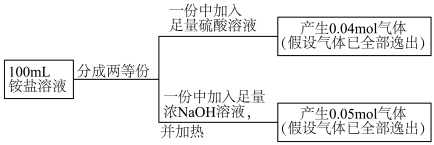
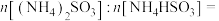
您最近一年使用:0次
名校
7 . 锑(Sb)可用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、MgO、
、MgO、 等)为原料提取锑的工艺如下:
等)为原料提取锑的工艺如下:
回答下列问题:
(1)“溶浸”时氧化产物是S, 被氧化的化学方程式为
被氧化的化学方程式为________ 。
(2)“还原”时加入Sb的目的是将________ 还原,提高产物的纯度。
(3)“水解”时需控制溶液pH=2.5。
① 发生水解的离子方程式为
发生水解的离子方程式为________ 。
②下列能促进该水解反应的措施有________ (填字母)。
A.升高温度 B.增大 C.增大
C.增大 D.加入
D.加入 粉末
粉末
③为避免水解产物中混入 ,
, 浓度应小于
浓度应小于________  (已知
(已知 )。
)。
(4)向“滤液”中通入足量 ,再将滤液pH调至3.5,可析出
,再将滤液pH调至3.5,可析出 沉淀。将沉淀溶于浓盐酸后,产物可返回
沉淀。将沉淀溶于浓盐酸后,产物可返回________ 工序循环使用。
(5)Sb可由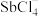 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为________ 。
 ,还含有
,还含有 、
、 、MgO、
、MgO、 等)为原料提取锑的工艺如下:
等)为原料提取锑的工艺如下: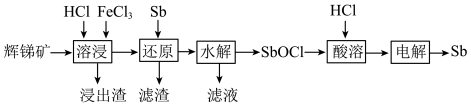
| 金属离子 |
|
|
|
|
开始沉淀时( )的pH )的pH | 2.2 | 3.7 | 7.5 | 9.6 |
完全沉淀时( )的pH )的pH | 3.2 | 4.7 | 9.0 | 11.1 |
(1)“溶浸”时氧化产物是S,
 被氧化的化学方程式为
被氧化的化学方程式为(2)“还原”时加入Sb的目的是将
(3)“水解”时需控制溶液pH=2.5。
①
 发生水解的离子方程式为
发生水解的离子方程式为②下列能促进该水解反应的措施有
A.升高温度 B.增大
 C.增大
C.增大 D.加入
D.加入 粉末
粉末③为避免水解产物中混入
 ,
, 浓度应小于
浓度应小于 (已知
(已知 )。
)。(4)向“滤液”中通入足量
 ,再将滤液pH调至3.5,可析出
,再将滤液pH调至3.5,可析出 沉淀。将沉淀溶于浓盐酸后,产物可返回
沉淀。将沉淀溶于浓盐酸后,产物可返回(5)Sb可由
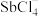 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为
您最近一年使用:0次
名校
解题方法
8 . 室温下,通过下列实验探究某些碳酸盐溶液及碳酸氢盐溶液的性质。
已知: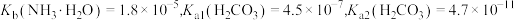 。
。
下列有关说法正确的是
已知:
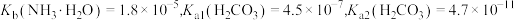 。
。| 实验 | 实验操作和现象 |
| 1 | 测量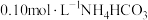 溶液的 溶液的 ,测得 ,测得 为 为 |
| 2 | 测量某浓度的 溶液的 溶液的 ,测得 ,测得 约为9.4 约为9.4 |
| 3 | 将两种浓度均为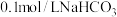 和 和 溶液等体积混合,测量其 溶液等体积混合,测量其 |
A.实验1溶液中: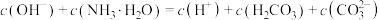 |
B.实验1测得的 值 值 |
C.实验2溶液中: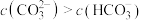 |
D.实验3所得溶液中: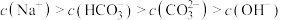 |
您最近一年使用:0次
名校
解题方法
9 . 用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
___________ 。(已知: 时,电离常数
时,电离常数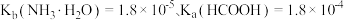 )
)
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数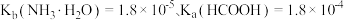 )
)
您最近一年使用:0次
10 . 常温下,已知三种一元弱酸的相对强弱: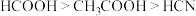 。在浓度均为
。在浓度均为 的
的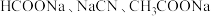 的混合溶液中,通入
的混合溶液中,通入 气体,随着
气体,随着 增大,溶液中的
增大,溶液中的 与
与 (
( 代表三种酸根离子,
代表三种酸根离子, 表示三种弱酸)的分布系数
表示三种弱酸)的分布系数 (平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。下列说法错误的是
(平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。下列说法错误的是
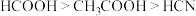 。在浓度均为
。在浓度均为 的
的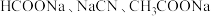 的混合溶液中,通入
的混合溶液中,通入 气体,随着
气体,随着 增大,溶液中的
增大,溶液中的 与
与 (
( 代表三种酸根离子,
代表三种酸根离子, 表示三种弱酸)的分布系数
表示三种弱酸)的分布系数 (平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。下列说法错误的是
(平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。下列说法错误的是
A. 的电离常数 的电离常数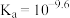 |
B.反应 的平衡常数 的平衡常数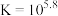 |
C.交点 处的 处的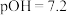 |
D.原混合溶液中: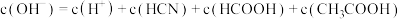 |
您最近一年使用:0次