名校
1 . 完成下列问题
(1)硫酸铝水解的离子方程式是___________ ,为了抑制其水解,配制时可以加入少量的___________ (填化学式)。
(2)饱和NH4Cl溶液加入镁条,则观察到有气泡产生,点燃有爆鸣声,此气体为___________ 产生该气体的原因是___________ (用离子方程式表示),微热后能放出有刺激性气味的气体,该气体是___________ ,产生该气体的原因是___________ 。
(1)硫酸铝水解的离子方程式是
(2)饱和NH4Cl溶液加入镁条,则观察到有气泡产生,点燃有爆鸣声,此气体为
您最近一年使用:0次
名校
2 . 为了配制NH 的浓度与Cl-的浓度之比为1∶1的溶液,可在NH4Cl溶液中加入
的浓度与Cl-的浓度之比为1∶1的溶液,可在NH4Cl溶液中加入
①适量的HCl ②适量的(NH4)2SO4 ③适量的氨水 ④适量的NaOH
 的浓度与Cl-的浓度之比为1∶1的溶液,可在NH4Cl溶液中加入
的浓度与Cl-的浓度之比为1∶1的溶液,可在NH4Cl溶液中加入①适量的HCl ②适量的(NH4)2SO4 ③适量的氨水 ④适量的NaOH
| A.①② | B.②③ | C.③④ | D.①④ |
您最近一年使用:0次
名校
解题方法
3 . 实验小组制备硫代硫酸钠(Na2S2O3)并探究其性质。
资料:ⅰ.S2O +2H+=S↓+SO2↑+H2O
+2H+=S↓+SO2↑+H2O
ⅱ.Fe3++3S2O
 Fe(S2O3)
Fe(S2O3) (紫黑色)
(紫黑色)
ⅲ.Ag2S2O3是难溶于水、可溶于Na2S2O3溶液的白色固体。
(1)实验室可利用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制备Na2S2O3,装置如下图。

①用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:S2-+H2O HS-+OH-、
HS-+OH-、___________ 。
②为了保证Na2S2O3的产量,实验中通入的SO2不能过量。要控制SO2的生成速率,可以采取的措施有:___________ (写出一条)。
(2)探究Na2S2O3溶液与不同金属的硫酸盐溶液间反应的多样性。
①Ⅰ中产生白色沉淀的离子方程式为___________ 。
②经检验,现象Ⅱ中的沉淀有Al(OH)3和S,用平衡移动原理解释Ⅱ中的现象:___________ 。
③经检验,现象中的无色溶液中含有Fe2+。从化学反应速率和限度的角度解释Ⅲ中Fe3+与S2O 反应的实验现象:
反应的实验现象:___________ 。
以上实验说明:Na2S2O3溶液与金属阳离子反应的多样性和阳离子的性质有关。
资料:ⅰ.S2O
 +2H+=S↓+SO2↑+H2O
+2H+=S↓+SO2↑+H2O ⅱ.Fe3++3S2O

 Fe(S2O3)
Fe(S2O3) (紫黑色)
(紫黑色)ⅲ.Ag2S2O3是难溶于水、可溶于Na2S2O3溶液的白色固体。
(1)实验室可利用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制备Na2S2O3,装置如下图。

①用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:S2-+H2O
 HS-+OH-、
HS-+OH-、②为了保证Na2S2O3的产量,实验中通入的SO2不能过量。要控制SO2的生成速率,可以采取的措施有:
(2)探究Na2S2O3溶液与不同金属的硫酸盐溶液间反应的多样性。
| 实验 | 试剂 | 现象 | |
 | 试管 | 滴管 | |
| 2mL0.1mol/LNa2S2O3溶液 | Ag2SO4溶液(浓度约为0.03mol/L) | Ⅰ.局部生成白色沉淀,振荡后沉淀溶解,得到无色溶液 | |
| 0.03mol/LAl2(SO4)3溶液 | Ⅱ.一段时间后,生成沉淀 | ||
| 0.03mol/LFe2(SO4)3溶液 | Ⅲ.混合后溶液先变成紫黑色,30s时溶液几乎变为无色 | ||
②经检验,现象Ⅱ中的沉淀有Al(OH)3和S,用平衡移动原理解释Ⅱ中的现象:
③经检验,现象中的无色溶液中含有Fe2+。从化学反应速率和限度的角度解释Ⅲ中Fe3+与S2O
 反应的实验现象:
反应的实验现象:以上实验说明:Na2S2O3溶液与金属阳离子反应的多样性和阳离子的性质有关。
您最近一年使用:0次
2023-12-27更新
|
51次组卷
|
2卷引用:北京市第八中学2022-2023学年高二上学期期中考试化学试题
名校
4 . 25℃时,在20.0mL0.10mol/L氨水中滴入0.10mol·L-1的盐酸,溶液pH与所加盐酸的体积关系如图所示。下列有关叙述不正确的是


| A.a点对应溶液中已电离的NH3·H2O为10-2.8mol·L-1 |
| B.b点对应盐酸的体积小于20.0mL |
C.b点对应溶液中c(Cl-)=c(NH ) ) |
D.加入10mL盐酸时:c(NH )>c(NH3·H2O) >c(Cl-) )>c(NH3·H2O) >c(Cl-) |
您最近一年使用:0次
2023-12-26更新
|
136次组卷
|
2卷引用:北京市第八中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
5 . Ka、Kw、Kh、Ksp分别表示电离常数、水的离子积常数、水解常数、溶度积常数,下列判断不正确的是
A.室温下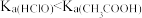 , , 的电离度一定比HClO的大 的电离度一定比HClO的大 |
B.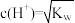 的溶液任何温度下均为中性 的溶液任何温度下均为中性 |
| C.已知25℃时,AgCl和砖红色沉淀Ag2CrO4的Ksp分别为1.8×10-10和2.0×10-12,则用AgNO3标准溶液滴定Cl-时,可采用K2CrO4为指示剂 |
| D.某温度下,一元弱酸HA的Ka越小,则NaA的Kh越大 |
您最近一年使用:0次
2023-12-25更新
|
489次组卷
|
8卷引用:山西省名校联考2022-2023学年高二上学期期末考试化学试题
名校
解题方法
6 . 下列说法不正确的是
A.将NaOH溶液从常温加热至 ,溶液的pH变小但仍保持碱性 ,溶液的pH变小但仍保持碱性 |
| B.常温下,pH=3的醋酸溶液中加醋酸钠固体,醋酸的电离程度和水电离的c(H+)均减小 |
| C.常温下,pH=7的氯化铵和氨水混合液,加少量水稀释后pH不变 |
| D.常温下,向AgCl悬浊液中加入少量稀盐酸,AgCl溶解度减小,Ksp不变,c(Ag+)减小 |
您最近一年使用:0次
名校
解题方法
7 . 常温下,下列有关电解质溶液的说法正确的是
| A.pH= 4的H2S溶液与pH= 10的NaOH溶液等体积混合,所得混合溶液中:c(Na+)+c(H+)=c(OH-)+ 2c(S2-) + c(HS-) |
B.将CH3COONa溶液从20℃升温至30℃,溶液中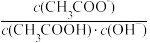 增大 增大 |
C.向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液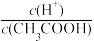 减小 减小 |
| D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)> c(H+)>c(OH-) |
您最近一年使用:0次
名校
8 . 下列说法正确的是
| A.将NH4Cl溶液蒸干制备NH4Cl固体 |
| B.施肥时,草木灰不能与NH4Cl混合施用,是因为K2CO3与NH4Cl反应生成氨气,降低肥效 |
| C.相同条件下,氯化银在水中的溶解能力与在氯化钠溶液中的溶解能力相同 |
| D.易溶性强电解质的稀溶液中不存在分子 |
您最近一年使用:0次
9 . 根据表中数据(常温下),完成下列填空。
(1)常温下,NaCN溶液呈___________ (填“酸”、“碱”或“中”)性,其原因是___________ (用离子方程式表示)。
(2)下列反应不能发生的是___________ (填序号)。
a.CO +2CH3COOH=2CH3COO﹣+CO2↑+H2O
+2CH3COOH=2CH3COO﹣+CO2↑+H2O
b.ClO﹣+CH3COOH=CH3COO﹣+HClO
c.CO +2HClO=2ClO﹣+CO2↑+H2O
+2HClO=2ClO﹣+CO2↑+H2O
d.2ClO﹣+CO2+H2O=CO +2HClO
+2HClO
(3)常温下,浓度均为0.1mol•L﹣1下列4种溶液:①CH3COONa溶液,②NaCN溶液,③NaHCO3溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是___________ (填序号)。
(4)①试计算Na2CO3溶液中CO 的水解常数Kh为
的水解常数Kh为___________ ;
②若加水稀释NaHCO3溶液时,其水解程度___________ ,溶液的pH___________ (填“增大”或“减小”);
(5)若室温时,0.1mol/L的HA在水中有0.1%发生电离,则该溶液的pH为___________ ,此酸的电离平衡常数约为___________ 。
| 物质 | CH3COOH | NH3•H2O | HCN | HClO | H2CO3 | H2SO3 |
| 电离常数(Ka) | 1.7×10﹣5 | 1.7×10﹣5 | 4.9×10﹣10 | 3×10﹣8 | Ka1=4.3×10﹣7 Ka2=4.7×10﹣11 | Ka1=1.5×10﹣2 Ka2=1.0×10﹣7 |
(2)下列反应不能发生的是
a.CO
 +2CH3COOH=2CH3COO﹣+CO2↑+H2O
+2CH3COOH=2CH3COO﹣+CO2↑+H2Ob.ClO﹣+CH3COOH=CH3COO﹣+HClO
c.CO
 +2HClO=2ClO﹣+CO2↑+H2O
+2HClO=2ClO﹣+CO2↑+H2Od.2ClO﹣+CO2+H2O=CO
 +2HClO
+2HClO(3)常温下,浓度均为0.1mol•L﹣1下列4种溶液:①CH3COONa溶液,②NaCN溶液,③NaHCO3溶液,④NaClO溶液;这4种溶液pH由大到小的顺序是
(4)①试计算Na2CO3溶液中CO
 的水解常数Kh为
的水解常数Kh为②若加水稀释NaHCO3溶液时,其水解程度
(5)若室温时,0.1mol/L的HA在水中有0.1%发生电离,则该溶液的pH为
您最近一年使用:0次
名校
解题方法
10 . 平衡——可逆反应的宿命,可逆反应永恒的话题。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在一定温度时发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0,4s后达到平衡状态。
CO2(g)+H2(g) △H<0,4s后达到平衡状态。
①CO和H2O的物质的量变化如下图所示,则在0~4s时正反应的平均反应速率v(CO2)=________ mol·L-1·min-1

②图中6s处改变的条件可能是________ (填字母代号)
A.只充入水蒸气 B.只降低温度 C.只使用催化剂
D.只充入惰性气体 E.缩小体积 F.只充入CO2
(2)明矾可以净水,用离子方程式表示明矾净水的原理:___________ ;写出Na2CO3溶液的质子守恒:___________ 。
(3)25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显___________ (填“酸”“碱”或“中”)性;用含a和b的代数式表示NH3·H2O的电离平衡常数Kb=___________ 。
(4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀[即当c(Fe3+)≤10-5mol·L-1时认为沉淀完全]而Mg2+不沉淀,应该调节溶液pH的范围是___________ (已知lg2=0.3)。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在一定温度时发生反应CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0,4s后达到平衡状态。
CO2(g)+H2(g) △H<0,4s后达到平衡状态。①CO和H2O的物质的量变化如下图所示,则在0~4s时正反应的平均反应速率v(CO2)=

②图中6s处改变的条件可能是
A.只充入水蒸气 B.只降低温度 C.只使用催化剂
D.只充入惰性气体 E.缩小体积 F.只充入CO2
(2)明矾可以净水,用离子方程式表示明矾净水的原理:
(3)25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显
(4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀[即当c(Fe3+)≤10-5mol·L-1时认为沉淀完全]而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次



