名校
解题方法
1 . 如图所示是原电池的装置图。请回答:

(1)若C为NaCl溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___________ ;反应进行一段时间后,向两电极附近溶液滴加酚酞试剂,___________ (填“A”或“B”)电极周围溶液显红色。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___________ ,B(负极)极材料为___________ ,溶液C为___________ 。
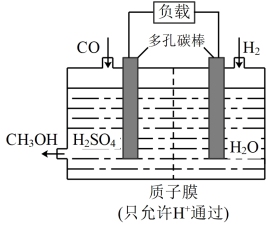
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是___________ (填“正极”或“负极”),c电极的反应方程式为___________ 。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为___________ L。

(1)若C为NaCl溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是
您最近一年使用:0次
解题方法
2 . 请回答下列问题:
(1)把A、B、C、D四种金属按表中装置进行实验。
根据表中信息判断四种金属活动性由大到小的顺序是_______ ;写出装置乙中正极的电极反应式:_______ 。
(2)锂离子电池已经成为新一代实用的蓄电池,它具有能量密度大、电压高的特性。某锂离子电池放电时电极反应如下:
负极Li-e-=Li+,
正极Li1-xMnO2+xLi++xe-=LiMnO2
该锂离子电池放电时电池的反应方程式为_______ 。
(3)H2还原CO电化学法制备甲醇(CO+2H2=CH3OH)的工作原理如下图所示:
通入H2的一端是电池的_______ 极(填“正”或“负”),电池工作过程中H+通过质子膜向_______ (填“左”或者“右”)移动,通入CO的一端发生的电极反应式为_______ 。
(1)把A、B、C、D四种金属按表中装置进行实验。
| 装置 | 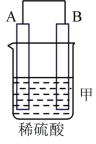 | 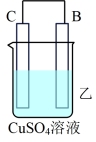 | 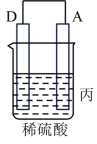 |
| 电子从A到B | C电极的质量增加 | 二价金属D不断溶解 |
(2)锂离子电池已经成为新一代实用的蓄电池,它具有能量密度大、电压高的特性。某锂离子电池放电时电极反应如下:
负极Li-e-=Li+,
正极Li1-xMnO2+xLi++xe-=LiMnO2
该锂离子电池放电时电池的反应方程式为
(3)H2还原CO电化学法制备甲醇(CO+2H2=CH3OH)的工作原理如下图所示:

通入H2的一端是电池的
您最近一年使用:0次
名校
解题方法
3 . X、Y、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,在周期表的短周期主族元素中,X的原子半径最小,X与R的最外层电子数相等;Y的内层电子数是最外层电子数的一半;U的最高化合价和最低化合价的代数和为6;Z和Q形成原子个数之比为1:2的气态化合物的颜色是红棕色;R和Q可形成原子个数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应。
请回答下列问题:
(1)T元素在周期表中的位置是_______ 。
(2)X、Y、Q三种元素的原子半径由小到大的顺序为_______ (填元素符号)。
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为_______ 。
(4)下列可以判断R和T的金属性强弱的是
(5)某同学用X、R两元素的单质反应生成固体物质RX,RX属于离子化合物,且能与化合物X2Q反应生成的单质。
①RX的电子式为_______ ;RX与X2Q反应的化学方程式为_______ 。
②该用电子式表示RX的形成过程:_______ 。
(6)R2Q2的化学式是_______ ,所含有的化学键类型为_______ ,它与水反应的离子方程式为_______ 。
(7)Z元素对应的最高价氧化物对应的水化物的化学式是_______ ,X与Z元素形成的化合物Z2X4的电子式是_______ ,化合物类型是_______ 。(填“离子化合物”或“共价化合物”)
(8)纳米级Cu2O由于具有优良的催化性能而受到关注,采用Z2X4燃料电池作为制备电源,其装置如图,燃料电池中,A电极是_______ (填“正”或“负”)极,A极发生的电极反应为_______ 。

请回答下列问题:
(1)T元素在周期表中的位置是
(2)X、Y、Q三种元素的原子半径由小到大的顺序为
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为
(4)下列可以判断R和T的金属性强弱的是
| A.单质的熔点:R比T低 |
| B.单质与酸反应时,失电子数:R比T少 |
| C.单质与水反应:R比T剧烈 |
| D.最高价氧化物对应水化物的碱性:R比T强 |
①RX的电子式为
②该用电子式表示RX的形成过程:
(6)R2Q2的化学式是
(7)Z元素对应的最高价氧化物对应的水化物的化学式是
(8)纳米级Cu2O由于具有优良的催化性能而受到关注,采用Z2X4燃料电池作为制备电源,其装置如图,燃料电池中,A电极是

您最近一年使用:0次
名校
解题方法
4 . 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积变化,下列说法正确的是
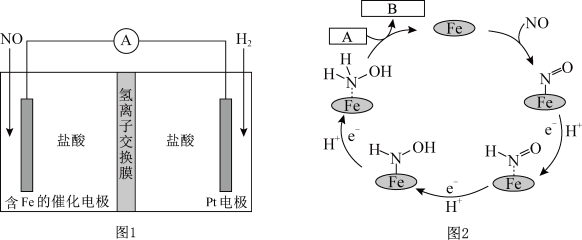

| A.电池工作时,Pt电极是正极 |
| B.图2中,A为H+和e-,B为NH3OH+ |
| C.电池工作时,每消耗2.24LNO(标准状况下),左室溶液质量增加3.3g |
| D.电池工作一段时间后,正、负极区溶液的pH均下降 |
您最近一年使用:0次
2022-04-20更新
|
2127次组卷
|
14卷引用:福建省福州市2022届高中毕业班(3月)第二次质量检测化学试题
福建省福州市2022届高中毕业班(3月)第二次质量检测化学试题湖南省大联考雅礼十六校2021-2022学年高三第二次联考化学试题(已下线)秘籍12 原电池原理及应用-备战2022年高考化学抢分秘籍(全国通用)河北省石家庄市第二中学2022届高三下学期5月模拟考试化学试题江苏省南京市第十三中学2022届高三下学期适应性考试化学试题江苏省南京市雨花台中学2022-2023学年高二上学期10月月考化学试题湖南省郴州市2023届高三下学期第三次教学质量监测化学试题江苏省镇江中学2022-2023学年高一下学期期中考试化学试题湖南省常德市第一中学2022-2023学年高三下学期5月月考化学试题江苏省常州市第一中学2022-2023学年高一下学期期末测试化学试题福建省漳州第一中学2023届高三下学期毕业班质检考化学试题福建省南平第一中学2023-2024学年高三上学期第二次阶段考化学试题江苏省前黄高级中学2023-2024学年高三上学期期中适应性考试化学试题福建省厦门第一中学2023-2024学年高二上学期10月月考试化学试题
解题方法
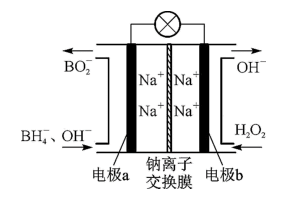
5 . 电化学法处理 是目前研究的热点。利用双氧水氧化吸收
是目前研究的热点。利用双氧水氧化吸收 可消除
可消除 污染,并制备硫酸。设计装置如图所示(已知电极为石墨电极只起导电作用,质子交换膜只允许
污染,并制备硫酸。设计装置如图所示(已知电极为石墨电极只起导电作用,质子交换膜只允许 通过)。下列叙述中错误的是
通过)。下列叙述中错误的是
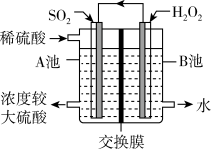
 是目前研究的热点。利用双氧水氧化吸收
是目前研究的热点。利用双氧水氧化吸收 可消除
可消除 污染,并制备硫酸。设计装置如图所示(已知电极为石墨电极只起导电作用,质子交换膜只允许
污染,并制备硫酸。设计装置如图所示(已知电极为石墨电极只起导电作用,质子交换膜只允许 通过)。下列叙述中错误的是
通过)。下列叙述中错误的是
A. 通入的一极为电池负极 通入的一极为电池负极 |
| B.导线上箭头方向表示电流方向 |
C.B池中的反应为 |
D.若 (标准状况) (标准状况)  参与反应,则A池中增加 参与反应,则A池中增加 |
您最近一年使用:0次
20-21高二上·江苏镇江·阶段练习
6 . 污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
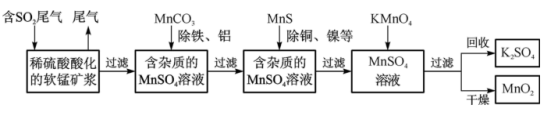
请回答下列问题:
(1)已知:25℃、101 kPa时,
Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是___________ 。请画出该反应的能量变化示意图___________ 。

(2)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示。
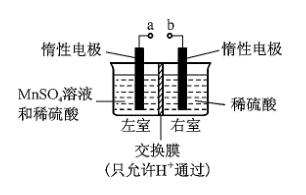
①a应与直流电源的___________ (填“正”或“负”)极相连。
②电解过程中氢离子的作用是___________ ;若转移的电子数为6.02×1023,左室溶液中最终n(H+)的变化量为___________ 。
(3)①MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时正极生成MnOOH,正极的电极反应式是___________ 。
②据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星,其工作原理如下图所示。
则该电池放电时通入H2O2的一极为___________ 极,电极反应式为___________ ;通入NaBH4的一极电极反应式为___________ 。

请回答下列问题:
(1)已知:25℃、101 kPa时,
Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是

(2)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示。

①a应与直流电源的
②电解过程中氢离子的作用是
(3)①MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时正极生成MnOOH,正极的电极反应式是
②据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星,其工作原理如下图所示。

则该电池放电时通入H2O2的一极为
您最近一年使用:0次
2022·河北·模拟预测
7 . 为实现碳回收,我国科学家设计的用电化学法还原CO2制备草酸的装置如图所示。下列有关该装置的说法中错误的是
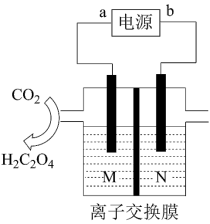

| A.a、b分别为电源的负极、正极 |
B.电解装置左池发生的电极反应为2CO2+2e-=C2O |
| C.为增强溶液导电性,左池中可加入少量Na2C2O4溶液 |
| D.右池电解质溶液为稀硫酸,发生的电极反应为2H2O-4e-=O2↑+4H+ |
您最近一年使用:0次
8 . 某学习小组设想利用A装置电解制备绿色硝化剂 ,装置如下(c、d为惰性电极)。已知:无水硝酸可在液态
,装置如下(c、d为惰性电极)。已知:无水硝酸可在液态 中发生微弱电离。
中发生微弱电离。
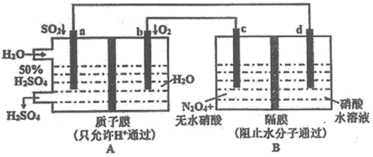
请回答:
(1)a电极名称为_______ 。
(2)写出B装置中生成 的电极反应式
的电极反应式_______ 。
(3) 与水反应生成
与水反应生成 ,
, 作为强氧化剂可氧化大部分金属。3.84g铜粉与100ml一定浓度的硝酸恰好完全反应,收集到2.24L(标准状况下)
作为强氧化剂可氧化大部分金属。3.84g铜粉与100ml一定浓度的硝酸恰好完全反应,收集到2.24L(标准状况下) 与
与 的混合物,则该硝酸物质的量浓度为
的混合物,则该硝酸物质的量浓度为___ 。
 ,装置如下(c、d为惰性电极)。已知:无水硝酸可在液态
,装置如下(c、d为惰性电极)。已知:无水硝酸可在液态 中发生微弱电离。
中发生微弱电离。
请回答:
(1)a电极名称为
(2)写出B装置中生成
 的电极反应式
的电极反应式(3)
 与水反应生成
与水反应生成 ,
, 作为强氧化剂可氧化大部分金属。3.84g铜粉与100ml一定浓度的硝酸恰好完全反应,收集到2.24L(标准状况下)
作为强氧化剂可氧化大部分金属。3.84g铜粉与100ml一定浓度的硝酸恰好完全反应,收集到2.24L(标准状况下) 与
与 的混合物,则该硝酸物质的量浓度为
的混合物,则该硝酸物质的量浓度为
您最近一年使用:0次
解题方法
9 . 2009年6月22日,柯达宣布受到数码相机的影响,决定停止彩色胶卷的生产。一代人的回忆在它74岁的时候,画上了句号。黑白相机的底片上涂有一薄层含AgBr的明胶凝胶,曝光时底片上的AgBr分解成极细的银晶核,哪部分感光越强,哪部分就越黑。该过程称之为“潜影”。
已知:Br2在碱性条件下歧化成Br-和BrO 。
。
回答以下问题:
(1)可以利用气体载体N2、H2、CO2等将溴引向物质制备溴化物(加热及夹持装置省略):

①装置的连接顺序为___ 。(按字母顺序填写)
②当载气中存在氧气等杂质气体时溴化作用减慢,溴化作用减慢的原因是___ 。所以待装置气密性检验完毕后,需___ 。
(2)装置B中盛装NaOH溶液的目的___ (用化学方程式解释)。
(3)请用化学方程式表示铁丝处发生的反应__ 。
(4)该实验装置还有一定的缺陷,请改正:___ 。
(5)α—AgI晶体中的Ag+具有高度的可移动性。根据这个原理,以α—AgI为主要成分的物质作为固体电解质电池可以检测外界气氛中氧气的浓度。
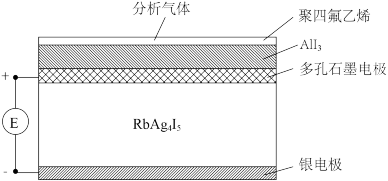
O2透过传感器聚四氟乙烯薄膜,与活性物质AlI3发生氧化还原反应,产物向多孔石墨极片扩散,形成原电池,正极的电极反应式为___ 。
(6)为测定液溴在反应中的转化率,通过沉淀滴定法测量尾气吸收液中的Brˉ浓度(假设通过四段式管子的未反应的Br2全部被吸收液吸收)。先滴加适量的硝酸,再滴加几滴K2CrO4指示剂,然后滴加cmol·L-1的AgNO3溶液至锥形瓶内出现___ ,且30s不变化,停止滴加。此时滴加了VmL。反应共消耗液溴ag,则Br2的转化率是__ 。(已知Ksp[Ag2CrO4红色]=2.0×10-12,Ksp[AgBr]=5.0×10-13,用含a、c、V的式子表示)
已知:Br2在碱性条件下歧化成Br-和BrO
 。
。回答以下问题:
(1)可以利用气体载体N2、H2、CO2等将溴引向物质制备溴化物(加热及夹持装置省略):

①装置的连接顺序为
②当载气中存在氧气等杂质气体时溴化作用减慢,溴化作用减慢的原因是
(2)装置B中盛装NaOH溶液的目的
(3)请用化学方程式表示铁丝处发生的反应
(4)该实验装置还有一定的缺陷,请改正:
(5)α—AgI晶体中的Ag+具有高度的可移动性。根据这个原理,以α—AgI为主要成分的物质作为固体电解质电池可以检测外界气氛中氧气的浓度。

O2透过传感器聚四氟乙烯薄膜,与活性物质AlI3发生氧化还原反应,产物向多孔石墨极片扩散,形成原电池,正极的电极反应式为
(6)为测定液溴在反应中的转化率,通过沉淀滴定法测量尾气吸收液中的Brˉ浓度(假设通过四段式管子的未反应的Br2全部被吸收液吸收)。先滴加适量的硝酸,再滴加几滴K2CrO4指示剂,然后滴加cmol·L-1的AgNO3溶液至锥形瓶内出现
您最近一年使用:0次
10 . 以某锂离子电池、丙烯腈电合成己二腈[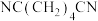 ]的装置如图所示(电极均为石墨)。该锂离子电池的总反应是
]的装置如图所示(电极均为石墨)。该锂离子电池的总反应是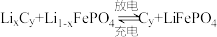 。
。
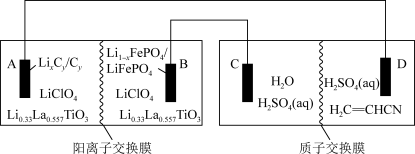
当锂离子电池放电时,回答下列问题:
(1)A极上发生的反应是_______ (填“氧化反应”或“还原反应”),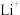 迁移方向是
迁移方向是______ (指明由阳离子交换膜哪一侧迁移到哪一侧)。
(2)B极的电极反应式为_______ 。
(3)C极上产生的气体是_______ (填化学式),D极的电极反应式为_______ 。
(4)稀硫酸的作用是_______ 。
(5)A极质量减轻14g,理论上可制备________ mol己二腈。
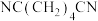 ]的装置如图所示(电极均为石墨)。该锂离子电池的总反应是
]的装置如图所示(电极均为石墨)。该锂离子电池的总反应是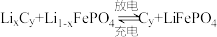 。
。
当锂离子电池放电时,回答下列问题:
(1)A极上发生的反应是
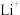 迁移方向是
迁移方向是(2)B极的电极反应式为
(3)C极上产生的气体是
(4)稀硫酸的作用是
(5)A极质量减轻14g,理论上可制备
您最近一年使用:0次



