名校
1 . (1)科研人员设想用如图所示装置生产硫酸。
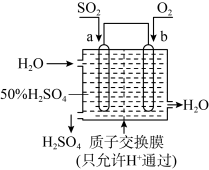
①上述生产硫酸的总反应方程式为_____ ,b是_____ 极(填“正”或“负”),a电极反应式为_______ ,生产过程中H+向_____ (填a或b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____ (填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成原电池装置,则负极材料为_____ ,电解质溶液为_____ 。
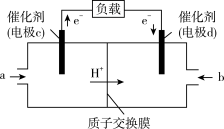
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)燃料电池的结构示意图如图:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____ 极(填“正”或“负”),c电极反应方程式为_________ 。

①上述生产硫酸的总反应方程式为
②该小组同学反思原电池的原理,其中观点正确的是
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成原电池装置,则负极材料为

(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)燃料电池的结构示意图如图:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为
您最近一年使用:0次
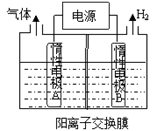
2 . (I)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。
B极区电解液为__________ 溶液(填化学式),阳极电极反应式为_________________________ ,
电解过程中Li+向__________ 电极迁移(填“A”或“B”)。
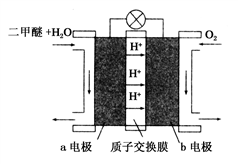
(Ⅱ)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是________ 极。
请写出负极的电极反应方程式:__________________
B极区电解液为
电解过程中Li+向

(Ⅱ)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图.b电极是
请写出负极的电极反应方程式:

您最近一年使用:0次
解题方法
3 . 硫元素的单质及其化合物在科学研究、工农业生产、农药的制备与使用等方面具有广泛用途。请
根据以下应用回答有关问题:
(1)已知单质硫有S2、S4、S6、S8、Sn等多种形式,在Sn分子内S原子以S—S单键形成“锯齿形”的n
元环。试画出S8的八元环结构式___________ 。
(2)绿色农药“石硫合剂”的有效成分为五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),可由单质硫和熟石灰在加热条件下制得,该反应的化学方程式为(反应中单质硫要求用S4表示);____________ 。
已知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式_________________ 。
(3)科学家探测出火星大气中含有一种称为硫化羰的物成,其化学式为COS,结构与二氧化碳分子相似。硫化羰可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。请你利用下表中相关共价键的键能数据:
根据有关反应原理写出硫化羰气体与水蒸气反应生成CO2和H2S的热化学方程式:______________ .
(4)S4广泛用于杀菌剂和抗真菌剂中,可由H2S2的燃料电池获得,其装置如下图所示。
①H2S2的名称是________ 。
②电极b为________ (选填“正极”、 “负极”)。
③电极a上发生的电极反应为:_______________ 。
(5)一氧化二硫(S2O)常温下是一种无色、不稳定的气体,实验室可由S8和氧化铜共热制得,同时生成硫化铜和SO2(注:生成物中气体产物等物质的量:升价与降价的硫也是等物质的量)。
该制备反应的化学方程式为________ ;
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元素的价态分析并写出该分解反应的化学方程式_____________________ 。
根据以下应用回答有关问题:
(1)已知单质硫有S2、S4、S6、S8、Sn等多种形式,在Sn分子内S原子以S—S单键形成“锯齿形”的n
元环。试画出S8的八元环结构式
(2)绿色农药“石硫合剂”的有效成分为五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),可由单质硫和熟石灰在加热条件下制得,该反应的化学方程式为(反应中单质硫要求用S4表示);
已知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式
(3)科学家探测出火星大气中含有一种称为硫化羰的物成,其化学式为COS,结构与二氧化碳分子相似。硫化羰可作为一种熏蒸剂,能防止某些昆虫、线虫的危害。请你利用下表中相关共价键的键能数据:
| 共价键 | C=O | C=S | H—O | H—S |
| 键能/kJ.mol-1 | 745 | 536 | 464 | 339 |
(4)S4广泛用于杀菌剂和抗真菌剂中,可由H2S2的燃料电池获得,其装置如下图所示。
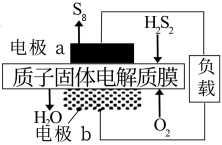
①H2S2的名称是
②电极b为
③电极a上发生的电极反应为:
(5)一氧化二硫(S2O)常温下是一种无色、不稳定的气体,实验室可由S8和氧化铜共热制得,同时生成硫化铜和SO2(注:生成物中气体产物等物质的量:升价与降价的硫也是等物质的量)。
该制备反应的化学方程式为
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元素的价态分析并写出该分解反应的化学方程式
您最近一年使用:0次
2017-04-23更新
|
185次组卷
|
2卷引用:江西省上饶市重点中学六校2017届高三第二次联考理科综合化学试题
4 . 氧化还原反应可拆分为氧化和还原两个“半反应”。某小组同学从“半反应”的角度探究反应规律。
(1)已知:IO +I-→I2的转化在酸性条件下才能发生。
+I-→I2的转化在酸性条件下才能发生。
①该转化的还原半反应是2IO +10e-+12H+=I2+6H2O,则相应的氧化半反应是
+10e-+12H+=I2+6H2O,则相应的氧化半反应是_______ 。
②分析上述还原半反应可知:增大c(H+)可促进IO 得到电子,使其
得到电子,使其_______ 性增强,进而与I-发生反应
(2)探究Cu与浓盐酸能否发生反应。
①有同学认为Cu与浓盐酸不能发生反应产生氢气,其依据是_______ 。
用如下装置进行实验[硫酸与浓盐酸中c(H+)接近]。
②甲是对比实验,目的是排除_______ 的干扰。
③a.丙中气球变鼓是因为生成了_______ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在[CuCl4]3-。从氧化还原性的角度分析丙中反应能够发生的原因:_______ 。
(3)探究以下原电池的工作原理。
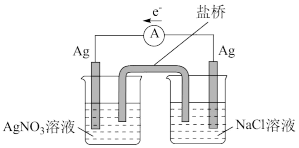
实验结果:产生电流,左侧Ag电极表面有Ag析出。右侧Ag电极周围生成AgCl。
①该装置中右侧Ag电极作_______ (填“正”或“负”)极。
②对该原电池的电极反应和总反应的反应类型进行分析,谈谈对原电池工作原理的认识:_______ 。
(1)已知:IO
 +I-→I2的转化在酸性条件下才能发生。
+I-→I2的转化在酸性条件下才能发生。①该转化的还原半反应是2IO
 +10e-+12H+=I2+6H2O,则相应的氧化半反应是
+10e-+12H+=I2+6H2O,则相应的氧化半反应是②分析上述还原半反应可知:增大c(H+)可促进IO
 得到电子,使其
得到电子,使其(2)探究Cu与浓盐酸能否发生反应。
①有同学认为Cu与浓盐酸不能发生反应产生氢气,其依据是
用如下装置进行实验[硫酸与浓盐酸中c(H+)接近]。
| 装置 | 序号 | 试管内药品 | 现象 |
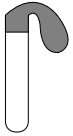 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 | Cu粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 | Cu粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在[CuCl4]3-。从氧化还原性的角度分析丙中反应能够发生的原因:
(3)探究以下原电池的工作原理。

实验结果:产生电流,左侧Ag电极表面有Ag析出。右侧Ag电极周围生成AgCl。
①该装置中右侧Ag电极作
②对该原电池的电极反应和总反应的反应类型进行分析,谈谈对原电池工作原理的认识:
您最近一年使用:0次
解题方法
5 . 有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
由此可判断这四种金属的活动性顺序是
| 实验 | |||
| 装置 | 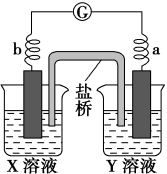 | 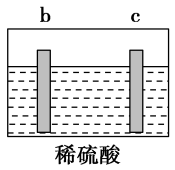 | 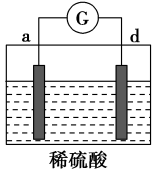 |
| 部分实验现象 | a极质量减小,b极质量增大 | b上有气体产生,c上无变化 | 在导线中,电流从a极流向d极 |
| A.a>b>c>d | B.b>c>d>a |
| C.d>a>b>c | D.a>b>d>c |
您最近一年使用:0次



