名校
解题方法
1 . (NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____ 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(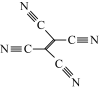 )。
)。
①CH3CN中碳原子的杂化方式是____ 和_____ 。
②TCNE中第一电离能较大的是___ (填元素符号),分子中所有原子____ (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___ 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为___ (列出计算式)g·cm-3。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(
 )。
)。①CH3CN中碳原子的杂化方式是
②TCNE中第一电离能较大的是
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为
您最近一年使用:0次
2020-04-06更新
|
618次组卷
|
4卷引用:江西省九江市十校2020届高三下学期模拟考试理综化学试题
江西省九江市十校2020届高三下学期模拟考试理综化学试题河南等省五岳2020届高三4月联考(全国I卷)理综化学试题河南省临颍县南街高级中学2020届高三下学期第一次月考理综化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
解题方法
2 . 2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。LiFePO4、聚乙二醇、LiPF6、LiAsF6和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Fe的价层电子排布式为___ 。
(2)Li、F、P、As四种元素的电负性由大到小的顺序为___ 。
(3)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是___ 。
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。
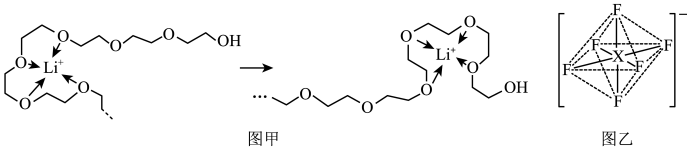
①聚乙二醇分子中,碳、氧的杂化类型分别是___ 、___ 。
②从化学键角度看,Li+迁移过程发生___ (填“物理变化”或“化学变化”)。
③PF6中P的配位数为___ 。
④相同条件,Li+在___ (填“LiPF6”或“LiAsF6”)中迁移较快,原因是___ 。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为___ 。LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加 德罗常数的值,则LiCl·3H2O晶体的密度为___ g·cm-3(列出计算表达式)。
(1)Fe的价层电子排布式为
(2)Li、F、P、As四种元素的电负性由大到小的顺序为
(3)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①聚乙二醇分子中,碳、氧的杂化类型分别是
②从化学键角度看,Li+迁移过程发生
③PF6中P的配位数为
④相同条件,Li+在
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为

您最近一年使用:0次
2020-03-13更新
|
293次组卷
|
2卷引用:江西省上饶市2020届高三5月第三次模拟考试理综化学试题
名校
解题方法
3 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为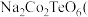 制备原料为
制备原料为 、
、 和
和 ,电解液为
,电解液为 的碳酸丙烯酯溶液。
的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中______ 区元素,其基态原子的价电子排布式为______ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为______ 。
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为______  用元素符号表示
用元素符号表示 。
。
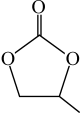
(4)碳酸丙烯酯的结构简式如下图所示,则其中碳原子的杂化轨道类型为______ ,1mol碳酸丙烯酯中σ键的数目为______ 。
 的几何构型为正八面体形,配体是
的几何构型为正八面体形,配体是______ ,该配离子包含的作用力为______  填选项字母
填选项字母 。
。
A.离子键 B. 极性键 C. 配位键 D.氢键 E. 金属键
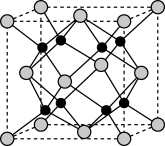
(6)Na和O形成的离子化合物的晶胞结构如下图所示,该晶胞的密度为ρg/ ,阿伏加 德罗常数的值为
,阿伏加 德罗常数的值为 ,则Na与O之间的最短距离为
,则Na与O之间的最短距离为_______________________ 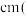 用含ρ、
用含ρ、 的代数式表示
的代数式表示 。
。
 制备原料为
制备原料为 、
、 和
和 ,电解液为
,电解液为 的碳酸丙烯酯溶液。
的碳酸丙烯酯溶液。回答下列问题:
(1)Te属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为
 用元素符号表示
用元素符号表示 。
。(4)碳酸丙烯酯的结构简式如下图所示,则其中碳原子的杂化轨道类型为

 的几何构型为正八面体形,配体是
的几何构型为正八面体形,配体是 填选项字母
填选项字母 。
。A.离子键 B. 极性键 C. 配位键 D.氢键 E. 金属键
(6)Na和O形成的离子化合物的晶胞结构如下图所示,该晶胞的密度为ρg/
 ,阿伏加 德罗常数的值为
,阿伏加 德罗常数的值为 ,则Na与O之间的最短距离为
,则Na与O之间的最短距离为 用含ρ、
用含ρ、 的代数式表示
的代数式表示 。
。
您最近一年使用:0次
2011·江西·一模
名校
解题方法
4 . 已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为:___________________________________ ,Y元素原子最外层电子的电子排布图为:____________ 。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为________ (填“共价键”或“离子键”)。
(3)该化合物的空间结构为______________ 形,中心原子的轨道杂化类型为__________ ,分子为______________ (填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____________ 。
(5)该化合物的沸点与SiCl4比较:________ (填化学式)的高,原因是__________________________ 。
(1)X元素的原子基态时电子排布式为:
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为
(3)该化合物的空间结构为
(4)该化合物在常温下为液体,该液体微粒间的作用力是
(5)该化合物的沸点与SiCl4比较:
您最近一年使用:0次
2019-04-27更新
|
398次组卷
|
15卷引用:2011届江西省八所重点中学联合考试高三(理综)化学部分
(已下线)2011届江西省八所重点中学联合考试高三(理综)化学部分(已下线)2012-2013学年山东省淄博市沂源一中高二下学期期中模块检测化学卷河北省秦皇岛市卢龙县2016-2017学年高二下学期期末考试化学试题人教版2017-2018学年高二化学选修三同步训练:2.3 分子的性质(第2课时)贵州省息烽县一中2018-2019学年高二11月份考试化学试题云南省巧家县四中2018-2019学年高二上学期12月份考试化学试题贵州省从江县第一民族中学2018-2019学年高二上学期期末考试化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题云南省玉溪市江川二中2018-2019学年高二下学期5月份考试化学试题云南省昭通市永善县第二中学2019—2020学年高二上学期期末考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题(已下线)第二章 分子结构与性质【过关测试提高卷】-2020-2021学年高二化学单元复习(新教材人教版选择性必修2)辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题 新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题云南省大理州实验中学2021-2022学年高二下学期化学期中考试题
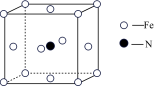
5 . 铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:
(1)铁元素基态原子的电子排布式为_________ ,3d能级上的未成对电子数为_________ ,能量最高能级的电子云形状为_________ 。
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为_________ ,写出一个与SCN-具有相同空间构型的分子:_________ 。
(3)氮元素的最简单氢化物为氨,氨的沸点_________ (填“高于”或“低于”)膦(PH3),原因是_________ 。氮元素另一种氢化物联氨(N2H4)是_________ (填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为_________ 。
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是_________ 。
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_________ 。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_________ g/cm3(设阿伏伽德罗常数的值为NA)。
(1)铁元素基态原子的电子排布式为
(2)Fe3+可用KSCN溶液检验,形成的配合物颜色为
(3)氮元素的最简单氢化物为氨,氨的沸点
(4)铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:

您最近一年使用:0次
名校
6 . 含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________ ,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____ 种 ,第一电离能比P大有____ 种。
(3)PH3分子的空间构型为___________ 。PH3的键角小于NH3的原因是__________ 。
(4)化合物(CH3)3N能溶于水,试解析其原因____________ 。
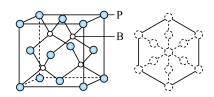
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ 。
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________ 。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)与P同周期的主族元素中,电负性比P小的元素有
(3)PH3分子的空间构型为
(4)化合物(CH3)3N能溶于水,试解析其原因

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑
您最近一年使用:0次
2019-02-13更新
|
2515次组卷
|
8卷引用:江西省上饶市2020届第一次高考模拟考试理科综合化学试题
江西省上饶市2020届第一次高考模拟考试理科综合化学试题【市级联考】四川省攀枝花市2019届高三上学期第二次统考化学试题【市级联考】山东省泰安市2019届高三下学期二轮模拟考试理科综合化学试题解题达人.化学选择题(2021全国卷)精编特训06(已下线)2021年高考全国甲卷化学试题变式题2020年全国卷Ⅰ理综化学高考真题变式题(已下线)2020年海南卷化学高考真题变式题15-19河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期7月份月考化学试题
2011·江西抚州·一模
7 . 下表为长式周期表的一部分,其中的序号代表对应的元素。
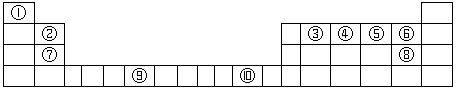
(1)写出上表中元素⑨原子的基态原子核外电子排布式为___________________ 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为_____ 杂化;元素⑦与⑧形成的化合物的晶体类型是___________ 。
(3)元素④的第一电离能______ ⑤(填写“>”、 “=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为__________ 。请写出与元素④的单质互为等电子体分子、离子的化学式______________________ (各写一种)。
(4)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为_______________ 。
(5)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________ 。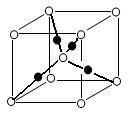

(1)写出上表中元素⑨原子的基态原子核外电子排布式为
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为
(3)元素④的第一电离能
(4)④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为
(5)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为

您最近一年使用:0次
名校
解题方法
8 . 第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________ ,电子占据的最高能层的轨道形状为__________ 。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________ 。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________ (任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________ 。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________ 。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物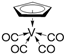 的熔点为138 ℃,其晶体类型为
的熔点为138 ℃,其晶体类型为__________ ;已知该化合物满足18电子规则,其配体“ ”中的大π键可表示为
”中的大π键可表示为__________ 。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。
①VCl2和VBr2两者熔点差异的原因是__________ 。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________ (用含a、c、r+和r-的式子表示)。
(1)钒在周期表中的位置为
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、
②CO作配体时,配位原子是C而不是O,其原因是
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物
 的熔点为138 ℃,其晶体类型为
的熔点为138 ℃,其晶体类型为 ”中的大π键可表示为
”中的大π键可表示为(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为
您最近一年使用:0次
2018-05-29更新
|
792次组卷
|
5卷引用:【全国百强校】江西省新余市第四中学2020届高三第七次训练理科综合化学试题
【全国百强校】江西省新余市第四中学2020届高三第七次训练理科综合化学试题【全国百强校】四川省绵阳中学2018届高三考前适应性考试(三)理科综合化学试题四川省绵阳南山中学2020届高三下学期3月网络考试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编解题达人.化学选择题(2021全国卷)精编特训10
名校
9 . 由N、P、Ti等元素组成的新型材料有着广泛的用途,请回答下列问题。
(1)钛元素基态原子未成对电子数为____ 个,能量最高的电子占据的能级符号为__ 。
(2)磷的一种同素异形体—白磷(P4)的立体构型为____ ,推测其在CS2中的溶解度____ (填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:________ 。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:______ 。
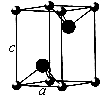
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____ ,已知晶体的密度为pg·cm-3,阿伏伽德罗常数为NA,则晶胞边长为____ cm(用含p、NA的式子表示)。
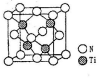
(1)钛元素基态原子未成对电子数为
(2)磷的一种同素异形体—白磷(P4)的立体构型为
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因:
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4。写出生成TiCl4的化学反应方程式:
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为

您最近一年使用:0次
2018-05-28更新
|
297次组卷
|
4卷引用:江西省南昌市2018届高三第二次模拟考试理科综合化学试题
江西省南昌市2018届高三第二次模拟考试理科综合化学试题(已下线)2018年高考题及模拟题汇编 专题18 物质结构与性质(选修)广东省北大附中深圳南山分校2020届高三上学期期中考试化学试题2020届高三化学二轮选修大题必练— —— 物质结构与性质
名校
解题方法
10 . 据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____ 区元素,其基态原子的价电子排布式为_____ 。
(2)基态Na原子中,核外电子占据的原子轨道总数为____ ,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____ (用元素符号表示)。
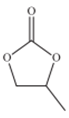
(4)CO32-的几何构型为______ ;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________ ,1mol碳酸丙烯酯中键的数目为________ .
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____ ,该配离子包含的作用力为__ (填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______ ,该晶胞的密度为ρg/cm3,阿伏伽德罗常数的值为NA,则Na与O之间的最短距离为_____ cm(用含ρ、NA的代数式表示)。
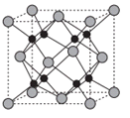
回答下列问题:
(1)Te属于元素周期表中
(2)基态Na原子中,核外电子占据的原子轨道总数为
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为
(4)CO32-的几何构型为

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为

您最近一年使用:0次
2018-04-27更新
|
459次组卷
|
5卷引用:【市级联考】江西省宜春市2019届高三上学期期末统考理科综合化学试题



