1 . 短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是
| A.X能与多种元素形成共价键 | B.简单氢化物沸点: |
C.第一电离能: | D.电负性: |
您最近一年使用:0次
2022-07-06更新
|
9246次组卷
|
28卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题
江西省宜春市宜丰中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题06 物质结构元素周期律-2022年高考真题模拟题分项汇编(已下线)2022年辽宁省高考真题化学试题(部分试题)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)2022年辽宁高考真题化学试题(已下线)2022年辽宁省高考真题变式题(1-10)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京清华附中2022-2023学年高三上学期10月统练(三)化学试题(已下线)易错点13 原子结构与核外电子排布-备战2023年高考化学考试易错题(已下线)第36讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题1-5)(已下线)题型9 元素“位—构-性”关系的综合应用-高考必备50个题型(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 物质结构与性质(选择题)-2023年高考化学真题题源解密(新高考专用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用) 天津市静海区第一中学2023-2024学年高三上学期12月月考化学试题天津市和平区2023-2024学年高三下学期第一次质量调查化学试卷吉林省长春外国语学校2021-2022学年高二下学期期末考试化学试题吉林省长春市第五中学2022-2023学年高二上学期期末考试化学试题河南省鹤壁市高中2022-2023学年高二下学期第一次段考化学试题天津市和平区2022-2023学年高二下学期期末质量调查化学试题天津市第一中学2022-2023学年高二上学期期末考试化学试题河北省遵化市第一中学2023-2024学年高二上学期月考2化学试题吉林省长春市第二实验中学2023-2024学年高二下学期开学考试化学试题内蒙古呼和浩特市剑桥中学2023-2024学年高二下学期3月月考化学试题
2 . 某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Z的最外层电子数等于W的核外电子数。下列叙述正确的是
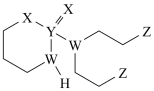

| A.W位于第二周期IIIA族 |
| B.基态Y原子只有1个未成对电子 |
| C.W、Z的最简单氢化物混合物的沸点,前者小于后者 |
| D.电负性:W>Y |
您最近一年使用:0次
2022-06-03更新
|
190次组卷
|
2卷引用:江西省丰城中学2023-2024学年高三上学期12月月考化学试题
3 . W、X、Y、Z、M是构成离子液体的五种短周期不同主族元素,原子序数依次增大且只有一种元素与其他元素不在同一周期。离子液体被广泛应用于有机合成、分离提纯以及电化学研究中。离子液体的结构如图所示。下列有关说法错误的是
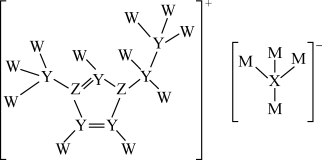

| A.Y的氢化物常温下为气体 |
| B.元素W与X形成的化合物中W显负价 |
| C.Z的最高价含氧酸能与其对应的简单氢化物反应 |
| D.由W、Z、M元素可形成同时含有离子键和共价键的化合物 |
您最近一年使用:0次
2022-05-05更新
|
535次组卷
|
3卷引用:江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题
江西省重点中学盟校2022届高三下学期5月第二次联考理综化学试题(已下线)微专题31 元素推断的破解-备战2023年高考化学一轮复习考点微专题湖南省株洲市十三中2022-2023学年高三第五次月考化学试题
名校
解题方法
4 . 以物质的量之比3:1的Fe和Al共熔后结晶得Fe3Al晶体,晶胞结构如图一所示,该晶胞为立方晶胞,晶胞参数为a pm。血红素(如图二)是血红蛋白的活性部位,其中心元素是Fe( II)。二者是常见的含铁物质,请回答下列问题。
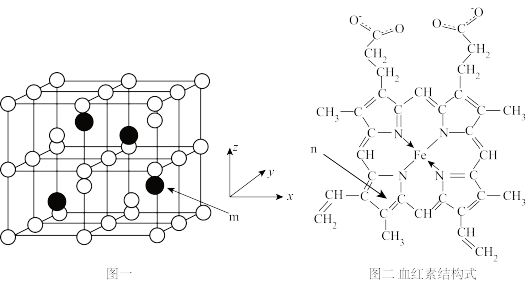
(1)Fe2+的价电子排布式为:_______ 。
(2)血红素分子中非金属元素电负性由大到小的顺序是_______ (用元素符号表示);这些元素形成的简单氢化物中沸点由高到低的顺序是_______ (用化学式表示);C、N、O三种元素形成一种阴离子CNO-,其结构中有_______ 个σ键,_______ 个π键。
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为_______ ;该环_______ (填“有”、“无”)芳香性。
(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为_______ (以含π的代数式表示)。
(5)m原子的原子分数坐标为_______ . ;晶胞内任意两个A1原子之间的距离为_______ pm。
(6)Fe3Al晶体的密度为_______ g·cm-3。

(1)Fe2+的价电子排布式为:
(2)血红素分子中非金属元素电负性由大到小的顺序是
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3
 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为
(5)m原子的原子分数坐标为
(6)Fe3Al晶体的密度为
您最近一年使用:0次
2022-04-29更新
|
627次组卷
|
3卷引用:江西省九江市2021届高三三模考试化学试题
名校
解题方法
5 . 已知P4单质、次磷酸的结构如图,P4在KOH溶液中的变化是: P4+3KOH+3H2O═3KH2PO2+PH3↑,下列说法正确的是
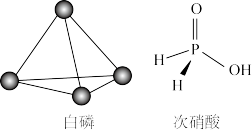

| A.PH3分子中所有的原子可能共平面 |
| B.31 g P4含有1.5NA个P﹣P |
| C.元素的电负性大小顺序:P>O>H>K |
| D.KH2PO2属于酸式盐 |
您最近一年使用:0次
2022-04-29更新
|
115次组卷
|
4卷引用:江西省宜春市丰城市第九中学2023-2024学年高三上学期开学考化学试题
名校
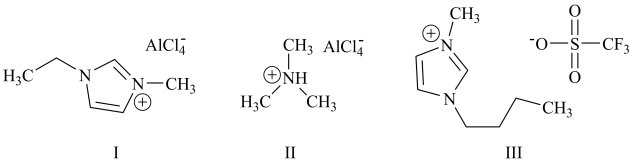
6 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________(填编号)。
(3)化合物I中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物III中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为_____ 。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______ g·cm-3(列出计算式)。
(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.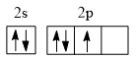 | B.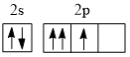 | C.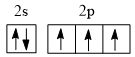 | D.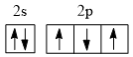 |
(4)化合物III中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
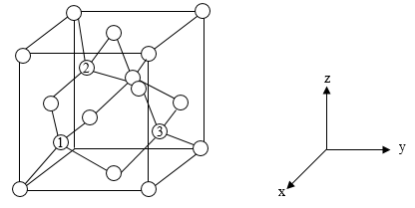
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(
 ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-03-17更新
|
2751次组卷
|
10卷引用:江西省新余市2022届高三第二次模拟考试理综化学试题
江西省新余市2022届高三第二次模拟考试理综化学试题广东省广州市2022届高三一模考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国乙卷)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)广东省广州市2021-2022学年高三下学期一模考试化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题(已下线)热点25 物质结构与性质综合题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
7 . 由于铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,受到研究人员的广泛关注。γˊ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去___________ 轨道电子,Fe3+价层电子排布图为___________ 。
(2)氨气中N的杂化类型是___________ ,NH3中H−N−H的键角比NH4+中H−N−H的键角___________ (填“大”或“小”),理由是___________ 。
(3) 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有___________ (填标号)。
A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是___________ ,配位原子为___________ 。
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为___________ 。
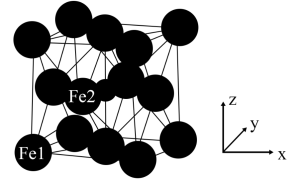
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为___________ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
(3)
 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
2021-12-31更新
|
288次组卷
|
5卷引用:江西稳派2022-2023学年高三上学期期中联考化学试题
名校
解题方法
8 . 金属钛有“生物金属、海洋金属、太空金属”的美称。有些含钛的化合物在耐高温、环保或者抑菌方面有着重要的应用,钛元素也被称为“健康钛”。
(1)Ti元素位于元素周期表的_______ 区,基态原子电子排布式为_______ 。
(2)TiCl4与SiCl4互为等电子体。SiCl4可以与N-甲基咪唑
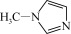
 发生反应。
发生反应。
①TiCl4分子的空间构型为_______ 。
②N-甲基咪唑分子中碳原子的杂化轨道类型为_______ ,C、N、Si的电负性由大到小的顺序为_______ ,1个 含有
含有_______ 个π键。
(3)TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。
① TiCl4 (H2NCH2CH2NH2)中提供电子对形成配位键的原子是_______ 。
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性较差的是_______ (填“Mg2+”或“Cu2+”)。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似(如图),其中阴离子(N3-)采用面心立方最密堆积方式,X-射线衍射实验测得氮化钛的晶胞参数(晶胞边长)为a pm,则r(N3-)为_______ pm。该氮化钛的密度为_______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

(1)Ti元素位于元素周期表的
(2)TiCl4与SiCl4互为等电子体。SiCl4可以与N-甲基咪唑


 发生反应。
发生反应。①TiCl4分子的空间构型为
②N-甲基咪唑分子中碳原子的杂化轨道类型为
 含有
含有(3)TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。
① TiCl4 (H2NCH2CH2NH2)中提供电子对形成配位键的原子是
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性较差的是
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似(如图),其中阴离子(N3-)采用面心立方最密堆积方式,X-射线衍射实验测得氮化钛的晶胞参数(晶胞边长)为a pm,则r(N3-)为

您最近一年使用:0次
2021-11-18更新
|
906次组卷
|
7卷引用:江西省重点校2022-2023学年高三上学期第二次联考化学试题.
江西省重点校2022-2023学年高三上学期第二次联考化学试题.黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】17(已下线)一轮巩固卷8-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)宁夏吴忠市2022届高三4月模拟联考(二模)理科综合化学试题黑龙江省大庆市2023-2024学年高三上学期第一次模拟考试化学试题山东省威海乳山市银滩高级中学2021-2022学年高二12月月考化学试题
解题方法
9 . 锌及其化合物在工农业生产及科学研究中具有广泛的用途。回答下列问题:
(1)Zn位于元素周期表的___________ 区,基态Zn2+的核外电子排布式为___________ 。
(2)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。
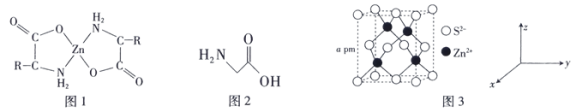
①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的原子是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(3)ZnS可用于制白色颜料、玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS的晶胞如图3所示。
①上图中 的坐标有
的坐标有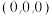 、
、 ,与
,与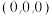 距离最近的
距离最近的 还有
还有___________ (填坐标)。
②Zn2+占据___________ (填“八面体”或“四面体”)空隙,空隙利用率为___________ %。
③ZnS的密度为___________  。
。
(1)Zn位于元素周期表的
(2)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的原子是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(3)ZnS可用于制白色颜料、玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS的晶胞如图3所示。
①上图中
 的坐标有
的坐标有 、
、 ,与
,与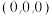 距离最近的
距离最近的 还有
还有②Zn2+占据
③ZnS的密度为
 。
。
您最近一年使用:0次
2021-07-05更新
|
127次组卷
|
2卷引用:江西省赣抚吉名校2022届高三上学期8月联合考试化学试题
解题方法
10 . 铑的配合物Rh(PPh3)Cl可催化丙烯与氢气的加成,反应过程为:CH3CH=CH2+H2 CH3CH2CH3,回答下列问题:
CH3CH2CH3,回答下列问题:
(1)基态Rh原子的价电子排布式为4d85s1,铑在周期表的位置是_______ ,其原子中的未成对电子数为_______ 。
(2) 1mol丙烯(CH3CH=CH2)中σ键的数目为_______ ,其结构简式中打点的C原子与H原子间的σ键可称为sp2-sσ键,则丙烯分子中C原子之间的所有σ键可称为_______ 。
(3)第一电离能P_______ Cl (填“大于”或“小于”),PPh3是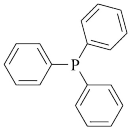 的缩写,该分子的立体构型是
的缩写,该分子的立体构型是_______ 。比较PPh3与PH3的沸点大小,并说明原因_______ 。
(4) RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):
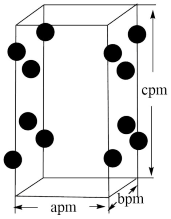
①晶胞中含有的Cl-数目为_______ ;
②若阿伏加德罗常数为NA,则晶体的密度为_______ g·cm-3.(列出计算式)
 CH3CH2CH3,回答下列问题:
CH3CH2CH3,回答下列问题:(1)基态Rh原子的价电子排布式为4d85s1,铑在周期表的位置是
(2) 1mol丙烯(CH3CH=CH2)中σ键的数目为
(3)第一电离能P
 的缩写,该分子的立体构型是
的缩写,该分子的立体构型是(4) RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):

①晶胞中含有的Cl-数目为
②若阿伏加德罗常数为NA,则晶体的密度为
您最近一年使用:0次
2021-05-31更新
|
257次组卷
|
2卷引用:江西省新余市2023届高三下学期第二次模拟考试理科综合化学试题



