名校
1 . CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O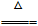 2CuCl↓+4H++SO
2CuCl↓+4H++SO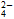
2CuCl2+SnCl2===2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:

请回答下列问题:
(1)基态Cu原子的核外电子排布式为________ ;H、N、O三种元素的电负性由大到小的顺序是________ 。
(2)SO2分子的空间构型为________ ;与SnCl4互为等电子体的一种离子的化学式为________ 。
(3)乙二胺分子中氮原子轨道的杂化类型为________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是_________________________________ 。
(4)②中所形成的配离子中含有的化学键类型有______ (填字母)。
A.配位键 B.极性键
C.离子键 D.非极性键
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O
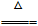 2CuCl↓+4H++SO
2CuCl↓+4H++SO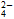
2CuCl2+SnCl2===2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:

请回答下列问题:
(1)基态Cu原子的核外电子排布式为
(2)SO2分子的空间构型为
(3)乙二胺分子中氮原子轨道的杂化类型为
(4)②中所形成的配离子中含有的化学键类型有
A.配位键 B.极性键
C.离子键 D.非极性键
您最近一年使用:0次
2019-01-04更新
|
444次组卷
|
5卷引用:云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题
2 . 现有短周期A、B、C三种元素,原子序数依次增大,A元素的单质是密度最小的气体,B获得2个电子可达到稳定结构,C与A同主族。
(1)判断A、B、C各为何种元素(填名称)。
A________ ,B________ ,C________ 。
(2)用电子式表示三种元素原子之间可能构成的化合物的形成过程,并指出各自化学键的类型:
①A与B:__________________ 。
②A与C:________________ 。
③B与C:______________ 。
④A、B、C_________________ 。
(1)判断A、B、C各为何种元素(填名称)。
A
(2)用电子式表示三种元素原子之间可能构成的化合物的形成过程,并指出各自化学键的类型:
①A与B:
②A与C:
③B与C:
④A、B、C
您最近一年使用:0次
解题方法
3 . 有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__ ;D的价电子排布图为__ ;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__ (填写分子的化学式); 在③的分子中有__ 个σ键和__ 个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__ ;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__ ,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__ .
(1)上述元素中,第一电离能最小的元素的原子结构示意图为
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为
您最近一年使用:0次
2019-01-02更新
|
208次组卷
|
5卷引用:云南省盐津县第一中学2018-2019学年高二上学期12月份考试化学试题
11-12高二下·吉林·期中
名校
解题方法
4 . 能说明CH4分子的5个原子不在同一平面而为正四面体构型的是
| A.两个键之间夹角为109.5° | B.C—H键为极性共价键 |
| C.4个C—H键的键能、键长相同 | D.碳的价层电子都形成共价键 |
您最近一年使用:0次
2018-12-26更新
|
644次组卷
|
9卷引用:云南省盐津县第二中学2018-2019学年高二上学期12月份考试化学试题
云南省盐津县第二中学2018-2019学年高二上学期12月份考试化学试题云南省禄丰县一中2019-2020学年高二12月月考化学试题云南省耿马县民族中学2019-2020学年高二12月月考化学试题(已下线)2011-2012学年吉林省四校高二下学期期中联考化学试卷宁夏吴忠市高二人教版选修3第2章 分子结构与性质综合练习2课时1 一些典型分子的空间构型杂化轨道理论——A学习区 夯实基础(鲁科版选修3)江西省萍乡市莲花中学2019-2020学年高一下学期第二次月考化学试题宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期中考试化学试题新疆哈密市第八中学2019-2020学年高二下学期期中考试化学试题
名校
5 . 下列说法中,错误的是
| A.非金属元素可能形成离子化合物 |
| B.成键原子间原子轨道重叠的愈多,共价键愈牢固 |
| C.对双原子分子来说,键能愈大,含有该键的分子愈稳定 |
| D.键长愈长,化学键愈牢固 |
您最近一年使用:0次
2018-12-26更新
|
214次组卷
|
4卷引用:云南省盐津县第二中学2018-2019学年高二上学期12月份考试化学试题
解题方法
6 . 请按要求填空:
(1)Mg是第3周期元素,该周期部分元素氟化物的熔点见下表:
①解释表中氟化物熔点差异的原因:
a._________________________________________________ 。
b.__________________________________ 。
②硅在一定条件下可以与Cl2反应生成SiCl4,试判断SiCl4的沸点比CCl4的________ (填“高”或“低”),理由__________________________________ 。
(2)下列物质变化,只与范德华力有关的是_________
a.干冰熔化 b.乙酸汽化
c.石英熔融 d.HCONHCH3CH3溶于水
e.碘溶于四氯化碳
(3)C,N元素形成的新材料具有如下图所示结构, 该晶体的化学式为:_______________ 。该晶体硬度将超过目前世界上最硬的金刚石,其原因是________________________ 。

(4)FeCl3常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断FeCl3的晶体类型为_________________ 。
(5)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大,熔点高、化学性质稳定。
①氮化硅的硬度________ (“大于”或“小于”)氮化碳的硬度,原因是________________ 。
②下列物质熔化时所克服的微粒间的作用力与氮化硅熔化时所克服的微粒间的作用力相同的是_________ 。
a.单质I2和晶体硅 b.冰和干冰
c.碳化硅和二氧化硅 d.石墨和氧化镁
③已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式________ 。
(6)第ⅢA,ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与______ 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________ 。在四大晶体类型中,GaN属于_______ 晶体。
(1)Mg是第3周期元素,该周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
①解释表中氟化物熔点差异的原因:
a.
b.
②硅在一定条件下可以与Cl2反应生成SiCl4,试判断SiCl4的沸点比CCl4的
(2)下列物质变化,只与范德华力有关的是
a.干冰熔化 b.乙酸汽化
c.石英熔融 d.HCONHCH3CH3溶于水
e.碘溶于四氯化碳
(3)C,N元素形成的新材料具有如下图所示结构, 该晶体的化学式为:

(4)FeCl3常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断FeCl3的晶体类型为
(5)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大,熔点高、化学性质稳定。
①氮化硅的硬度
②下列物质熔化时所克服的微粒间的作用力与氮化硅熔化时所克服的微粒间的作用力相同的是
a.单质I2和晶体硅 b.冰和干冰
c.碳化硅和二氧化硅 d.石墨和氧化镁
③已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式
(6)第ⅢA,ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。在GaN晶体中,每个Ga原子与
您最近一年使用:0次
7 . 下列各组微粒属于等电子体的是( )
| A.12CO2和14CO | B.H2O和CH4 |
| C.N2和13CO | D.NO和CO |
您最近一年使用:0次
8 . 已知SiC晶体具有较大的硬度,且原子间均以单键结合,下列关于晶体的说法正确的是( )
| A.SiC晶体是分子晶体 |
| B.SiC晶体中,C-Si键的键长比金刚石中C-C键的键长要短 |
| C.SiC晶体中微粒间通过离子键结合 |
| D.SiC晶体中每个C原子连接4个Si原子,而每个Si原子连接4个C原子 |
您最近一年使用:0次
2018-12-24更新
|
871次组卷
|
8卷引用:云南省巧家县四中2018-2019学年高二上学期12月份考试化学试题
云南省巧家县四中2018-2019学年高二上学期12月份考试化学试题云南省玉溪市江川区第二中学2018-2019学年高二上学期期末考试化学试题云南省通海三中2018-2019学年高二下学期6月份考试化学试题云南省玉溪市新平三中2019-2020学年高二上学期12月份月考化学试题(已下线)2020年山东卷化学高考真题变式题1-10(人教版2019)选择性必修2 第三章 晶体结构与性质 第二节 分子晶体与共价晶体 第2课时 共价晶体鲁科版2019选择性必修2第3章 不同聚集状态的物质与性质 第2节 几种简单的晶体结构模型 第3课时 共价晶体(已下线)【知识图鉴】单元讲练测选择性必修2第三章01讲核心
名校
9 . 下列有关化学键类型的判断不正确的是
| A.s—s σ键与s—p σ键的对称性相同 |
| B.分子中含有共价键,则至少含有一个σ键 |
| C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C) |
| D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键 |
您最近一年使用:0次
2018-12-19更新
|
323次组卷
|
6卷引用:云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题
名校
10 . 电子数相等的粒子叫等电子体,下列粒子不属于等电子体的是
| A.CH4和NH4+ | B.NO和O2 |
| C.HCl和H2S | D.NH2﹣和H3O+ |
您最近一年使用:0次
2018-12-19更新
|
175次组卷
|
3卷引用:云南省华宁二中2018-2019学年高二下学期开学考试化学试题



