9-10高二下·江苏·期末
名校
解题方法
1 . 已知A,B,C,D,E,F均为周期表中前36号元素,且原子序数依次增大.A,B,C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A,F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:
(1)A,B,C三种元素的电负性最大的是__ (填写元素符号),D,E两元素中D的第一电离能较大的原因是__ .
(2)F基态原子的核外电子排布式是__ ;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于__ 光谱(填“吸收”或“发射”).
(3)根据等电子原理,写出AB+的电子式:__ .
(4)已知:F3+可形成配位数为6的配合物.组成为FCl3•6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为__ .
A [CrCl(H2O)5]Cl2•H2O B [CrCl2(H2O)4]Cl•2H2O
C [Cr(H2O)6]Cl3 D [CrCl3(H2O)3]•3H2O
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |
(2)F基态原子的核外电子排布式是
(3)根据等电子原理,写出AB+的电子式:
(4)已知:F3+可形成配位数为6的配合物.组成为FCl3•6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为
A [CrCl(H2O)5]Cl2•H2O B [CrCl2(H2O)4]Cl•2H2O
C [Cr(H2O)6]Cl3 D [CrCl3(H2O)3]•3H2O
您最近一年使用:0次
2019-07-03更新
|
74次组卷
|
4卷引用:云南省西双版纳州民族中学2017-2018学年高二6月份考试化学试题
2 . 下列关于甲烷分子结构的说法正确的是( )
A.甲烷分子的电子式为 ,分子中各原子都达到8电子稳定结构 ,分子中各原子都达到8电子稳定结构 |
| B.甲烷分子中的化学键全部为非极性键 |
| C.CH4分子比SiH4分子稳定,说明碳元素的非金属性比硅元素的非金属性强 |
| D.CH3Cl的四个价键的键长和强度相同,夹角相等 |
您最近一年使用:0次
2019-06-20更新
|
68次组卷
|
2卷引用:云南省新平一中2018-2019学年高一6月月考化学试题
3 . 与NO3¯互为等电子体的是( )
| A.SO3 | B.PCl3 | C.CH4 | D.NO2 |
您最近一年使用:0次
2019-06-12更新
|
139次组卷
|
4卷引用:云南省玉溪市通海县第二中学2018-2019学年高二下学期5月月考化学试题
名校
4 . 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
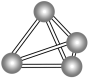

| A.N4分子中只含有非极性键 | B.N4分子属于一种新型的化合物 |
| C.1 mol N4分子所含共价键数为4NA | D.N4沸点比P4(白磷)高 |
您最近一年使用:0次
2019-06-09更新
|
143次组卷
|
16卷引用:云南省玉溪市江川二中2018-2019学年高一下学期5月份考试化学试题
云南省玉溪市江川二中2018-2019学年高一下学期5月份考试化学试题2015-2016学年江西省崇义中学高一下学期第一次月考化学试卷2015-2016学年湖南衡阳一中高一下期中化学试卷2015-2016学年湖北省枣阳市白水高中高一5月月考化学试卷2015-2016学年湖北省松滋一中高一下学期期末化学试卷内蒙古杭锦后旗奋斗中学2016-2017学年高一下学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题河北省永清县第一中学2018-2019学年高一下学期第二次月考化学试题2019—2020学年人教版必修1第一章第三节《化学键》第2课时 《化学键与分子间作用力》(跟踪训练)(已下线)山西省原平市范亭中学2018-2019学年高二4月月考化学试题(已下线)【全国百强校】吉林省延边第二中学2018-2019学年高二下学期期中考试化学试题(已下线)练习15 化学键-2020-2021学年【补习教材·寒假作业】高一化学(人教版)云南省马关县一中2020-2021学年高一下学期6月月考化学试题吉林省辽源市田家炳高级中学2020-2021学年高二下学期期中化学试题四川省眉山市仁寿第二中学等四校2020-2021学年高一下学期期中考试(5月)化学试题江西省抚州市南城一中2020-2021学年高一下学期5月月考化学试题
11-12高二下·吉林白山·阶段练习
名校
5 . 通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是()
| A.CH4和NH4+是等电子体,键角均为60° |
| B.NO3-和CO32-是等电子体,均为平面正三角形结构 |
| C.H3O+和PCl3是等电子体,均为三角锥形结构 |
| D.B3N3H6和苯是等电子体,B3N3H6分子中也存在“肩并肩”式重叠的轨道 |
您最近一年使用:0次
2019-06-06更新
|
421次组卷
|
32卷引用:云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题
云南省玉溪市通海三中2018-2019学年高二上学期10月考试化学试题云南省泸水五中2018-2019学年高二上学期期中考试化学试题云南省香格里拉县一中2018-2019学年高二上学期期中考试化学试题云南省新平县一中2018-2019学年高二上学期12月考试化学试题云南省华宁二中2018-2019学年高二下学期开学考试化学试题云南省墨江第二中学2019—2020学年高二上学期期末考试化学试题(已下线)2011-2012学年吉林省白山二中高二下学期第一次月考化学试卷(已下线)2011-2012学年新疆喀什二中高一下学期第一次月考检测化学试卷(已下线)2012-2013学年四川省南山中学高二10月月考化学试卷2015-2016学年山西大学附属中学高二下3月月考化学试卷2015-2016学年贵州省思南中学高二下期中化学试卷2015-2016学年山西大学附中高二下3月月考化学试卷2016-2017学年河南省师范大学附属中学高二下学期第二次月考理科综合化学试卷广东省实验中学2016-2017学年高二下学期期中考试化学试题辽宁省实验中学分校2016-2017学年高二6月月考化学试题人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质人教版2017-2018学年高二化学选修三同步训练:2.1 共价键(第2课时)峨山县第一中学2017-2018学年第二学期3月份月考卷(高二化学)宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题【全国百强校】宁夏银川唐徕回民中学2017-2018学年高二下学期期中考试化学试题【全国百强校】辽宁省葫芦岛市第一高级中学2017-2018学年高二下学期期中考试化学试题【全国百强校】福建省三明市第一中学2019届高三第二次返校考试化学试题【全国百强校】福建省厦门外国语学校2018-2019学年高二上学期第一次月考化学试题(已下线)2018年12月2日 《每日一题》 一轮复习-每周一测贵州省息烽县一中2018-2019学年高二上学期期中考试化学试题【全国百强校】江苏省启东中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年6月27日 《每日一题》选修3—— 等电子微粒的推断吉林省公主岭市范家屯镇第一中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年12月1日《每日一题》2020年高考化学一轮复习—— 每周一测安徽省毛坦厂中学2019-2020学年高二上学期期中考试化学试题(已下线)专题11.2 分子结构与性质(讲)-《2020年高考一轮复习讲练测》上海中学东校2023-2024学年高三上学期9月月考化学试题
名校
6 . 金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____ 。
②与BH4-互为等电子体的阳离子的化学式为_____ 。
③H、B、Ti原子的第一电离能由小到大的顺序为_____ 。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
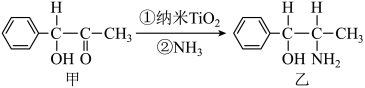
化合物乙的分子中采取sp3杂化方式的原子个数为_____ 。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____ 。
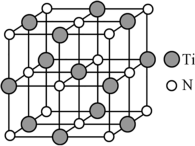
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____ 。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为
②与BH4-互为等电子体的阳离子的化学式为
③H、B、Ti原子的第一电离能由小到大的顺序为
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。

化合物乙的分子中采取sp3杂化方式的原子个数为
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是

您最近一年使用:0次
2019-06-01更新
|
521次组卷
|
4卷引用:云南省楚雄姚安一中2020届高三3月线上模拟理综化学试题
名校
解题方法
7 . 深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6] 2(CN)2↑+12KCN+N2↑+Fe3C+C
2(CN)2↑+12KCN+N2↑+Fe3C+C
请回答下列问题:
(1)①Fe2+基态核外电子排布式为_____ 。
② 的空间构型为
的空间构型为______ (用文字描述)。
③(CN)2分子中碳原子杂化轨道类型为_______ ,一种与CN-互为等电子体的分子的电子式为_______ 。
④1molFe(CN)63−中含有σ键的数目为____ mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___ 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____ (填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则该立方体是不是Fe3O4的晶胞______ (填“是”或“否”),立方体中三价铁离子处于氧离子围成的________ (填空间结构)空隙。

(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71g•cm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____ 。(用代数式表示,不要求算出具体结果)。
 2(CN)2↑+12KCN+N2↑+Fe3C+C
2(CN)2↑+12KCN+N2↑+Fe3C+C请回答下列问题:
(1)①Fe2+基态核外电子排布式为
②
 的空间构型为
的空间构型为③(CN)2分子中碳原子杂化轨道类型为
④1molFe(CN)63−中含有σ键的数目为
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则该立方体是不是Fe3O4的晶胞

(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71g•cm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=
您最近一年使用:0次
2019-05-28更新
|
458次组卷
|
2卷引用:云南省玉溪一中2020届高三上学期第二次月考化学试题
名校
8 . 下列物质中,σ键数目与Π键数目之比为1﹕1的是()
| A.N2 | B.CS2 | C.HCHO | D.H2O2 |
您最近一年使用:0次
2019-05-14更新
|
268次组卷
|
4卷引用:【全国百强校】福建省莆田第一中学2018-2019学年高二下学期期中考试化学试题
名校
9 . 下列有关化学键类型的判断正确的是
| A.全部由非金属元素组成的化合物中肯定不存在离子键 |
| B.所有物质中都存在化学键 |
| C.已知乙炔的结构式为H—C≡C—H,则1个乙炔分子中存在2个σ键(C—H)和3个π键(C≡C) |
| D.乙烷分子中只存在σ键,即C—H键和C—C键都为σ键,不存在π键 |
您最近一年使用:0次
2019-04-22更新
|
87次组卷
|
6卷引用:云南省景谷一中2018-2019学年高二下学期第一次月考化学试题
名校
10 . 下列有关σ键和π键的说法正确的是
| A.单键既有σ键也有π键 | B.所有的π键都容易打开 |
| C.σ键可沿键轴自由旋转而不影响键的强度 | D.π键比σ键重叠程度大,形成的共价键强 |
您最近一年使用:0次
2019-04-22更新
|
149次组卷
|
5卷引用:云南省景谷一中2018-2019学年高二下学期第一次月考化学试题



