解题方法
1 . 硼及其化合物在耐高温合金工业、催化剂制造、高能燃料等方面有广泛应用。
(1)硼原子的价电子排布图为____________ 。
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为________ 。
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B__________ N(填“>”“<”或“=”,下同)。H2N―→BH2中B原子的杂化类型为________ 。
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是________ ;写出制备反应的化学方程式:____________ 。
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。

①磷化硼晶体属于______________ 晶体(填晶体类型),____________ (填“是”或“否”)含有配位键。
②晶体中P原子的配位数为____________ 。
③已知BP的晶胞边长为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度为____________ g·cm-3(用含a、NA的式子表示)。
(1)硼原子的价电子排布图为
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造。由第二周期元素组成的与BCl3互为等电子体的阴离子为
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型储氢材料。
①B与N的第一电离能:B
②Ti(BH4)3由TiCl3和LiBH4反应制得。BH4-的立体构型是
(4)磷化硼(BP)是受到高度关注的耐磨材料,它可用作金属表面的保护层。如图为磷化硼晶胞。

①磷化硼晶体属于
②晶体中P原子的配位数为
③已知BP的晶胞边长为a nm,NA为阿伏加 德罗常数的数值,则磷化硼晶体的密度为
您最近一年使用:0次
名校
解题方法
2 . 氰气的化学式为 ,结构式为
,结构式为 ,性质与卤素相似,下列有关叙述正确的是()
,性质与卤素相似,下列有关叙述正确的是()
 ,结构式为
,结构式为 ,性质与卤素相似,下列有关叙述正确的是()
,性质与卤素相似,下列有关叙述正确的是()| A.氰气分子中既有极性键,又有非极性键 |
B.氰气分子中 键的键长大于 键的键长大于 键的键长 键的键长 |
C.氰气分子中含有2个 键和4个 键和4个 键 键 |
| D.氰气不能和氢氧化钠溶液发生反应 |
您最近一年使用:0次
2020-04-10更新
|
135次组卷
|
6卷引用:云南省河口县一中2018-2019学年高二上学期期中考试化学试题
云南省河口县一中2018-2019学年高二上学期期中考试化学试题第2章 化学键与分子间作用力——易错疑难集训(一)——A学习区 夯实基础(鲁科版选修3)山东省泰安市肥城市泰西中学2019-2020学年高二下学期5月月考化学试题(已下线)2.1 共价键模型-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)四川省安岳县兴隆中学高2021-2022学年 高二上学期10月月考化学试题 广东省佛山市三水区华侨中学2023-2024学年高二下学期第一次月考化学试卷
10-11高二下·山西吕梁·阶段练习
名校
3 . 下列各组分子中,属于含有非极性键的非极性分子的是
A.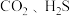 | B.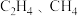 |
C.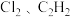 | D. |
您最近一年使用:0次
2020-04-10更新
|
127次组卷
|
18卷引用:云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题
云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题云南省昭通市绥江县二中2019-2020学年高二上学期期末考试化学试题(已下线)2010—2011学年山西省汾阳中学高二3月月考化学试卷(已下线)2010-2011学年湖北省武汉市三角路中学高二下学期期中考试化学试卷(已下线)2011-2012学年河北省邢台一中高二下学期第四次月考化学试卷(已下线)2013届山西省山西大学附属中学高三10月月考化学试卷(已下线)2012-2013学年湖北省荆州市监利县柘木中学高二下第二次月考化学卷(已下线)2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷2016-2017学年河北省张家口一中高二12月月考化学卷2016-2017学年福建省三明市第一中学高二下学期第一次月考化学试卷人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质吉林省长春汽车经济开发区第三中学2018-2019学年高二下学期4月月考化学试题吉林省汪清县第六中学2018-2019学年高二下学期期中考试化学试题黑龙江省哈尔滨市阿城区第二中学2018-2019学年高二下学期期中考试化学试题课时3 分子的空间构型与分子性质——A学习区 夯实基础(鲁科版选修3)辽宁省阜新市第二高级中学2019-2020学年高二下学期期末考试化学试题江苏省东台中学2018-2019学年高二上学期期末考试化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构
名校
4 . Ⅱ组命题正确且能用I组命题加以解释的是( )
| 选项 | I组 | Ⅱ组 |
| A |  键的键能大于 键的键能大于 键的键能 键的键能 |  比 比 稳定 稳定 |
| B |  键的键能小于 键的键能小于 键的键能 键的键能 |  比 比 稳定 稳定 |
| C |  分子间的范德华力大于 分子间的范德华力大于 分子间的范德华力 分子间的范德华力 |  的沸点比 的沸点比 高 高 |
| D |  分子间的范德华力小于 分子间的范德华力小于 分子间的范德华力 分子间的范德华力 |  的沸点比 的沸点比 低 低 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-04-10更新
|
133次组卷
|
2卷引用:第2章 化学键与分子间作用力——C挑战区模拟高考(鲁科版选修3)
2010·上海嘉定·二模
名校
5 . 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均已单键结合,下列关于晶体说法正确的是
| A.C3N4晶体是分子晶体 |
| B.C3N4晶体中,C-N键的键长比金刚石中C-C键的键长要长 |
| C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 |
| D.C3N4晶体中微粒间通过离子键结合 |
您最近一年使用:0次
2020-03-23更新
|
191次组卷
|
20卷引用:云南省楚雄州南华县民族中学2018-2019学年高二上学期期中考试化学试题
云南省楚雄州南华县民族中学2018-2019学年高二上学期期中考试化学试题云南省景东一中2018-2019学年高二下学期开学考试化学试题云南省新平县三中2019-2020学年高二上学期期中考试化学试题云南省开远市第二中学校2019-2020学年高二上学期期末考试化学试题(已下线)上海市嘉定、黄浦区2010届高三第二次模拟考试化学试题(已下线)2012届浙江省杭州高中高三第二次月考化学试卷(已下线)2012届浙江省杭西高中高三上学期11月月考试卷(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷(已下线)2012-2013年湖北省仙桃市毛嘴高中高二上学期学业水平监测试化学卷2015-2016学年贵州省思南中学高二下第二次月考化学试卷2015-2016学年四川省南充高中高二下期末化学试卷2017届上海师范大学第二附属中学高三上学期期中考试化学试卷陕西省黄陵中学高新部2017-2018学年高二6月月考化学试题贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题鲁科版高二化学物质结构与性质单元练习卷:第3章 物态的聚集状态与物质性质四川省南充市阆中中学2020届高三化学《晶体类型与性质》专题练习上海市曹杨二中2016-2017学年高二下学期第一次考试化学(等级考)试题四川省棠湖中学2019-2020学年高二下学期期中考试化学试题四川省阿坝州九寨沟2019-2020学年高二上学期期末考试化学试题陕西省宝鸡市金台区2020-2021学年高二下学期期末考试化学试题
12-13高二下·上海·阶段练习
名校
6 . 如下图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是( )


| A.该有机物可能的分子式为C2HCl3 |
B.该有机物的分子中一定有 |
| C.该有机物分子中的所有原子在同一平面上 |
| D.该有机物可以由乙烯和氯化氢加成反应得到 |
您最近一年使用:0次
2020-03-18更新
|
1022次组卷
|
14卷引用:云南省广南县第三中学2019-2020学年高二上学期开学考试化学试题
云南省广南县第三中学2019-2020学年高二上学期开学考试化学试题(已下线)2012-2013学年上海市七校高二5月阶段检测化学试卷(已下线)2012-2013学年河南唐河县第一高级中学高一下学期第三次月考化学卷2015-2016学年广东省佛山一中高一下期中化学试卷7.2 乙烯与有机高分子材料——2020年春高一新人教版第二册化学一课一练上海市金山中学2015-2016学年高二下学期阶段考试化学试题(已下线)专题08 乙烯与有机高分子材料(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)2020年春高一化学新人教版第二册课后同步:7.2 乙烯与有机高分子材料吉林省辽源市田家炳高级中学2019-2020学年高一下学期第三次月考化学试题河北省石家庄市2019-2020学年高一下学期期末考试化学试题高一必修第二册(人教2019版)第七章 第二节 乙烯与有机高分子材料 课时1 乙烯山东省济南市山东师范大学附属中学2019-2020学年高一下学期5月学业水平检测化学试题(已下线)7.2.1 乙烯(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)江西省南昌县莲塘第一中学2021-2022学年高一下学期4月期中线上质量检测化学试题
11-12高一下·湖南湘潭·期中
名校
7 . 下列分子中所有原子均满足最外层8电子结构的是( )
| A.LiCl | B.BF3 | C.PCl5 | D.NCl3 |
您最近一年使用:0次
2020-03-17更新
|
121次组卷
|
7卷引用:2011-2012年湖南湘潭等四县一中高一下学期期中联考化学试卷
9-10高一下·河北衡水·期中
名校
解题方法
8 . 下列分子中含有的电子数目与HF相同,且只有两个极性共价键的是( )
| A.CO2 | B.N2O | C.H2O | D.CH4 |
您最近一年使用:0次
2020-03-13更新
|
302次组卷
|
16卷引用:云南省普洱市景东县第一中学2019—2020学年高一下学期月考化学试题
云南省普洱市景东县第一中学2019—2020学年高一下学期月考化学试题(已下线)2009—2010学年河北冀州中学高一下学期期中考试化学卷(已下线)2010—2011学年江苏省姜堰市高一下学期期中考试化学试卷(已下线)2010-2011学年江西省南昌二中高一下学期期中考试化学试卷(已下线)2012年苏教版高中化学选修3 3.3共价键 原子晶体练习卷2015-2016学年福建省晋江平山中学高二上学期期中(理)化学试卷湖南省长沙市明德中学2016-2017学年高一下学期期中考试化学试卷吉林省辽源五中2017-2018学年高一下学期第一次月考化学试题辽宁省辽阳县集美学校2018-2019学年高一下学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高一下学期期中考试化学试题2020年春季苏教版高中化学必修2专题一《微观结构与物质的多样性》测试卷广西武宣县第二中学2019-2020学年高一上学期期末考试化学试题福建省南安市侨光中学2019-2020学年高二下学期第一次阶段考化学试题山西省运城市新绛县第二中学2019-2020学年高一下学期3月月考化学试题新疆喀什地区巴楚县第一中学2020-2021学年高二上学期期中考试化学试题福建省莆田砺志学校2021-2022学年高二下学期期中检测化学试题
名校
解题方法
9 . 硼(B)及其化合物在化学中具有十分重要的地位,请回答下列有关问题。
(1)基态硼原子中有_______ 种能量不同的电子,第一电离能介于B和N之间的第二周期元素有_______ 种。
(2)硼酸( )能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
)能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。

①硼酸晶体内所含有作用力类型有__________________ ,根据硼酸的分子结构判断硼酸应属于________ (填“强酸”“中强酸”或“弱酸”),你的判断依据是_________________________ 。
②三氟化硼( )水解生成硼酸和氟硼酸(
)水解生成硼酸和氟硼酸( ),与
),与 互为等电子体的一种阴离子是
互为等电子体的一种阴离子是_________ (写化学式)。
(3)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内B—N核间距为acm,层间距为 ,晶体密度为
,晶体密度为 ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为___________ ,其结构与石墨相似却不导电,原因是___________________ ,网状加德罗常数
________ 。(用含 的式子表示)。
的式子表示)。

(1)基态硼原子中有
(2)硼酸(
 )能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
)能够屏蔽核辐射,其晶体具有层状结构(每一层结构如图所示),成片状,有滑腻感,可作润滑剂。
①硼酸晶体内所含有作用力类型有
②三氟化硼(
 )水解生成硼酸和氟硼酸(
)水解生成硼酸和氟硼酸( ),与
),与 互为等电子体的一种阴离子是
互为等电子体的一种阴离子是(3)六方氮化硼的结构与石墨结构相类似(如图甲),上、下层平行,B、N原子相互交替,层内B—N核间距为acm,层间距为
 ,晶体密度为
,晶体密度为 ,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
,晶胞如图乙所示。六方氮化硼晶体中硼原子的杂化类型为
 的式子表示)。
的式子表示)。
您最近一年使用:0次
解题方法
10 . 形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]__ ,基态Ga原子核外电子占据最高能级的电子云轮廓图为___ 。
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为___ 。乙炔钠中存在___ (填字母)。
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为____ 。写出和该阴离子互为等电子体的一种分子的结构式___ 。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是____ 。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是___ 。
(6)某离子晶体的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有___ 个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加 德罗常数为NA,则晶体中两个最近的X间的距离为___ cm。
(1)基态Ga原子的核外电子排布式是[Ar]
(2)HC≡CNa(乙炔钠)广泛用于有机合成,乙炔钠中C原子的杂化类型为
A.金属键 B.σ键 C.π键 D.氢键 E.配位键 F.离子键 G.范德华力
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是
(6)某离子晶体的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加 德罗常数为NA,则晶体中两个最近的X间的距离为
您最近一年使用:0次
2020-03-03更新
|
283次组卷
|
3卷引用:湖北省襄阳市优质高中2020届高三联考理科综合化学试题



