解题方法
1 . 一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为__________ 。
②NO3-的空间构型是____________________________________________ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为________ 。
②1 mol CO2中含有的σ键数目为____________ 。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______________ 。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为
②NO3-的空间构型是
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为
②1 mol CO2中含有的σ键数目为
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
您最近一年使用:0次
名校
解题方法
2 . 碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________ (填元素符号),该元素基态原子最外层电子的自旋状态___________ (填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________ 。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
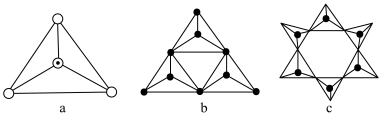
硅氧四面体中Si的轨道杂化类型为____________ ; 图b环状结构硅酸根的化学式为______________ 若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________ 。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________ ,其晶格能可通过下图的Borm-Haber循环计算得到。
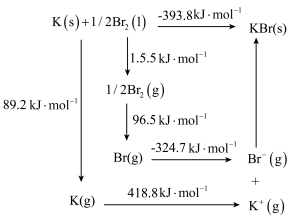
从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______ kJ/ mol,KBr的晶格能为______ kJ/mol,晶格能越大,该晶体的熔点越______ 。
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是
(2)碳和硅的有关化学键键能如下所示:
| 化学键 | C-H | C-O | Si-H | Si-O |
| 键能/kJ▪mol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。

硅氧四面体中Si的轨道杂化类型为
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为

从上图可知,K原子的第一电离能为
您最近一年使用:0次
2019-12-06更新
|
256次组卷
|
3卷引用:云南省昆明市第一中学2019-2020高三第三次双基检测化学试题
3 . 价电子总数与原子总数都相同的分子、离子或原子团称为等电子体,等电子体具有相似的结构和性质。下列选项中互称为等电子体的是( )
| A.CO2和 NO2 | B.N2和 O2 |
| C.CO32-和SO32- | D.SO2和 O3 |
您最近一年使用:0次
2019-11-29更新
|
88次组卷
|
2卷引用:云南省玉溪市江川二中2019-2020学年高二上学期期中考试化学试题
名校
解题方法
4 . 卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______ 。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________ (填元素符号)。
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________ 。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________ 。
(3)ClO2-中心氯原子的杂化轨道类型为________ ,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________ (写出一个即可)。
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________ 个碘原子,碘晶体中碘分子的配位数为____________ 。


(5)已知NA为阿伏加 德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________ 。
(1)溴原子的价层电子排布图为
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是
(3)ClO2-中心氯原子的杂化轨道类型为
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有


(5)已知NA为阿伏加 德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为
您最近一年使用:0次
2019-11-22更新
|
210次组卷
|
3卷引用:云南省楚雄市紫溪中学2019-2020学年高三上学期期末考试理综化学试题
名校
5 . 分子中存在π 键,且碳原子全部以sp杂化轨道成键的是( )
| A.CH3CH3 | B.CH2=CH2 | C.CH≡CH | D.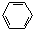 |
您最近一年使用:0次
2019-09-24更新
|
295次组卷
|
3卷引用:云南省楚雄州南华县第一中学2019-2020学年高二9月考试化学试题
解题方法
6 . 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金(含铁)空心球为吸收剂的太阳能吸热涂层,铁、镍基态原子未成对电子数各为_____________ 、________________ 。
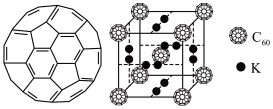
(2)C60可用作储氢材料,已知金刚石中的C-C键的键长为0.154 nm,C60中C-C键键长为0.140~0.145 nm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?_________ ,阐述理由:________________________________________________________________________ 。C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有_____ 个。
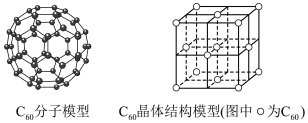
(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如下图所示,分子中碳原子轨道的杂化类型为_________ ;1 mol C60分子中σ键的数目为________ 。科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为________ 。
(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______________ 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______ 个。
(5)请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:________________________________________________________________________ 。
(1)太阳能热水器中常使用一种以镍或镍合金(含铁)空心球为吸收剂的太阳能吸热涂层,铁、镍基态原子未成对电子数各为
(2)C60可用作储氢材料,已知金刚石中的C-C键的键长为0.154 nm,C60中C-C键键长为0.140~0.145 nm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?

(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如下图所示,分子中碳原子轨道的杂化类型为

(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是
(5)请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:
您最近一年使用:0次
2019-09-19更新
|
145次组卷
|
2卷引用:云南省弥勒市第四中学2020届高三上学期开学考试化学试题
名校
7 . 下列说法不正确的是
| A.沸点:H2O>HF | B.热稳定性:HF>H2O |
| C.NCl3、SiCl4分子中每个原子最外层均满足8电子结构 | D.仅由N、H、O三种元素形成的化合物中不可能含离子键 |
您最近一年使用:0次
2019-09-17更新
|
643次组卷
|
18卷引用:云南省丘北二中2018-2019学年高一下学期6月份月考化学试题
云南省丘北二中2018-2019学年高一下学期6月份月考化学试题云南省文山州马关县二中2019-2020学年高二上学期9月份考试化学试题浙江省金华十校2017~2018学年第一学期期末调研考试高一化学试题河北省邢台市第二中学2017-2018学年高一下学期第一次月考化学试题黑龙江省哈尔滨市第六中学2017-2018学年高一4月月考化学试题陕西省黄陵中学高新部2018-2019学年高一下学期期末考试化学试题安徽省颍上县实验中学2019-2020学年高二上学期开学考试化学试题福建省漳州市第一中学2019-2020学年高一3月在线测试(实验班)化学试题湖北省武汉市第三十九中学2019-2020学年高一下学期线上期中考试化学试题沪科版化学拓展性课程1《原子结构与元素周期律》测试题四川省眉山市仁寿第二中学、华兴中学2019-2020学年高一下学期5月联考(期中)化学试题广东省江门市第二中学2019-2020学年高一下学期第二次考试(期中)化学试题吉林省长春市实验中学2019-2020高二下学期期中考试化学试题江苏省宜兴一中2020-2021学年高一上学期第二次阶段性考试化学试题云南省马关县第一中学2021-2022学年高二下学期2月份考试化学试题贵州省毕节市金沙县第一中学2020-2021学年高一下学期第一次月考化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题四川省华蓥中学2020-2021学年高一下学期5月月考化学考试题
8 . 下列说法不正确的是( )
| A.非金属单质氯气、白磷、金刚石等都含有非极性键 |
| B.化合物氯化氢、硫酸、甲烷中都含有极性键 |
| C.氧化物二氧化碳、三氧化硫、过氧化钠中都含有共价键 |
| D.离子化合物中一定不含有共价键 |
您最近一年使用:0次
名校
9 . A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为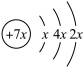 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A________ ,B________ ,C________ ,D________ 。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________ ,碱性最强的是__________ 。
(3)用元素符号表示D所在周期第一电离能最大的元素是________ ,电负性(除稀有气体外)最大的元素是_________ 。
(4)E元素原子的核电荷数是_________ ,E元素在周期表的第_______ 周期第_______ 族,在________ 区。
(5)写出D元素原子构成单质的电子式___________ ,该分子中有_______ 个σ键,_______ 个π键。
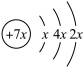 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期第一电离能最大的元素是
(4)E元素原子的核电荷数是
(5)写出D元素原子构成单质的电子式
您最近一年使用:0次
2019-08-13更新
|
210次组卷
|
8卷引用:云南省曲靖市沾益二中2017-2018学年高二下学期期末考试化学试题
名校
10 . 已知原子数和价电子数相同的离子或分子结构相似,如SO3、NO都是平面三角形。那么下列分子或离子中与SO42-有相似结构的是( )
| A.PCl5 | B.CCl4 | C.NF3 | D.N |
您最近一年使用:0次
2019-07-22更新
|
189次组卷
|
5卷引用:云南省丘北二中2018-2019学年高二下学期期末考试化学试题



