1 . 亚铁氰化钾(K4[Fe(CN)6])是重要的化工原料和食品添加剂,又称黄血盐。黄血盐溶液与稀硫酸加热时发生反应:K4[Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
(1)写出基态Fe2+的核外电子排布式______ 。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______ 和______ 。:1mol K4[Fe(CN)6]中含有σ键的数目为_____ NA。
(3)(NH4)2SO4中N原子的杂化方式为______ ;N和O相比,第一电离能更大的是______ ,电负性更大的是______ 。
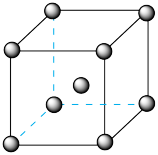
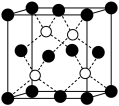
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为______ ,钠、钾相比,熔点更高的是______ ,原因是______ 。已知铁的原子半径为r cm,阿伏加 德罗常数为NA,铁的相对原子质量为a,则铁的密度为______ g·cm-3。
 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑。回答下列问题:(1)写出基态Fe2+的核外电子排布式
(2)K4[Fe(CN)6]中的作用力除共价键外,还有
(3)(NH4)2SO4中N原子的杂化方式为
(4)铁、钾、钠均采用体心立方堆积,结构如图。晶胞中金属原子的配位数为

您最近一年使用:0次
12-13高二下·吉林延边·期中
名校
解题方法
2 . H2O分子中每个O原子结合2个H原子的根本原因是( )
| A.共价键的方向性 | B.共价键的饱和性 |
| C.共价键的键角 | D.共价键的键长 |
您最近一年使用:0次
2020-09-02更新
|
696次组卷
|
16卷引用:云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题
云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题云南省大关县一中2018-2019学年高二上学期12月考试化学试题云南省玉溪市江川二中2018-2019学年高二下学期开学考试化学试题(已下线)2012-2013学年吉林省汪清六中高二下学期期中考试化学试卷(已下线)2012-2013学年湖北省孝感高级中学高二上学期期末考试化学试卷福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题福建省厦门市湖滨中学2018-2019学年高二(理)上学期期中考试化学试题贵州省毕节市黔西县第一中学2018-2019学年高二上学期12月份考试化学试题广西壮族自治区蒙山县第一中学2019-2020学年高二下学期期末考试化学试题广西蒙山一中2018-2019学年高二下学期期末考试化学试题2020届高三化学二轮物质结构题型专攻——共价键对分子构型、性质的影响【选择基础专练】2020届高三化学二轮物质结构题型专攻——分子结构与性质【选择基础专练】宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期中考试化学试题江苏省盐城市东台市创新学校2020-2021学年高二上学期9月份月检测化学试题(选修)四川省广安代市中学校2020-2021学年高二下学期第一次月考化学试题广东省惠州市博罗县博师高级中学2022-2023学年高二下学期3月考试化学试题
19-20高一·全国·课时练习
名校
3 . 下列事实与氢键有关的是( )
| A.HF、HCl、HBr、HI的热稳定性依次减弱 |
| B.水加热到很高的温度都难以分解 |
| C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 |
| D.氨气在水中的溶解度很大 |
您最近一年使用:0次
2020-08-14更新
|
78次组卷
|
3卷引用:5.2.2 共价键 分子间作用力练习(1)——《高中新教材同步备课》(苏教版 必修第一册)
(已下线)5.2.2 共价键 分子间作用力练习(1)——《高中新教材同步备课》(苏教版 必修第一册)云南省玉溪市民族中学2021-2022学年高一上学期期末考试化学试题安徽省合肥市第一中学2022-2023 学年高一下学期第三次素质拓展训练化学试题
名校
解题方法
4 . 目前我国研制的稀土催化剂催化转化汽车尾气示意图如图:

(1)Zr原子序数为40,价电子排布式为___ 。图1中属于非极性的气体分子是___ 。
(2)①氟化硼(BF3)是石油化工的重要催化剂。BF3中B-F比BF 中B—F的键长短,原因是
中B—F的键长短,原因是___ 。
②乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。

B2H6的分子结构如图2所示,其中B原子的杂化方式为___ 。
③H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是__ 。
④硼酸盐是重要的防火材料。图3是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有__ 。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
(3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,[Ni(CO)4]的配体中配位原子是___ 。
(4)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图4所示,则与每个Sr2+紧邻的O2-有___ 个。
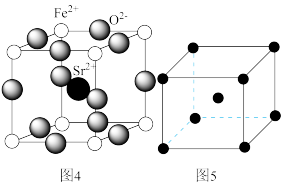
(5)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格(如图5所示),原子半径为apm,相对原子质量为b,阿伏加 德罗常数为NA,试计算晶体铌的密度为___ g·cm-3(用来a、b、NA表示计算结果)。

(1)Zr原子序数为40,价电子排布式为
(2)①氟化硼(BF3)是石油化工的重要催化剂。BF3中B-F比BF
 中B—F的键长短,原因是
中B—F的键长短,原因是②乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。

B2H6的分子结构如图2所示,其中B原子的杂化方式为
③H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是
④硼酸盐是重要的防火材料。图3是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
(3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,[Ni(CO)4]的配体中配位原子是
(4)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图4所示,则与每个Sr2+紧邻的O2-有

(5)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格(如图5所示),原子半径为apm,相对原子质量为b,阿伏加 德罗常数为NA,试计算晶体铌的密度为
您最近一年使用:0次
2020-07-02更新
|
290次组卷
|
2卷引用:山东师范大学附属中学2020届普通高等学校招生全国统一考试化学试题(模拟一)
5 . 自然界中存在大量的元素,如钠、镁、铝、铁、铜、砷、锌、镍等在生活中有着广泛的应用。
(1)请写出Fe的基态原子核外电子排布式________ ,砷属于________ 区元素。
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
则A原子的价电子排布式为___________________________ 。
(3)锌化铜是一种金属互化物,其化学式有多种形式,如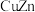 ,
,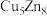 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能________ (填“大于”“小于”或“等于”)锌的第二电离能。
(4)用锌还原 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是________ ,与Ti形成配位键的配体是________ , 该配合物中含有
该配合物中含有 键的数目为
键的数目为________ 。
(5) 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为:________ ;与 互为等电子体的分子有:
互为等电子体的分子有:___________________ (填分子式)。
(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=________  (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
(1)请写出Fe的基态原子核外电子排布式
(2)金属A的原子只有3个电子层,其第一至第四电离能如下:
电离能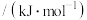 |  |  | 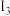 | 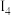 |
| A | 932 | 1821 | 15390 | 21771 |
则A原子的价电子排布式为
(3)锌化铜是一种金属互化物,其化学式有多种形式,如
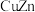 ,
,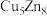 ,
, 等。其中所含元素铜的第二电离能
等。其中所含元素铜的第二电离能(4)用锌还原
 的盐酸溶液,经后续处理可制得绿色的晶体
的盐酸溶液,经后续处理可制得绿色的晶体 。该晶体所含元素中,电负性最大的元素是
。该晶体所含元素中,电负性最大的元素是 该配合物中含有
该配合物中含有 键的数目为
键的数目为(5)
 能形成多种配离子,如
能形成多种配离子,如 ,
, 等。
等。 的空间构型为:
的空间构型为: 互为等电子体的分子有:
互为等电子体的分子有:(6)铜的化合物种类很多,如图是氯化亚铜的晶胞结构(黑色球表示
 ,白色球表示
,白色球表示 ),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ=
),已知晶胞的棱长为acm,则氯化亚铜密度的计算式为ρ= (用
(用 表示阿伏加 德罗常数)
表示阿伏加 德罗常数)
您最近一年使用:0次
12-13高二上·四川自贡·阶段练习
名校
解题方法
6 . 下列说法中正确的是( )
| A.NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 |
| B.P4和CH4都是正四面体型分子且键角都为109.5° |
C.NH4+的电子式为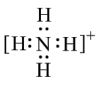 ,离子呈平面正方形结构 ,离子呈平面正方形结构 |
| D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
您最近一年使用:0次
2020-06-05更新
|
1321次组卷
|
22卷引用:云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题
云南省昭通水田新区中学2018-2019学年高二上学期12月月考化学试题(已下线)2014届四川省富顺一中高二上学期第一次月考化学试卷2014-2015山西省太原市五中高二4月阶段形成检测化学试卷河南省兰考县第二高级中学2016-2017学年高二下学期期末考试化学试题四川省德阳市第五中学2018-2019学年高二上学期10月月考化学试题贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题贵州省黄平县且兰高级中学2018-2019学年高二上学期12月份考试化学试题吉林省公主岭市范家屯镇第一中学2018-2019学年高二下学期期中考试化学试题贵州省岑巩县第四中学2019-2020学年高二上学期期末考试化学试题山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题河北省正定中学2019-2020学年高二3月线上月考化学试题辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题山西省太原市阳曲县第一中学2019-2020学年高二5月复学检测化学试题新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练湖北省武汉市江夏实验高中2020-2021学年高二下学期3月月考化学试题甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题湖北省华中师范大学第一附属中学2020-2021学年高一下学期期末考试化学试题湖南省邵阳市第二中学2021-2022学年高二下学期入学考试化学试题山西省临汾市尧都区山西师范大学实验中学2021-2022学年高二下学期第一次月考化学考试试题
名校
7 . 下列分子或离子中键角由大到小的排列顺序是( )
①SO2 ②NH3 ③H2O ④CH4 ⑤CO2
①SO2 ②NH3 ③H2O ④CH4 ⑤CO2
| A.⑤④①②③ | B.⑤①④②③ | C.④①②⑤③ | D.③②④①⑤ |
您最近一年使用:0次
2020-06-05更新
|
81次组卷
|
3卷引用:新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题
新疆昌吉回族自治州第二中学2019-2020学年高二下学期期中考试化学试题(已下线)练习19 共价键-2020-2021学年【补习教材·寒假作业】高二化学(人教版)云南省丘北县第一中学2021-2022学年高二下学期3月份考试 化学试题
名校
解题方法
8 . 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4O10,下列有关P4S3的说法中不正确的是( )


| A.P4S3属于共价化合物 |
| B.1mol P4S3分子中含有9mol共价键 |
C.P4S3充分燃烧的化学方程式为P4S3+8O2 P4O10+3SO2 P4O10+3SO2 |
| D.P4S3中磷元素为+3价 |
您最近一年使用:0次
2020-05-28更新
|
350次组卷
|
17卷引用:陕西省西安中学2016-2017学年高一(实验班)下学期期中考试化学试题
陕西省西安中学2016-2017学年高一(实验班)下学期期中考试化学试题【全国百强校】黑龙江省鹤岗市第一中学2019届高三上学期第一次月考化学试题吉林省白城市通榆县第一中学2018-2019学年高一下学期第一次月考化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期第二次月考化学试题福建省泉州第十六中学、惠南中学2018-2019学年高二下学期期末化学试题湖北省荆州中学2018-2019学年高一下学期5月月考化学试题人教版高一化学必修2同步练习:第一章第三节《化学键》辽宁省瓦房店市实验高级中学2018-2019学年高一下学期月考化学试题安徽省安庆市怀宁县第二中学2019届高三上学期第四次月考化学试题辽宁省抚顺市第一中学2019-2020高二下学期期中考试化学试题山西省太原市山西大学附属中学2019-2020学年高一5月模块诊断化学试题湖北省武汉市蔡甸区汉阳一中2019-2020学年高一下学期3月月考化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期期中考试化学(理)试题(已下线)考点06 原子结构 化学键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)宁夏吴忠中学2021-2022学年高一下学期期中考试化学试题河北省石家庄市新乐市第一中学2023-2024学年高三上学期开学测试化学试题
名校
9 . 当两种物质的原子总数相同且各原子最外层电子数之和也相同时,它们具有相似的结构特征。下列各组粒子不符合上述结构特征的是
| A.N2H4和C2H4 | B.O3和SO2 | C.CO2和N2O | D.CO和N2 |
您最近一年使用:0次
2020-04-29更新
|
140次组卷
|
6卷引用:河北省承德市隆化县存瑞中学2019--2020学年高一下学期期中考试化学试题
河北省承德市隆化县存瑞中学2019--2020学年高一下学期期中考试化学试题河北省邢台市2019-2020学年高一下学期期中考试化学试题河北省保定市2020-2021学年高一上学期期中考试化学试题河北定兴县固城二中2020-2021学年高一上学期12月测试化学试题云南省玉溪师范学院附属中学2022-2023学年高一下学期期末考试化学试题(已下线)4.1.2 原子核外电子排布规律-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
11-12高二下·湖北武汉·期末
名校
解题方法
10 . 下列说法中正确的是
A.乙烯中 的键能是乙烷中 的键能是乙烷中 的键能的2倍 的键能的2倍 |
B.氮气分子中含有1个 键和2个π键 键和2个π键 |
C. 键的极性比 键的极性比 键的极性大 键的极性大 |
D. 中4个 中4个 键的键能不相同 键的键能不相同 |
您最近一年使用:0次
2020-04-28更新
|
307次组卷
|
12卷引用:云南省盐津县三中2018-2019学年高二第一学期12月份考试化学试题
云南省盐津县三中2018-2019学年高二第一学期12月份考试化学试题云南省普洱市澜沧县民族中学2018-2019学年高二下学期期末考试化学试题(已下线)2011-2012学年湖北武汉部分重点学校高二下学期期末统考化学卷2016-2017学年宁夏银川市第二中学高二下学期第一次月考化学试卷贵州省息烽县一中2018-2019学年高二上学期期中考试化学试题2020届高三化学二轮物质结构题型专攻——分子结构与性质【选择基础专练】吉林省辽源市田家炳高级中学等友好学校2019-2020学年高二下学期期末考试化学试题天津市河西区2020芦台一中高三模拟测试(已下线)模块同步卷04 共价键-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)天津市南开中学2021届高三上学期第五次月考化学试卷福建省永安市第三中学2020-2021学年高二3月月考化学试题新疆克孜勒苏柯尔克孜自治州阿克陶县2022-2023学年高二上学期11月期中考试化学试题



