11-12高二下·黑龙江·期末
名校
1 . 根据等电子原理判断,下列说法中错误的是
A. 分子中所有原子均在同一平面上 分子中所有原子均在同一平面上 |
B. 分子中存在双键,可发生加成反应 分子中存在双键,可发生加成反应 |
C. 和 和 互为等电子体,均为三角锥形 互为等电子体,均为三角锥形 |
D. 和 和 互为等电子体,均为正四面体形 互为等电子体,均为正四面体形 |
您最近一年使用:0次
2021-02-07更新
|
581次组卷
|
25卷引用:云南省丘北县第二中学2018-2019学年高二下学期6月份考试化学试题
云南省丘北县第二中学2018-2019学年高二下学期6月份考试化学试题(已下线)2011-2012年黑龙江龙东地区高二下学期期末考试化学试卷2015-2016学年山西省忻州一中高二下期中化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷辽宁省瓦房店市高级中学2016-2017学年高二下学期期末考试化学试题人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质【全国百强校】福建省莆田第一中学2017-2018学年高二下学期期中考试化学试题贵州省安顺市普定县第一中学2018-2019学年高二上学期12月考试化学试题(已下线)专题11.2 分子结构与性质(讲)-《2020年高考一轮复习讲练测》贵州省施秉县一中2019-2020学年高二上学期期末考试化学试题江苏省徐州市第一中学2019-2020学年高二下学期第三次在线检测化学试题安徽省安庆市太湖县太湖中学2019-2020学年高二下学期3月线上考试化学试题陕西省西安中学2019-2020学年高二下学期期末考试化学试题四川省乐山沫若中学2020-2021学年高二上学期第一次月考化学试题(已下线)第36讲 分子结构与性质(精讲)-2021年高考化学一轮复习讲练测甘肃省天水市秦安县第一中学2020-2021学年高二上学期期末考试化学试题鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2章学科素养提升(已下线)专题18 物质结构与性质-备战2021届高考化学二轮复习题型专练吉林省吉化第一高级中学校2020-2021学年高二下学期3月月考化学试题山西省怀仁市大地学校2020-2021学年高二下学期第三次月考化学试题(已下线)考点34 分子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)新疆柯坪县柯坪湖州国庆中学2021-2022学年高三上学期第一次月考化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第30讲 分子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
2 . 下列说法中正确的是
| A.分子中所含共价键键能越大,键长越短,则分子越稳定 |
| B.只有非金属原子之间才能形成共价键 |
C.水分子可表示为 ,分子中键角为180° ,分子中键角为180° |
D. 键键能为 键键能为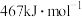 ,即 ,即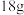 水分子生成 水分子生成 和 和 时,放出能量为 时,放出能量为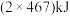 |
您最近一年使用:0次
2021-02-01更新
|
700次组卷
|
11卷引用:云南省广南二中2018-2019学年高二6月考试化学试题
云南省广南二中2018-2019学年高二6月考试化学试题贵州省毕节市黔西县第一中学2018-2019学年高二上学期12月份考试化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键 第2课时 共价键的键参数鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第1节 共价键模型 第2课时 共价键的键参数(已下线)2.1 共价键(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)2.1 共价键(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)广东省云浮市云安区云安中学2021-2022学年高二下学期第一次统测化学试题第一节 共价键 第2课时 键参数——键能、键长和键角(已下线)2.1 共价键-同步学习必备知识浙江省海盐高级中学2021-2022学年高二下学期开学测试化学试题
解题方法
3 . 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。已知铜的配合物A结构如图。请回答下列问题:

(1)基态二价铜离子的电子排布式为___ ,已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释___ 。
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是___ ;N2O与CO2互为等电子体,则N2O的电子式为___ 。
(3)铜与(SCN)2反应生成Cu(SCN)2,lmol(SCN)2中含有π键的数目为___ (用NA表示),HSCN结构有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N≡C≡S)的原因是___ 。
(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___ 。
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为___ 。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为361.5pm,立方氮化硼的密度是___ g·cm-3(只列算式,NA为阿伏加德罗常数的值)。

(1)基态二价铜离子的电子排布式为
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是
(3)铜与(SCN)2反应生成Cu(SCN)2,lmol(SCN)2中含有π键的数目为
(4)立方氮化硼如图与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为

您最近一年使用:0次
2021-01-07更新
|
457次组卷
|
2卷引用:云南省玉溪市普通高中2021届高三上学期第一次教学质量检测化学试题
10-11高一下·河北邢台·阶段练习
名校
解题方法
4 . 下列物质中,含有极性共价键的是
| A.单质碘 | B.氯化镁 | C.溴化钾 | D.水 |
您最近一年使用:0次
2021-01-02更新
|
1091次组卷
|
33卷引用:云南省玉龙纳西族自治县田家炳民族中学2019-2020学年高一下学期期中考试化学(文)试题
云南省玉龙纳西族自治县田家炳民族中学2019-2020学年高一下学期期中考试化学(文)试题(已下线)2010—2011学年河北省南宫中学高一3月月考化学试卷(已下线)2011-2012学年吉林长春外国语学校高一下学期3月月考文科化学试卷2015-2016学年贵州凯里一中高一下期中文科化学试卷2015-2016学年黑龙江省哈尔滨三十二中高一下学期期末化学试卷2016-2017学年广西南宁第一中学高一下学期期中模拟考试化学试卷【全国市级联考】辽宁省大连市2017-2018学年高一下学期期末考试(文)化学试题黑龙江省伊春市第二中学2017-2018学年高一下学期期末考试(文)化学试题西藏林芝二中2017-2018学年高一下学期期末考试化学试题【全国百强校】辽宁省实验中学2016-2017学年高一下学期期中考试文科反向理科综合化学试题河南省永城市实验高级中学2018-2019学年高一下学期期中考试化学试题黑龙江省绥滨县第一中学2018-2019学年高一(文)下学期期中考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高一下学期期中考试化学试题黑龙江省大庆市三校联考2018-2019学年高二下学期期末考试化学试题新疆自治区阿克苏地区沙雅县第二中学2018-2019学年高一下学期期中考试化学试题广东省广州市天河区华南师范大学附属中学2020届高三化学专题训练(10)河南省林州市林虑中学2019-2020学年高一下学期3月线上考试化学试题新疆吾尔自治区喀什巴楚县第一中学2019-2020学年高一下学期期末考试化学试题天津市南开区2020届高中学业水平合格性考试模拟试卷化学试题甘肃省武威市民勤县第一中学2019-2020学年高一下学期期末考试(文)化学试题浙江省台州市书生中学2020-2021学年高一上学期第三次月考化学试题(已下线)【浙江新东方】在线化学 (15)辽宁省朝阳育英高考补习学校2020-2021学年高一上学期期末考试化学试题人教2019版必修第一册第四章第三节 化学键课后习题甘肃省民乐县第一中学2021-2022学年高一下学期3月第一次月考化学试题天津市河东区普通高中2022年高二学业水平合格考试模拟化学试题黑龙江省哈尔滨市第三十二中学2021-2022学年高一上学期期末考试化学试题新疆叶城县第八中学2021-2022学年高一上学期期末考试化学试题河南省平顶山市蓝天高级中学2021-2022学年高一上学期期末考试化学试题吉林省乾安县第七中学2021-2022学年高一上学期期末考试化学试题青海省西宁市大通回族土族自治县2022-2023学年高一上学期期末考试化学试题甘肃省民勤县第一中学2022-2023学年度高一下学期期中考试(选考)化学试题吉林省吉林市普通高中2023-2024学年高一上学期期末调研测试化学试题
解题方法
5 . 下列微粒中,跟 的电子总数和质子总数都相同的是
的电子总数和质子总数都相同的是
 的电子总数和质子总数都相同的是
的电子总数和质子总数都相同的是| A.Ne | B.F- | C.CH4 | D.H3O+ |
您最近一年使用:0次
2020-12-23更新
|
283次组卷
|
2卷引用:上海市奉城高级中学2019-2020学年高一上学期期中考试化学试题
名校
解题方法
6 . 下列说法中正确的是
| A.P4和CH4都是正四面体形分子,且键角都为109°28’ |
| B.乙烯分子中,碳原子的sp2杂化轨道形成σ键,未杂化的2p轨道形成π键 |
| C.键长H-F < H-Cl < H-Br < H-I,因此稳定性HF < HCl < HBr < HI |
| D.PH3分子中孤电子对与成键电子对的排斥作用比成键电子对之间的排斥作用弱 |
您最近一年使用:0次
2020-12-14更新
|
3590次组卷
|
31卷引用:湖北省十一校2021届高三上学期第一次联考化学试题
湖北省十一校2021届高三上学期第一次联考化学试题云南省昆明市官渡区尚品书院学校2022-2023学年高二下学期3月月考化学试题云南省大理州实验中学2021-2022学年高二下学期化学期中考试题云南省文山州广南县第十中学校2023-2024学年高二下学期3月考试化学试题(已下线)第02章 微粒间相互作用与物质性质(B卷能力提升篇)-2020-2021学年高二化学同步单元AB卷(鲁科版2019选择性必修2)湖北省黄冈市麻城市实验高级中学2020-2021学年高二3月月考化学试题福建省龙岩市武平县第一中学2020-2021学年高二下学期化学月考试题(已下线)学科网2020年高三1月大联考考后强化卷(山东卷)(已下线)【一飞冲天】名家原创卷2内蒙古自治区赤峰市赤峰二中2020-2021学年高二下学期第二次月考化学试题吉林省延边第二中学2020-2021学年高二下学期第一次考试月考化学试题重庆市第七中学2021-2022学年高二下学期第一次月考化学试题四川省广安市第二中学2021-2022学年高二下学期第一次月考化学试题甘肃省高台县第一中学2021-2022学年高二下学期3月月考化学试题湖南省株洲市茶陵县第一中学2021-2022学年高二下学期期中考试化学试题广东省梅州市大埔县田家炳实验中学2021-2022学年高二下学期第二次段考(5月)化学试题江苏省泰州中学2021-2022学年高二下学期期初质量检测化学试卷河南省实验中学2021-2022学年高二下学期期中考试化学试题四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题新疆乌鲁木齐市第三十一中学2021-2022学年高二下学期期中考试化学试题(已下线)第37讲 分子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测湖南省攸县长鸿实验中学2022-2023学年高三第四次月考化学试题第二章 分子结构与性质(B卷·能力提升练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)广东省惠州市华罗庚中学2022-2023学年高二下学期3月月考化学试题河南省焦作市博爱县第一中学2022-2023学年高二下学期6月期末考试化学试题(已下线)化学键 分子结构及性质宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题四川省成都高新实验中学2023-2024学年高二下学期3月月考化学试卷辽宁省沈阳市东北育才学校2023-2024学年高二下学期4月月考化学试题广东省江门市广雅中学2023-2024学年高二下学期3月月考化学试题A卷
名校
解题方法
7 . 向含Fe2+的溶液中加入少量K3[Fe(CN)6]溶液,可生成蓝色沉淀(Turbull blue,滕氏蓝),这是鉴别Fe2+的灵敏反应。回答下列问题:
(1)基态Fe原子的电子排布式为__________________ 。
(2)K3[Fe(CN)6]中C原子的杂化方式为_______ ,C、N和同周期的O比较,第一电离能由小到大的顺序为________ , C、 N、O的最简单氢化物的沸点由低到高的顺序为________________ 。(用分子式表示)。
(3)写出两种与CN-互为等电子体的分子___________ 、____________ (填分子式)。
(4)经X射线衔射证明,滕氏蓝的立方晶胞结构由如图所示的8个小立方体构成,一个晶胞中有4个K+,占有4个互不相邻的小立方体的体心。滕氏蓝的化学式为[以最简整数比表示,其中铁用Fe(II)、Fe(III)表示]_______ , Fe3+的配位数为_________ 。

(5)若滕氏蓝晶体的密度为ρg∙cm-3,计算其晶胞参数a=_____ nm。(列出计算式,设NA为阿伏加德罗常数的值)。
(1)基态Fe原子的电子排布式为
(2)K3[Fe(CN)6]中C原子的杂化方式为
(3)写出两种与CN-互为等电子体的分子
(4)经X射线衔射证明,滕氏蓝的立方晶胞结构由如图所示的8个小立方体构成,一个晶胞中有4个K+,占有4个互不相邻的小立方体的体心。滕氏蓝的化学式为[以最简整数比表示,其中铁用Fe(II)、Fe(III)表示]

(5)若滕氏蓝晶体的密度为ρg∙cm-3,计算其晶胞参数a=
您最近一年使用:0次
解题方法
8 . 下列有关化学键类型的判断正确的是( )
| A.全部由非金属元素组成的化合物中肯定不存在离子键 |
| B.所有物质中都存在化学键 |
| C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C) |
| D.乙烷分子中只有σ键,即6个C—H键和1个C—C键都为σ键,不存在π键 |
您最近一年使用:0次
2020-11-05更新
|
328次组卷
|
3卷引用:四川省南充市川绵外国语学校2020-2021学年高二上学期学期中考试化学试题
四川省南充市川绵外国语学校2020-2021学年高二上学期学期中考试化学试题云南省富宁县第一中学校2021-2022学年高二下学期开学考试化学题(已下线)第2章 微粒间相互作用与物质性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)
名校
解题方法
9 . 钛和钛的化合物用途比较广泛。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有__ 种,基态钛原子的价电子排布式为__ ,该基态原子最外层的电子电子云轮廓图为__ 。
(2)C、O和Ti电负性由大到小的顺序为__ 。
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为__ 和___ (填化学式)。
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为__ 。从电负性角度分析,Fe(CO)5中与Fe形成配位键的是__ (填“碳”或“氧”)原子。
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___ 。H4SiO4中Si的轨道杂化类型为__ 。
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。
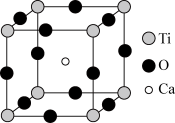
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__ 个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为___ g/cm3。
I.以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理如图所示。请根据该反应机理中所涉及的元素及其化合物,回答下列问题:

(1)氧原子核外电子的空间运动状态有
(2)C、O和Ti电负性由大到小的顺序为
(3)与CO分子互为等电子体的分子和离子各写出1种,分别为
(4)在一定条件下CO可与铁单质反应生成配位化合物——羰基铁Fe(CO)5,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为
(5)同主族化学性质相似,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是
II.钙钛矿晶体为高温超导领域里的一种化合物,其结构如图所示,该结构是具有代表性的最小重复单位。

(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为
您最近一年使用:0次
解题方法
10 . 氮及其化合物在工、农业生产中用途广泛。
(1)基态氮原子的核外电子排布式为__________ ;与N同周期的主族元素中,电负性大于N的有_______ 种。
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与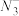 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:____________ ,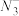 的空间构型为
的空间构型为_________ 。
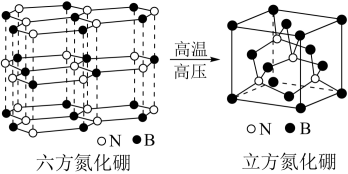
(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为_______________ 。该氮化硼晶体具有良好的润滑性,其原因是___________________ 。

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为_____________ ;已知晶体的密度为d g·cm-3,NA为阿伏加 德罗常数的值,则晶胞边长为__________ pm(用含d、NA的代数式表示)。
(1)基态氮原子的核外电子排布式为
(2)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与
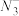 互为等电子体的分子的化学式:
互为等电子体的分子的化学式: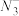 的空间构型为
的空间构型为(3)氮化硼(BN)和碳一样可以形成像石墨那样的平面六角形的层状结构,如图1所示,其中B原子的杂化方式为

(4)一定条件下,层型BN可转变为立方氮化硼,其晶胞结构如图2所示。晶胞中B原子的配位数为
您最近一年使用:0次
2020-09-25更新
|
421次组卷
|
3卷引用:云南、四川、贵州、西藏四省名校2021届高三第一次大联考化学试题
云南、四川、贵州、西藏四省名校2021届高三第一次大联考化学试题广西壮族自治区玉林市2021届高三上学期11月教学质量监测理科综合化学试题(已下线)第32讲 晶体结构与性质(练) — 2022年高考化学一轮复习讲练测(新教材新高考)



