名校
解题方法
1 . 绿矾(FeSO4•7H2O)结构如图所示,下列说法不正确 的是
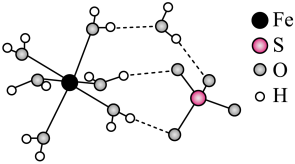

| A.中心离子Fe2+价层电子排布式为3d6 |
| B.H2O为配体,中心离子的配位数为7 |
| C.绿矾中存在配位键、氢键、离子键 |
| D.绿矾受热分解产生红棕色固体的同时可能生成SO2 |
您最近一年使用:0次
2022-10-27更新
|
544次组卷
|
4卷引用:重庆市万州第二高级中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
2 . 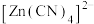 在水溶液中与HCHO发生如下反应:
在水溶液中与HCHO发生如下反应: 。下列说法正确的是
。下列说法正确的是
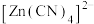 在水溶液中与HCHO发生如下反应:
在水溶液中与HCHO发生如下反应: 。下列说法正确的是
。下列说法正确的是| A.HCHO的分子构型是是三角锥形 |
B.基态 的电子排布式为 的电子排布式为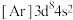 |
C.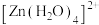 中与 中与 形成配位键的原子是H 形成配位键的原子是H |
D.1mol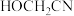 中所含 中所含 键的数目是6mol 键的数目是6mol |
您最近一年使用:0次
2022-10-07更新
|
539次组卷
|
3卷引用:重庆市万州第二高级中学2022-2023学年高三上学期1月质量检测化学试题
名校
解题方法
3 . 在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才实现产出。我国科学家最早研究的是稀土-钴化合物的结构。请回答下列问题:
(1)钴原子的价电子排布图为_______ ,基态钴原子的核外未成对电子数为_______ .
(2) 中存在
中存在_______ 种不同能级的电子。
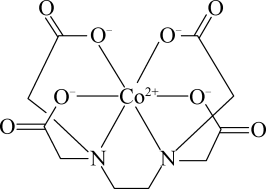
(3)一种钴的配合物乙二胺四乙酸合钴的结构如图所示,其中手性碳原子的个数为_______ .
(4)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属_______ 分子(选填“极性”“非极性”),其中心原子的 构型为
构型为_______ .
(5)橙红色晶体羰基钴的熔点为 ,分子式为
,分子式为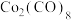 ,是一种重要的无机金属配合物,可溶于多数有机溶剂。该晶体属于
,是一种重要的无机金属配合物,可溶于多数有机溶剂。该晶体属于_______ 晶体。配体CO中与Co形成配位键的原子是C非O,原因是_______ 。
(1)钴原子的价电子排布图为
(2)
 中存在
中存在(3)一种钴的配合物乙二胺四乙酸合钴的结构如图所示,其中手性碳原子的个数为

(4)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属
 构型为
构型为(5)橙红色晶体羰基钴的熔点为
 ,分子式为
,分子式为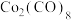 ,是一种重要的无机金属配合物,可溶于多数有机溶剂。该晶体属于
,是一种重要的无机金属配合物,可溶于多数有机溶剂。该晶体属于
您最近一年使用:0次
名校
解题方法
4 . 已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大,A是短周期中原子半径最大的元素,B元素 能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。
能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。
试回答下列有关的问题:
(1)写出基态D原子的价层电子排布式:_______ ,E元素在元素周期表的位置:_______ 。
(2)画出A、B、C中第一电离能最大的元素的原子结构式意图,_______ ;这三种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时, 由大到小的顺序是
由大到小的顺序是_______ (写化学式)。
(3)D可形成化合物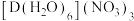 。
。
①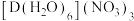 中配位体的
中配位体的 模型名称是
模型名称是_______ 。该化合物中阴离子的中心原子的轨道杂化类型为_______ 。
②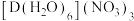 中
中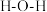 的键角
的键角_______ 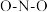 的键角(填“
的键角(填“ ”、
”、 ”、“
”、“ ”),原因是
”),原因是_______ 。
(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中_______ (填化学式)为非极性分子,另一种化合物的电子式为_______ 。
(5)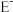 离子能与
离子能与 离子形成
离子形成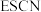 沉淀、
沉淀、 离子对应的酸有硫氰酸(
离子对应的酸有硫氰酸(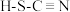 )和异硫氰酸(
)和异硫氰酸(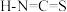 ),这两种酸沸点更高的是
),这两种酸沸点更高的是_______ (填名称),原因是_______ 。
 能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。
能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E元素位于元素周期表的第11列。试回答下列有关的问题:
(1)写出基态D原子的价层电子排布式:
(2)画出A、B、C中第一电离能最大的元素的原子结构式意图,
 由大到小的顺序是
由大到小的顺序是(3)D可形成化合物
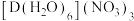 。
。①
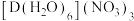 中配位体的
中配位体的 模型名称是
模型名称是②
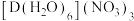 中
中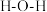 的键角
的键角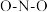 的键角(填“
的键角(填“ ”、
”、 ”、“
”、“ ”),原因是
”),原因是(4)已知B、C两种元素形成的化合物通常有两种。这两种化合物中
(5)
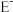 离子能与
离子能与 离子形成
离子形成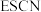 沉淀、
沉淀、 离子对应的酸有硫氰酸(
离子对应的酸有硫氰酸(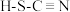 )和异硫氰酸(
)和异硫氰酸(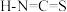 ),这两种酸沸点更高的是
),这两种酸沸点更高的是
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题
(1)现有下列物质:①金刚石;②干冰;③晶体硅;④二氧化硅晶体;⑤氯化铵;⑥氖;⑦金属锌。
通过非极性键形成共价晶体的是_______ ;属于分子晶体,且分子为直线形的是_______ ;由单原子分子构成的分子晶体是_______ ;含有极性键的离子化合物是_______ ;能导电且为金属晶体的是_______ 。
(2)在①苯;② ;③
;③ ;④
;④ ;⑤
;⑤ 五种有机溶剂中,碳原子采取
五种有机溶剂中,碳原子采取 杂化的分子有
杂化的分子有_______ 。(填序号)。 分子的立体构型是
分子的立体构型是_______ 。 与
与 相比,
相比,_______ (填化学式)的熔点较高。
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体 ,呈正四面体构型,易溶于下列物质中的_______(填序号)。
,呈正四面体构型,易溶于下列物质中的_______(填序号)。
(4)甲醛、甲醇和甲酸等碳原子个数较少的醛、醇和羧酸均易溶于水,而甲烷、甲酸甲酯难溶于水,试解释其原因_______ 。
(1)现有下列物质:①金刚石;②干冰;③晶体硅;④二氧化硅晶体;⑤氯化铵;⑥氖;⑦金属锌。
通过非极性键形成共价晶体的是
(2)在①苯;②
 ;③
;③ ;④
;④ ;⑤
;⑤ 五种有机溶剂中,碳原子采取
五种有机溶剂中,碳原子采取 杂化的分子有
杂化的分子有 分子的立体构型是
分子的立体构型是 与
与 相比,
相比,(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体
 ,呈正四面体构型,易溶于下列物质中的_______(填序号)。
,呈正四面体构型,易溶于下列物质中的_______(填序号)。| A.水 | B.  | C. | D. 溶液 溶液 |
您最近一年使用:0次
名校
解题方法
6 . 金属羰基配位化合物在催化反应中有着重要应用。 是锰的一种简单羰基配位化合物,其结构示意图如图。回答问题:
是锰的一种简单羰基配位化合物,其结构示意图如图。回答问题:

(1)基态锰原子的价层电子排布式为_______ 。
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。 中锰原子的配位数为
中锰原子的配位数为_______ 。
(3)第一电离能的大小:C_______ O(填“大于”或“小于”)。
(4)写出一种与 具有相同空间结构的—1价无机酸根离子的化学式
具有相同空间结构的—1价无机酸根离子的化学式_______ 。
(5)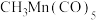 可看作是
可看作是 中的氢原子被甲基取代的产物。
中的氢原子被甲基取代的产物。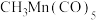 与
与 反应可用于制备
反应可用于制备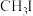 ,反应前后锰的配位数不变,
,反应前后锰的配位数不变,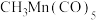 与
与 反应的化学方程式为
反应的化学方程式为_______ 。
(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是_______ 。
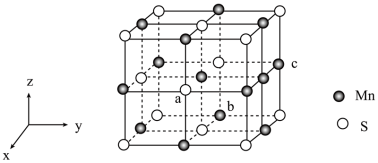
以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,a点硫原子坐标为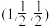 ,b点锰原子坐标为
,b点锰原子坐标为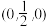 ,则c点锰原子坐标为
,则c点锰原子坐标为_______ 。
 是锰的一种简单羰基配位化合物,其结构示意图如图。回答问题:
是锰的一种简单羰基配位化合物,其结构示意图如图。回答问题:
(1)基态锰原子的价层电子排布式为
(2)配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。
 中锰原子的配位数为
中锰原子的配位数为(3)第一电离能的大小:C
(4)写出一种与
 具有相同空间结构的—1价无机酸根离子的化学式
具有相同空间结构的—1价无机酸根离子的化学式(5)
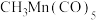 可看作是
可看作是 中的氢原子被甲基取代的产物。
中的氢原子被甲基取代的产物。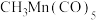 与
与 反应可用于制备
反应可用于制备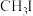 ,反应前后锰的配位数不变,
,反应前后锰的配位数不变,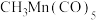 与
与 反应的化学方程式为
反应的化学方程式为(6)MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是

以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在MnS晶胞坐标系中,a点硫原子坐标为
 ,b点锰原子坐标为
,b点锰原子坐标为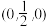 ,则c点锰原子坐标为
,则c点锰原子坐标为
您最近一年使用:0次
7 . 法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为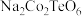 (制备原料为
(制备原料为 、
、 和
和 ),电解液为
),电解液为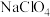 的碳酸丙烯酯溶液。回答下列问题:
的碳酸丙烯酯溶液。回答下列问题:
(1)基态Na原子中,核外电子占据的原子轨道总数为_______ ,Te属于元素周期表中_______ 区元素,其基态原子的价电子排布式为_______ 。
(2) 的空间结构为
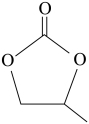
的空间结构为_______ ,碳酸丙烯酯的结构简式如图所示,其中碳原子的杂化轨道类型为_______ ,1mol碳酸丙烯酯中 键的数目为
键的数目为_______ 。
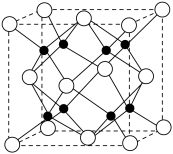
(3)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为_______ ,该晶胞的密度为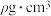 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Na与O之间的最短距离为
,则Na与O之间的最短距离为_______ cm(用含有 、
、 的代数式表示)。
的代数式表示)。
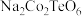 (制备原料为
(制备原料为 、
、 和
和 ),电解液为
),电解液为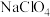 的碳酸丙烯酯溶液。回答下列问题:
的碳酸丙烯酯溶液。回答下列问题:(1)基态Na原子中,核外电子占据的原子轨道总数为
(2)
 的空间结构为
的空间结构为 键的数目为
键的数目为
(3)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为
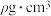 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Na与O之间的最短距离为
,则Na与O之间的最短距离为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
8 . 顺铂的结构简式为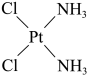 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为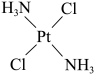 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为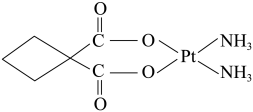 。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成
。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成 。请回答下列问题:
。请回答下列问题:
(1)下列说法正确的是_______(填序号)。
(2)根据碳铂的结构简式推断,1mol1,1—环丁二羧酸中含有 键的数目为
键的数目为_______ 。
(3)顺铂和反铂的物理性质有很大差异,其中只有_______ 易溶于水,原因是_______ 。
(4)乙烯酮分子中碳原子的杂化类型为_______ ;乙烯酮在一定条件下可聚合成双乙烯酮(结构简式为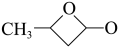 ),双乙烯酮分子中含有的
),双乙烯酮分子中含有的 键和
键和 键的数目之比为
键的数目之比为_______ 。
(5)由于氢键的存在,乙酸分子间也可形成二聚体(含八元环),该二聚体的结构为_______ 。
 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为 ,无抗癌作用;碳铂的结构简式为
,无抗癌作用;碳铂的结构简式为 。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成
。顺铂进入人体后,一个氧原子缓慢被水分子取代,形成 。请回答下列问题:
。请回答下列问题:(1)下列说法正确的是_______(填序号)。
| A.碳铂分子中有一个手性碳原子 |
| B.反铂属于极性分子 |
| C.碳铂的中心原子铂的配位数为4 |
D. 中 中 的H原子与Pt形成配位键 的H原子与Pt形成配位键 |
 键的数目为
键的数目为(3)顺铂和反铂的物理性质有很大差异,其中只有
(4)乙烯酮分子中碳原子的杂化类型为
 ),双乙烯酮分子中含有的
),双乙烯酮分子中含有的 键和
键和 键的数目之比为
键的数目之比为(5)由于氢键的存在,乙酸分子间也可形成二聚体(含八元环),该二聚体的结构为
您最近一年使用:0次
9 . 对下列事实的解释不正确的是
| 选项 | 事实 | 解释 |
| A | 在水中,HCl的溶解度比 的溶解度大 的溶解度大 | 根据相似相溶原理,氯化氢为极性分子,易溶于极性的水中,而碘单质为非极性分子,不易溶于水 |
| B | 氯化钠的晶体中, 可以吸引不同方向的6个 可以吸引不同方向的6个 | 离子键具有饱和性和方向性 |
| C |  溶液中滴加过量氨水,先出现蓝色沉淀后沉淀溶解变为深蓝色溶液 溶液中滴加过量氨水,先出现蓝色沉淀后沉淀溶解变为深蓝色溶液 |  与 与 形成的配位键更稳定 形成的配位键更稳定 |
| D | 铜金属具有良好的导电性 | 铜金属中有“自由电子” |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 氨硼烷 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下水解放出氢气:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下水解放出氢气: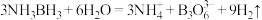 ,
, 的结构如图。下列说法错误的是
的结构如图。下列说法错误的是
 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下水解放出氢气:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下水解放出氢气: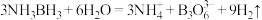 ,
, 的结构如图。下列说法错误的是
的结构如图。下列说法错误的是 
| A.氨硼烷中有配位键 | B.原子半径:N>B>H |
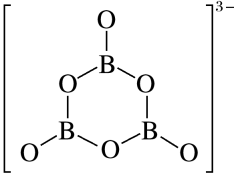
| C.第一电离能:N>O>B | D. 中各原子均在同一平面内 中各原子均在同一平面内 |
您最近一年使用:0次
2022-05-19更新
|
150次组卷
|
2卷引用:重庆市万州第二高级中学2021-2022学年高二下学期6月第三次质量检测化学试题



