名校
解题方法
1 . 小组同学进行Na2CO3和NaHCO3性质的探究,实验如下(夹持装置已略去,气密性已检验)。
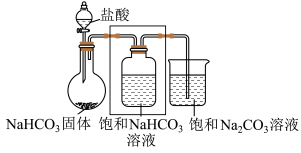
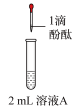
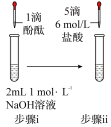
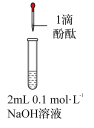
(1)打开分液漏斗活塞放出盐酸,发现流速越来越慢,可能的原因是________ 。
(2) NaHCO3与盐酸反应的化学方程式为________ 。
(3)方框中为洗气装置,请将该装置补充完整________ 。
(4)饱和 NaHCO3溶液的作用是________ 。
(5)反应持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:________ 。
(6)若向饱和NaHCO3溶液加入少量澄清石灰水的离子方程式_______

(1)打开分液漏斗活塞放出盐酸,发现流速越来越慢,可能的原因是
(2) NaHCO3与盐酸反应的化学方程式为
(3)方框中为洗气装置,请将该装置补充完整
(4)饱和 NaHCO3溶液的作用是
(5)反应持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:
(6)若向饱和NaHCO3溶液加入少量澄清石灰水的离子方程式
您最近一年使用:0次
名校
解题方法
2 . Fe2+在空气中易被氧化。某小组探究绿矾(FeSO4•7H2O)和莫尔盐[(NH4)2Fe(SO4)2•6H2O]在空气中的稳定性。
Ⅰ.探究溶液中的稳定性:配制0.1mol·L-1两种溶液[A:FeSO4,B:(NH4)2Fe(SO4)2],露置于空气中一段时间,并检验其中的Fe3+,结果如表。
(1)常温时0.1mol·L-1(NH4)2SO4溶液pH=5.0,则B溶液中水解程度:Fe2+_____ NH (填“>”或“<”),因此新配制的A、B溶液pH几乎相同。
(填“>”或“<”),因此新配制的A、B溶液pH几乎相同。
(2)放置24h后溶液pH均减小,写出该过程中Fe2+被空气氧化的离子方程式:_____ 。
上述实验说明两种溶液中的Fe2+的稳定性差异不大。
Ⅱ.探究晶体的稳定性:将两种晶体分别在不同条件下放置数天,实验记录如表。
(3)上述实验说明,相同条件下两种晶体在空气中稳定性更强的是_____ (填名称)。
(4)甲同学推测绿矾在ii中的结果与i不同可能是容器中O2不足造成的。乙同学经过对比,分析该推测不成立,其理由是_____ 。
(5)该小组同学根据实验结果进而推测绿矾易被氧化与其失去结晶水有关。
①绿矾晶体失去结晶水的实验现象是_____ 。
②莫尔盐晶体中______ 离子的存在使结晶水不易失去;该离子与H2O分子之间可能存在的作用是_____ 。
(6)同学们经过对两种晶体结构的比较,分析莫尔盐在空气中更稳定,除了上述原因外,还可能的原因:莫尔盐晶体中离子间的空隙较小,_____ 。
Ⅰ.探究溶液中的稳定性:配制0.1mol·L-1两种溶液[A:FeSO4,B:(NH4)2Fe(SO4)2],露置于空气中一段时间,并检验其中的Fe3+,结果如表。
| 编号 | 新配制 | 1h后 | 24h后 | |||||
| pH | 性状 | 酸化后滴等量KSCN(aq) | pH | 性状 | 酸化后滴等量KSCN(aq) | pH | 性状 | |
| A | 3.9 | 无色溶液 | 几乎无色 | 3.4 | 黄色溶液 | 变红 | 3.3 | 红褐色沉淀 |
| B | 3.9 | 无色溶液 | 几乎无色 | 3.3 | 黄色溶液 | 变红 | 3.2 | 红褐色沉淀 |
 (填“>”或“<”),因此新配制的A、B溶液pH几乎相同。
(填“>”或“<”),因此新配制的A、B溶液pH几乎相同。(2)放置24h后溶液pH均减小,写出该过程中Fe2+被空气氧化的离子方程式:
上述实验说明两种溶液中的Fe2+的稳定性差异不大。
Ⅱ.探究晶体的稳定性:将两种晶体分别在不同条件下放置数天,实验记录如表。
| 编号 | i | ii | iii | iv | |
| 实验条件 | 露置 | 密闭容器 | 潮湿的密闭容器 | 盛有干燥剂的 密闭容器 | |
| 实验结果 | 绿矾 | 晶体逐渐变白,进而出现土黄色;Fe3+含量很多 | 无明显变化;Fe3+含量非常少 | 晶体结块,颜色不变;Fe3+含量非常少 | 晶体逐渐变白,最终出现淡黄色;Fe3+含量很多 |
| 莫尔盐 | 无明显变化;Fe3+含量非常少 | 无明显变化;Fe3+含量非常少 | 晶体略结块,颜色不变;Fe3+含量非常少 | 无明显变化;Fe3+含量很少 | |
(4)甲同学推测绿矾在ii中的结果与i不同可能是容器中O2不足造成的。乙同学经过对比,分析该推测不成立,其理由是
(5)该小组同学根据实验结果进而推测绿矾易被氧化与其失去结晶水有关。
①绿矾晶体失去结晶水的实验现象是
②莫尔盐晶体中
(6)同学们经过对两种晶体结构的比较,分析莫尔盐在空气中更稳定,除了上述原因外,还可能的原因:莫尔盐晶体中离子间的空隙较小,
您最近一年使用:0次
2024-01-14更新
|
150次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题
名校
解题方法
3 . 李华同学想利用如图装置在实验室制备二氧化碳并验证过氧化钠可作呼吸面具中的供氧剂。下列有关说法正确的是
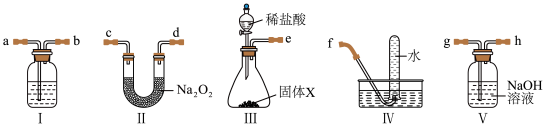

| A.装置的连接顺序为eghabcdf | B.装置Ⅰ中盛放浓硫酸 |
| C.装置Ⅲ中固体是生石灰 | D.装置Ⅳ中收集的气体可使带火星的木条复燃 |
您最近一年使用:0次
4 . 某化学兴趣小组设计了如图装置,该装置能制取 ,并进行相关性质实验,且可利用装置
,并进行相关性质实验,且可利用装置 储存多余的氯气。
储存多余的氯气。
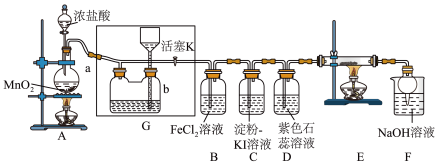
(1)A中发生反应的化学方程式为___________ 。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。
回答下列问题:
①在装置D中能看到的实验现象是___________ 。
②由C中出现的现象___________ 。
③在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为 和
和 ,则E中发生反应的化学方程式为
,则E中发生反应的化学方程式为___________ 。
(3)储气瓶b内盛放的试剂是___________ 。
(4)装置B中 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(5)F烧杯中发生反应的离子方程式为___________ 。
 ,并进行相关性质实验,且可利用装置
,并进行相关性质实验,且可利用装置 储存多余的氯气。
储存多余的氯气。
(1)A中发生反应的化学方程式为
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。
回答下列问题:
①在装置D中能看到的实验现象是
②由C中出现的现象
③在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为
 和
和 ,则E中发生反应的化学方程式为
,则E中发生反应的化学方程式为(3)储气瓶b内盛放的试剂是
(4)装置B中
 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为(5)F烧杯中发生反应的离子方程式为
您最近一年使用:0次
5 . 无水 常用作有机合成的脱水剂、缩合剂和催化剂。无水
常用作有机合成的脱水剂、缩合剂和催化剂。无水 易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水
易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水 ,并测定其纯度,实验装置如图所示:
,并测定其纯度,实验装置如图所示:
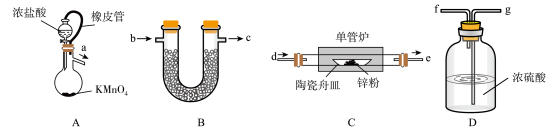
(1)装置A中反应的离子方程式为___________ ;装置A中橡皮管的作用为___________ 。
(2)按气流从左到右的方向,装置合理的连接顺序为___________
 (填接口小写字母)。
(填接口小写字母)。
(3)若省略装置D,经检验产物中含有氧化锌,利用所学知识解释原因___________ 。
(4)装置B中药品的作用为___________ 。
(5)氯化锌纯度的测定:将ag试样配成 溶液。取
溶液。取 ,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用
,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用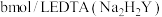 标准溶液滴定
标准溶液滴定 ,反应的离子方程式为
,反应的离子方程式为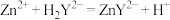 ,达到终点时,消耗EDTA溶液的平均体积为
,达到终点时,消耗EDTA溶液的平均体积为 。
。
①配制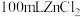 溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、___________ 。
②该氯化锌试样中氯化锌的质量分数为___________ (用含a.b的代数式表示)。
 常用作有机合成的脱水剂、缩合剂和催化剂。无水
常用作有机合成的脱水剂、缩合剂和催化剂。无水 易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水
易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水 ,并测定其纯度,实验装置如图所示:
,并测定其纯度,实验装置如图所示:
(1)装置A中反应的离子方程式为
(2)按气流从左到右的方向,装置合理的连接顺序为
 (填接口小写字母)。
(填接口小写字母)。(3)若省略装置D,经检验产物中含有氧化锌,利用所学知识解释原因
(4)装置B中药品的作用为
(5)氯化锌纯度的测定:将ag试样配成
 溶液。取
溶液。取 ,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用
,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用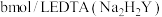 标准溶液滴定
标准溶液滴定 ,反应的离子方程式为
,反应的离子方程式为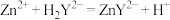 ,达到终点时,消耗EDTA溶液的平均体积为
,达到终点时,消耗EDTA溶液的平均体积为 。
。①配制
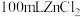 溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、②该氯化锌试样中氯化锌的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 研究小组探究 与水反应。取
与水反应。取 粉末加入到
粉末加入到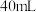 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
下列说法不正确的是
 与水反应。取
与水反应。取 粉末加入到
粉末加入到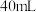 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。编号 | ① | ② | ③ | ④ |
操作 |
|
|
|
|
现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量能使带火星木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.变红色 | 溶液变红色,2小时后无明显变化 |
A.由②中现象ⅰ可知, 与水反应有 与水反应有 生成 生成 |
B.由③、④可知,②中溶液红色褪去是因为 大 大 |
C.由②、③、④可知,①中溶液红色褪去的主要原因不是 大 大 |
D.向①中褪色后的溶液中滴加5滴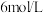 盐酸,溶液最终变成红色 盐酸,溶液最终变成红色 |
您最近一年使用:0次
2023-12-15更新
|
105次组卷
|
21卷引用:四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题
四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题北京市海淀区2021届高三上学期期中考试化学试题安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题北京一零一中学2021-2022学年高三上学期 9月开学练习化学试题北京交通大学附属中学2021-2022学年高一上学期期中考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市首都师范大学附属中学2022-2023学年高一上学期12月月考化学试题北京师范大学附属实验中学2021-2022学年高一上学期1月期末测试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题福建省厦门外国语学校2023-2024学年高一上学期10月第一次月考化学试题天津市第一中学2023-2024学年高一上学期11月期中化学试题北京市第二十中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市日坛中学2023-2024学年高一上学期期中考试化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷河南省唐河县鸿唐高级中学2023-2024学年高三上学期9月月考化学试题北京市第一五九中学2023-2024学年高一上学期期中考试化学试题山东省菏泽市郓城县第一中学2023-2024学年高一上学期9月月考化学试题
名校
7 . 氢化钠是常用的供氢剂,遇水剧烈反应,其制备原理是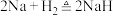 ,某小组设计实验制备氢化钠,装置如图所示。
,某小组设计实验制备氢化钠,装置如图所示。

请回答下列问题:
(1)A装置中反应的离子方程式_____________________ 。
(2)C装置中的试剂是___________ 。
(3)若拆掉B装置,则产品可能含有的杂质是________________ (填化学式)。
(4)实验时先打开活塞K,一段时间后再点燃酒精灯的原因是:_____________________ 。
(5)氢化钠与水反应生成一种碱和一种单质,写出化学方程式:______________________ 。
(6)若D中固体增重4g,则D中反应转移的电子数为_________ 。
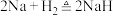 ,某小组设计实验制备氢化钠,装置如图所示。
,某小组设计实验制备氢化钠,装置如图所示。
请回答下列问题:
(1)A装置中反应的离子方程式
(2)C装置中的试剂是
(3)若拆掉B装置,则产品可能含有的杂质是
(4)实验时先打开活塞K,一段时间后再点燃酒精灯的原因是:
(5)氢化钠与水反应生成一种碱和一种单质,写出化学方程式:
(6)若D中固体增重4g,则D中反应转移的电子数为
您最近一年使用:0次
2023-12-14更新
|
52次组卷
|
2卷引用:四川省南充市嘉陵第一中学2023-2024学年高一上学期12月月考化学试题
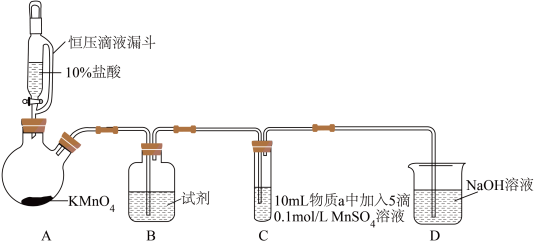
8 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
690次组卷
|
29卷引用:四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题
四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
名校
9 . 下列有关实验的现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向浓度均为0.10 mol·L-1的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向某浓度的K2CrO4溶液中缓慢滴加少许浓氢氧化钠溶液 | 溶液颜色由黄色变为橙红色 | 减小氢离子浓度,该溶液中的平衡向生成 的方向移动 的方向移动 |
| C | 向盛有某溶液的试管中滴加少量稀NaOH溶液 | 未产生使湿润的红色石蕊试纸变蓝的气体 | 该溶液中不含铵根 |
| D | 用pH计测定pH:①Na2CO3溶液②NaClO溶液 | pH:①>② | H2CO3酸性弱于HClO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-17更新
|
469次组卷
|
3卷引用:四川省遂宁市2023-2024学年高三上学期11月期中理综化学试题
名校
10 . 重铬酸铵[(NH4)2Cr2O7](M=252 g·mol-1)常用作分析试剂、催化剂及媒染剂等。某化学兴趣小组对重铬酸铵的一些性质及组成进行探究。已知: + H2O
+ H2O 2
2 +2H+。回答下列问题:
+2H+。回答下列问题:
(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol·L-1 NaOH溶液,振荡、微热。产生的现象是______________________ 。
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.52 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是___________ 。
②实验过程中,若发现加热温度不够,如何改进?___________ 。
③C装置的作用是___________ 。加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A中剩余固体1.52 g、B增重0.72 g,另外分解产物中还含有N2,则重铬酸铵受热分解的化学方程式为___________ 。
(3)为探究溶液酸性增强对铬(VI)盐溶液氧化性或Na2SO3溶液还原性的影响,该小组利用下图装置继续实验(已知物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,记录电压。
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验得出结论:___________ ;酸性增强,对Na2SO3溶液还原性几乎无影响。
②有同学认为:随着溶液酸性的增强,溶液中O2的氧化性增强也会使电压增大。补做实验:U型管左管中改为盛放___________ 溶液;然后向左管中滴加硫酸至pH=2后,测得电压增大了z,若z_____ y(填“>”、“<”或“=”),则证明实验结论不受影响。
 + H2O
+ H2O 2
2 +2H+。回答下列问题:
+2H+。回答下列问题:(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol·L-1 NaOH溶液,振荡、微热。产生的现象是
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.52 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是
②实验过程中,若发现加热温度不够,如何改进?
③C装置的作用是
(3)为探究溶液酸性增强对铬(VI)盐溶液氧化性或Na2SO3溶液还原性的影响,该小组利用下图装置继续实验(已知物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,记录电压。
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验得出结论:
②有同学认为:随着溶液酸性的增强,溶液中O2的氧化性增强也会使电压增大。补做实验:U型管左管中改为盛放
您最近一年使用:0次