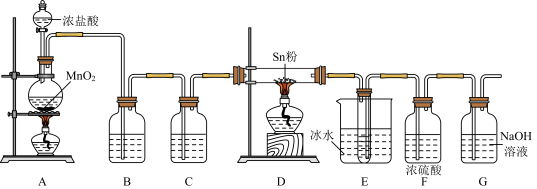
1 . 四氯化锡(SnCl4)常用作分析试剂、有机合成脱水剂等。设计如下装置制备SnCl4.
②装置D中发生反应:Sn+2Cl2 SnCl4.
SnCl4.
回答下列问题:
(1)装置A中反应的化学方程式为______ ,若反应中消耗1molMnO2,则生成Cl2的体积为______ L(标准状况下)。
(2)实验前,应进行的操作是______ 。
(3)装置B、C所盛装的试剂分别是______ 、______ (填字母),装置F的作用是______ 。
a.饱和食盐水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.碱石灰 e.无水硫酸铜 f.无水氯化钙
(4)装置E中使用冰水浴的目的是______ 。
(5)常温下,装置G中发生反应的离子方程式为______ 。
②装置D中发生反应:Sn+2Cl2
 SnCl4.
SnCl4.回答下列问题:
(1)装置A中反应的化学方程式为
(2)实验前,应进行的操作是
(3)装置B、C所盛装的试剂分别是
a.饱和食盐水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.碱石灰 e.无水硫酸铜 f.无水氯化钙
(4)装置E中使用冰水浴的目的是
(5)常温下,装置G中发生反应的离子方程式为
您最近半年使用:0次
2024-04-13更新
|
149次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
2 . 一氧化二氯( )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:
实验室制备原理: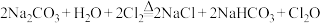
现用如图所示装置设计实验制备少量 ,并探究相关物质的性质。
,并探究相关物质的性质。

(1)装置A中仪器X的名称为________ ,写出装置A中的反应方程式________ 。
(2)若气体从左至右流动,则装置的连接顺序是A、________ 。(每个装置限用一次)
(3)装置F中盛装试剂的名称为________ 。装置E中无水氯化钙的作用________ 。
(4)装置中浓硫酸的作用________ 。写出 与
与 反应的离子方程式
反应的离子方程式________ 。
(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:________ 。
(6)已知 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式________ 。
 )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:物理性质 | 化学性质 |
常温下, |
|
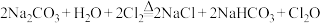
现用如图所示装置设计实验制备少量
 ,并探究相关物质的性质。
,并探究相关物质的性质。
(1)装置A中仪器X的名称为
(2)若气体从左至右流动,则装置的连接顺序是A、
(3)装置F中盛装试剂的名称为
(4)装置中浓硫酸的作用
 与
与 反应的离子方程式
反应的离子方程式(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:
(6)已知
 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式
您最近半年使用:0次
解题方法
3 . 硫酸铈铵 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈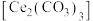 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
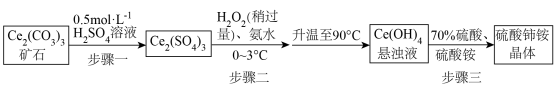
已知:①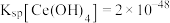 。
。
②硫酸铈铵的熔点为 ,沸点为
,沸点为 。
。
回答下列问题:
(1)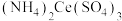 中铈元素的化合价为
中铈元素的化合价为_______ 。
(2)步骤一中,先将
 矿石粉碎,目的是
矿石粉碎,目的是_______ 。
(3)步骤二中,反应温度需要控制在
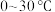 ,原因是
,原因是_______ 。反应完全后,要将混合物升温至
 ,目的是
,目的是_______ 。
(4)步骤二中,
 与
与
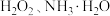 反应生成
反应生成
 的化学方程式为
的化学方程式为_______ 。
(5)步骤三反应完全后的溶液经_______ 、_______ 、过滤,得到晶体。最后用_______ 洗涤
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。
(6)若最初称取一定量的碳酸铈矿石,其中含
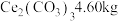 ,经该工艺流程最终获得
,经该工艺流程最终获得
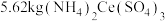 晶体,则
晶体,则
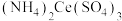 的产率为
的产率为_______ (保留三位有效数字)。
 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈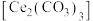 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
已知:①
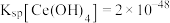 。
。②硫酸铈铵的熔点为
 ,沸点为
,沸点为 。
。回答下列问题:
(1)
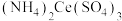 中铈元素的化合价为
中铈元素的化合价为(2)步骤一中,先将
 矿石粉碎,目的是
矿石粉碎,目的是(3)步骤二中,反应温度需要控制在
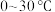 ,原因是
,原因是 ,目的是
,目的是(4)步骤二中,
 与
与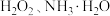 反应生成
反应生成 的化学方程式为
的化学方程式为(5)步骤三反应完全后的溶液经
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。(6)若最初称取一定量的碳酸铈矿石,其中含
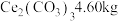 ,经该工艺流程最终获得
,经该工艺流程最终获得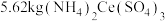 晶体,则
晶体,则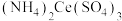 的产率为
的产率为
您最近半年使用:0次
2023-10-29更新
|
686次组卷
|
4卷引用:西藏林芝市2023-2024学年高三上学期期末考试化学试题
西藏林芝市2023-2024学年高三上学期期末考试化学试题广西北海市2024届高三一模考试化学试题甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
4 . 富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:
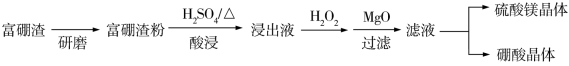
已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
(1)上述流程中能加快反应速率的措施有___________ 、___________ 等。
(2)酸浸时发生反应:2MgO·SiO2+2H2SO4=2MgSO4+SiO2+2H2O, 2MgO·B2O3+2H2SO4+H2O=2H3BO3+2MgSO4。
①上述反应体现出酸性强弱:H2SO4___________ H3BO3(填“>”或“<”)。
②酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的化学方程式:___________ 、___________ 。
③已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3+OH− =B(OH) 。下列关于硼酸的说法正确的是
。下列关于硼酸的说法正确的是 ___________
A.硼酸是一元酸
B.硼酸的电离方程式可表示为:H3BO3+H2O B(OH)
B(OH) +H+
+H+
C.向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
(3)检验褐色浸出液中的杂质离子:取少量浸出液,___________ (填操作和现象),证明溶液中含有Fe2+。
(4)除去浸出液中的杂质离子:用MgO调节溶液的pH至___________ 以上,使杂质离子转化为___________ (填化学式)沉淀,过滤。
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合下图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,___________ (将方法补充完整)。

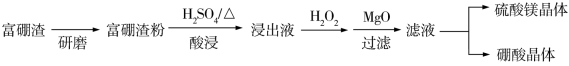
已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
| Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
| 开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
| 完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
(2)酸浸时发生反应:2MgO·SiO2+2H2SO4=2MgSO4+SiO2+2H2O, 2MgO·B2O3+2H2SO4+H2O=2H3BO3+2MgSO4。
①上述反应体现出酸性强弱:H2SO4
②酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的化学方程式:
③已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3+OH− =B(OH)
 。下列关于硼酸的说法正确的是
。下列关于硼酸的说法正确的是 A.硼酸是一元酸
B.硼酸的电离方程式可表示为:H3BO3+H2O
 B(OH)
B(OH) +H+
+H+C.向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
(3)检验褐色浸出液中的杂质离子:取少量浸出液,
(4)除去浸出液中的杂质离子:用MgO调节溶液的pH至
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合下图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,

您最近半年使用:0次
5 . 硫化钠可广泛用于染料、医药行业。工业生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列问题:
(1)工业上常用芒硝( )和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为
)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为_______ 。
(2)溶解回流装置如图所示,回流前无需加入沸石,其原因是_______ 。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3.若气雾上升过高,可采取的措施是_______ 。

(3)回流时间不宜过长,原因是_______ 。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为_______ (填标号)。
A.①②③ B.③①② C.②①③ D.①③②
(4)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是_______ 。过滤除去的杂质为_______ 。若滤纸上析出大量晶体,则可能的原因是_______ 。
(5)滤液冷却、结晶、过滤,晶体用少量_______ 洗涤,干燥,得到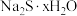 。
。
(1)工业上常用芒硝(
 )和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为
)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为(2)溶解回流装置如图所示,回流前无需加入沸石,其原因是

(3)回流时间不宜过长,原因是
A.①②③ B.③①② C.②①③ D.①③②
(4)该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是
(5)滤液冷却、结晶、过滤,晶体用少量
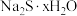 。
。
您最近半年使用:0次
2022-06-08更新
|
16506次组卷
|
25卷引用:西藏自治区林芝市第二高级中学2023-2024学年高三上学期第三次月考理科综合试题
西藏自治区林芝市第二高级中学2023-2024学年高三上学期第三次月考理科综合试题2022年高考全国甲卷化学真题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)(已下线)2022年全国甲卷高考真题变式题(非选择题)(已下线)专题14 化学实验综合题-备战2023年高考化学母题题源解密(全国通用)(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 硫及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题16 化学实验综合题-备战2023年高考化学母题题源解密(广东卷)(已下线)第29讲 化学综合实验(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点10 硫元素及其化合物-备战2023年高考化学考试易错题河北省石家庄市第四十三中学2022-2023学年高三上学期10月月考化学试题福建省2022-2023学年高三上学期化学1月质检考前模拟试题(已下线)特别关注·命题最前沿 注重灵活思维 培养创新意识坚持素养导向 突出创新命题(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题03 化学实验专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)云南省红河哈尼族彝族自治州2023届高三下学期全真模拟考试理综化学试题(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 物质制备实验的设计与评价(已下线)题型一 实验简答题答题规范-备战2024年高考化学答题技巧与模板构建甘肃省平凉市泾川县第三中学2023-2024学年高三上学期第3次月考化学试题
6 . 硫酸四氨合铜晶体( )常用作杀虫剂、媒染剂,也是高效安全的广谱杀菌剂。常温下该物质易溶于水,难溶于乙醇,受热时易发生分解。某化学兴趣小组拟合成硫酸四氨合铜晶体并测定其纯度。
)常用作杀虫剂、媒染剂,也是高效安全的广谱杀菌剂。常温下该物质易溶于水,难溶于乙醇,受热时易发生分解。某化学兴趣小组拟合成硫酸四氨合铜晶体并测定其纯度。
Ⅰ. 溶液的制备
溶液的制备
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸。
(1)请写出方案i反应的化学方程式___________ ,此方法硫酸的利用率较低的原因是___________ ;
(2)方案ii除了可提高硫酸的利用率外,还有的优点是___________ ;
Ⅱ.晶体的制备
将上述制备的 溶液按下图所示进行操作:
溶液按下图所示进行操作:
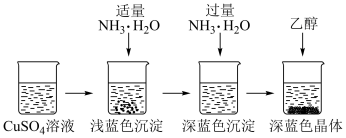
(3)加入适量 调节溶液pH,产生浅蓝色沉淀,已知其成分为
调节溶液pH,产生浅蓝色沉淀,已知其成分为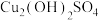 ,试写出生成此沉淀的离子反应方程式
,试写出生成此沉淀的离子反应方程式___________ ;继续滴加 ,浅蓝色沉淀会转化生成深蓝色溶液
,浅蓝色沉淀会转化生成深蓝色溶液 ;
;
(4)加入乙醇析出晶体的原因是___________ ;
Ⅲ.产品纯度的测定
精确称取mg晶体,加适量水溶解,注入图示的三颈瓶中,然后逐滴加入足量NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用 mL 0.500
mL 0.500 的盐酸标准溶液完全吸收。取下接收瓶,用0.500
的盐酸标准溶液完全吸收。取下接收瓶,用0.500 NaOH标准溶液滴定过剩的HCl,到终点时消耗
NaOH标准溶液滴定过剩的HCl,到终点时消耗 mL NaOH溶液。
mL NaOH溶液。
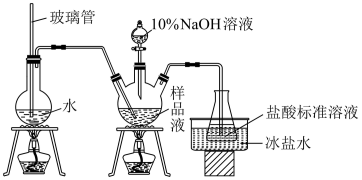
(5)若水槽中没有使用冰盐水冷却会使氨含量测定结果___________ (填“偏高”“偏低”或“无影响”);
(6)样品中产品纯度的表达式___________ 。(不用化简)
 )常用作杀虫剂、媒染剂,也是高效安全的广谱杀菌剂。常温下该物质易溶于水,难溶于乙醇,受热时易发生分解。某化学兴趣小组拟合成硫酸四氨合铜晶体并测定其纯度。
)常用作杀虫剂、媒染剂,也是高效安全的广谱杀菌剂。常温下该物质易溶于水,难溶于乙醇,受热时易发生分解。某化学兴趣小组拟合成硫酸四氨合铜晶体并测定其纯度。Ⅰ.
 溶液的制备
溶液的制备方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸。
(1)请写出方案i反应的化学方程式
(2)方案ii除了可提高硫酸的利用率外,还有的优点是
Ⅱ.晶体的制备
将上述制备的
 溶液按下图所示进行操作:
溶液按下图所示进行操作:
(3)加入适量
 调节溶液pH,产生浅蓝色沉淀,已知其成分为
调节溶液pH,产生浅蓝色沉淀,已知其成分为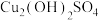 ,试写出生成此沉淀的离子反应方程式
,试写出生成此沉淀的离子反应方程式 ,浅蓝色沉淀会转化生成深蓝色溶液
,浅蓝色沉淀会转化生成深蓝色溶液 ;
;(4)加入乙醇析出晶体的原因是
Ⅲ.产品纯度的测定
精确称取mg晶体,加适量水溶解,注入图示的三颈瓶中,然后逐滴加入足量NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
 mL 0.500
mL 0.500 的盐酸标准溶液完全吸收。取下接收瓶,用0.500
的盐酸标准溶液完全吸收。取下接收瓶,用0.500 NaOH标准溶液滴定过剩的HCl,到终点时消耗
NaOH标准溶液滴定过剩的HCl,到终点时消耗 mL NaOH溶液。
mL NaOH溶液。
(5)若水槽中没有使用冰盐水冷却会使氨含量测定结果
(6)样品中产品纯度的表达式
您最近半年使用:0次
2021-12-04更新
|
289次组卷
|
2卷引用:西藏自治区拉萨中学2022届高三第五次月考理综化学试题
名校
7 . 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分为 ,含少量
,含少量 、FeO等杂质)为主要原料制金属钛的工艺流程如下:
、FeO等杂质)为主要原料制金属钛的工艺流程如下:

已知: 的氧化性比
的氧化性比 的弱,且
的弱,且 易水解生成
易水解生成 ,
, 进一步水解可得
进一步水解可得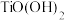 沉淀。
沉淀。
回答下列问题:
(1)要加快溶煮的反应速率,可以采取的措施是___________ (写两点)。
(2)“混合液”中加入Fe的主要作用是___________ 。
(3)“混合液”中含有 、
、 和少量
和少量 等阳离子。常温下,其对应氢氧化物的
等阳离子。常温下,其对应氢氧化物的 如下表所示。
如下表所示。
①常温下,若所得溶液中 的浓度为0.0018
的浓度为0.0018 ,当溶液的pH等于
,当溶液的pH等于___________ 时, 开始沉淀。
开始沉淀。
②若将含有 、
、 和
和 的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为
的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________ 。
(4)“分离煅烧”过程中反应的化学方程式为___________ 。
(5)“氯化”的过程为:将分离煅烧后的固体与炭粉混合,在高温条件下通入 制得
制得 和一种可燃性气体。该反应的化学方程式为
和一种可燃性气体。该反应的化学方程式为___________ 。
(6)“还原”过程必须在1070 K的温度下进行,你认为还应该控制的反应条件是___________ 。
 ,含少量
,含少量 、FeO等杂质)为主要原料制金属钛的工艺流程如下:
、FeO等杂质)为主要原料制金属钛的工艺流程如下:
已知:
 的氧化性比
的氧化性比 的弱,且
的弱,且 易水解生成
易水解生成 ,
, 进一步水解可得
进一步水解可得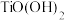 沉淀。
沉淀。回答下列问题:
(1)要加快溶煮的反应速率,可以采取的措施是
(2)“混合液”中加入Fe的主要作用是
(3)“混合液”中含有
 、
、 和少量
和少量 等阳离子。常温下,其对应氢氧化物的
等阳离子。常温下,其对应氢氧化物的 如下表所示。
如下表所示。| 氢氧化物 |  | 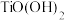 |  |
 |  | 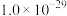 | 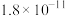 |
①常温下,若所得溶液中
 的浓度为0.0018
的浓度为0.0018 ,当溶液的pH等于
,当溶液的pH等于 开始沉淀。
开始沉淀。②若将含有
 、
、 和
和 的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为
的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为(4)“分离煅烧”过程中反应的化学方程式为
(5)“氯化”的过程为:将分离煅烧后的固体与炭粉混合,在高温条件下通入
 制得
制得 和一种可燃性气体。该反应的化学方程式为
和一种可燃性气体。该反应的化学方程式为(6)“还原”过程必须在1070 K的温度下进行,你认为还应该控制的反应条件是
您最近半年使用:0次
名校
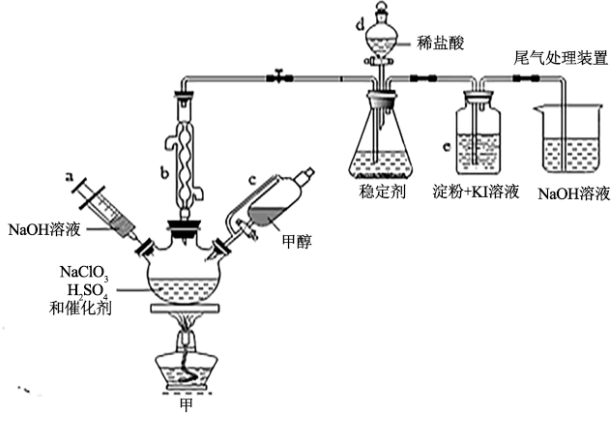
8 . 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O
③有关物质沸点如下表;
请回答:
(1)仪器b的名称是___________ ,在装置中的作用是___________ ;比较仪器c和d,实验中c的优点是___________ 。
(2)根据反应条件判断制备装置甲中需改进的一项措施是___________ 。
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:___________ 。该制备法可选用不同的还原性物质作为还原剂例如草酸(草酸的氧化产物为CO2),相比甲醇法,草酸法的优点是___________ 。
(4)下列有关说法正确的是___________ 。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5 =Cl-+4ClO2↑+2H2O
=Cl-+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5)采用以下方法可以测定所制备的ClO2的量:
Ⅰ.将足量KI用100mL水溶解后加入到锥形瓶,再加3mL稀 ;
;
Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用cmol/L的 标准溶液滴定(
标准溶液滴定( ),共用去
),共用去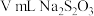 溶液:
溶液:
①达到滴定终点的现象是___________ 。
②实验测得所通入的ClO2的质量为___________ 。

已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O
③有关物质沸点如下表;
| 物质 | CH3OH | HCOOH | ClO2 |
| 沸点 | 64.7℃ | 100.8℃ | 11℃ |
(1)仪器b的名称是
(2)根据反应条件判断制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:
(4)下列有关说法正确的是
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5
 =Cl-+4ClO2↑+2H2O
=Cl-+4ClO2↑+2H2OD.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5)采用以下方法可以测定所制备的ClO2的量:
Ⅰ.将足量KI用100mL水溶解后加入到锥形瓶,再加3mL稀
 ;
;Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用cmol/L的
 标准溶液滴定(
标准溶液滴定( ),共用去
),共用去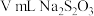 溶液:
溶液:①达到滴定终点的现象是
②实验测得所通入的ClO2的质量为
您最近半年使用:0次
2021-05-23更新
|
607次组卷
|
2卷引用:西藏自治区昌都市第一高级中学2021届高三第一次仿真考试理科综合化学试题
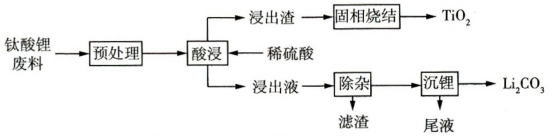
9 . 钛酸锂电池是一种较安全的锂离子电池,利用钛酸锂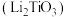 废料(含有少量碳、镍和铁元素),回收其中的有价金属锂和钛并制备高附加值的碳酸锂和二氧化钛产品,工艺流程如图所示:
废料(含有少量碳、镍和铁元素),回收其中的有价金属锂和钛并制备高附加值的碳酸锂和二氧化钛产品,工艺流程如图所示:
(1) 中
中 的化合价为
的化合价为______ 。
(2)酸浸时生成钛酸 ,提高酸浸速率的措施有:
,提高酸浸速率的措施有:________ .(写一条即可)
(3)浸出渣中含有钛酸和少量_________ 。
(4)已知: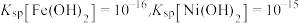 .常温时通过调节溶液
.常温时通过调节溶液 大于
大于________ ,达到除杂目的。
若要将镍、铁从浸出液中分步除去,达到分离镍和铁的目的,方案为___________ ,然后继续调 ,过滤得到
,过滤得到 。
。
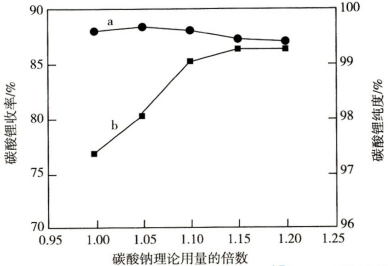
(5)用碳酸钠“沉锂”的离子方程式为___________________________ ;碳酸钠的添加量(理论用量的倍数)对 的收率及纯度影响如图所示.代表
的收率及纯度影响如图所示.代表 纯度的曲线为
纯度的曲线为___________ (填“a”或“b”)。
(6)工业上向尾液中加入 的目的是
的目的是___________ (填编号)。
A.进一步回收金属锂 B.得到产品 C.除杂 D.污水处理
C.除杂 D.污水处理
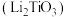 废料(含有少量碳、镍和铁元素),回收其中的有价金属锂和钛并制备高附加值的碳酸锂和二氧化钛产品,工艺流程如图所示:
废料(含有少量碳、镍和铁元素),回收其中的有价金属锂和钛并制备高附加值的碳酸锂和二氧化钛产品,工艺流程如图所示:
(1)
 中
中 的化合价为
的化合价为(2)酸浸时生成钛酸
 ,提高酸浸速率的措施有:
,提高酸浸速率的措施有:(3)浸出渣中含有钛酸和少量
(4)已知:
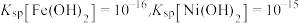 .常温时通过调节溶液
.常温时通过调节溶液 大于
大于若要将镍、铁从浸出液中分步除去,达到分离镍和铁的目的,方案为
 ,过滤得到
,过滤得到 。
。(5)用碳酸钠“沉锂”的离子方程式为
 的收率及纯度影响如图所示.代表
的收率及纯度影响如图所示.代表 纯度的曲线为
纯度的曲线为
(6)工业上向尾液中加入
 的目的是
的目的是A.进一步回收金属锂 B.得到产品
 C.除杂 D.污水处理
C.除杂 D.污水处理
您最近半年使用:0次
2021-05-22更新
|
642次组卷
|
3卷引用:西藏自治区拉萨中学2022届高三第五次月考理综化学试题
西藏自治区拉萨中学2022届高三第五次月考理综化学试题江西省南昌市2021届高三4月第二次模拟考试理综化学试题(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)
解题方法
10 . 一氯化碘(ICl)是一种重要的卤素互化物,在化工生产中有广泛应用。有关一氯化碘的部分信息如下:
某小组拟设计实验制备一氯化碘并测定其纯度,装置如图所示。
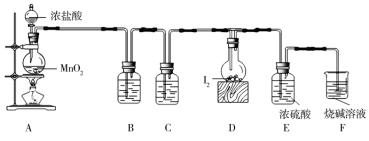
按如图所示装置进行实验,当D装置中产生红棕色液体、固体消失时停止反应。
请回答下列问题:
(1)盛装浓盐酸的仪器名称是_______ ;C装置作用是_______ 。
(2)B装置中试剂名称是_______ 。
(3)写出A中反应的化学方程式_______ 。
(4)启动反应后,将D装置的仪器放置于冷水浴中,其目的是_______ 。
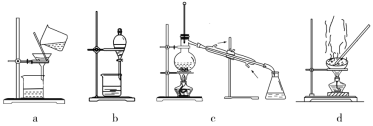
(5)粗产品中混有碘单质,提纯产品可选择下列装置中的_______ (填字母)。
| 物质 | 部分信息 |
| ICl | 沸点为97.4℃,红棕色液体;遇水反应。I2(s)+Cl2(g)=2ICl(l) ΔH<0 |
| I2 | 熔点:113.5℃,沸点:184.4℃,易升华。 |

按如图所示装置进行实验,当D装置中产生红棕色液体、固体消失时停止反应。
请回答下列问题:
(1)盛装浓盐酸的仪器名称是
(2)B装置中试剂名称是
(3)写出A中反应的化学方程式
(4)启动反应后,将D装置的仪器放置于冷水浴中,其目的是
(5)粗产品中混有碘单质,提纯产品可选择下列装置中的

您最近半年使用:0次



