名校
解题方法
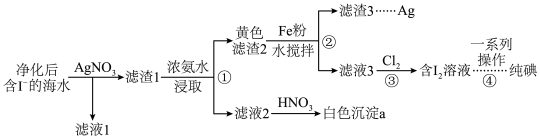
1 . 碘及其化合物在生产、生活等方面都有广泛的应用,下图是从海水提取单质碘的一种工艺流程图。回答下列问题:___________ 。白色沉淀a的化学式___________ 。
(2)滤渣1用浓氨水浸取,滤渣部分溶解,用平衡移动的原理进行合理解释:___________ (要求写出可逆反应,并适当进行文字说明)。
(3)步骤②发生反应的离子方程式___________ 。
(4)步骤③通入 后,若生成两种氧化产物且物质的量的比为1:1,则发生反应的离子方程式
后,若生成两种氧化产物且物质的量的比为1:1,则发生反应的离子方程式___________ 。
(5)步骤④中一系列操作包括___________ (填实验操作名称)。
(6)硝酸银是高中重要的检验用试剂,写出净化后含 海水(碘元素含量较高)中含有
海水(碘元素含量较高)中含有 的检验方法
的检验方法___________ 。
(7)银盐大部分不溶于水,现在有两种银盐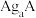 和
和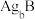 均难溶于水,在含有
均难溶于水,在含有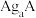 和
和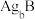 的悬浊液中加入
的悬浊液中加入 的
的 溶液,混合溶液中
溶液,混合溶液中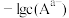 或
或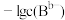 与
与 的关系如图所示:
的关系如图所示: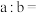
___________ 。
② 点饱和溶液中加入硝酸银溶液,
点饱和溶液中加入硝酸银溶液,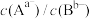 将
将___________ (填增大、減小、不变、不能确定)。
(2)滤渣1用浓氨水浸取,滤渣部分溶解,用平衡移动的原理进行合理解释:
(3)步骤②发生反应的离子方程式
(4)步骤③通入
 后,若生成两种氧化产物且物质的量的比为1:1,则发生反应的离子方程式
后,若生成两种氧化产物且物质的量的比为1:1,则发生反应的离子方程式(5)步骤④中一系列操作包括
(6)硝酸银是高中重要的检验用试剂,写出净化后含
 海水(碘元素含量较高)中含有
海水(碘元素含量较高)中含有 的检验方法
的检验方法(7)银盐大部分不溶于水,现在有两种银盐
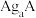 和
和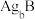 均难溶于水,在含有
均难溶于水,在含有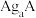 和
和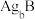 的悬浊液中加入
的悬浊液中加入 的
的 溶液,混合溶液中
溶液,混合溶液中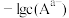 或
或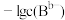 与
与 的关系如图所示:
的关系如图所示: 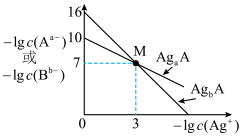
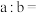
②
 点饱和溶液中加入硝酸银溶液,
点饱和溶液中加入硝酸银溶液,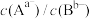 将
将
您最近半年使用:0次
名校
2 . 氯化亚铁在冶金、医药制造、媒染剂等方面有着较为广泛的用途,氯化亚铁可以对许多分子进行激活反应,成为一种新型“明星分子”。回答下列问题:
(1)由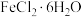 固体粗略配制
固体粗略配制 溶液,称取
溶液,称取___________ g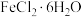 固体在
固体在___________ (填试剂)中溶解后,加水稀释为 ,最后加入少量铁粉。
,最后加入少量铁粉。
(2)“无汞定铁法”标定 溶液浓度:
溶液浓度:
①将___________ (填酸式或碱式)滴定管先水洗,再润洗,最后盛装 标准
标准 溶液,其下一步操作是
溶液,其下一步操作是___________ ,……正确安装滴定管。
②用移液管准确量取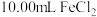 溶液注入锥形瓶中,并加入
溶液注入锥形瓶中,并加入 硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是
硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是___________ 。
③用 标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗
标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗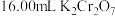 标准溶液,写出滴定反应的离子方程式
标准溶液,写出滴定反应的离子方程式___________ 。 溶液的标定浓度为
溶液的标定浓度为___________ 。
(3)取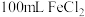 溶液加热、蒸干、灼烧至质量不变。固体质量为
溶液加热、蒸干、灼烧至质量不变。固体质量为___________ 。
(4)已知:亚硫酰氯( )沸点为
)沸点为 ,遇水极易水解。实验室利用
,遇水极易水解。实验室利用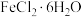 固体和亚硫酰氯(
固体和亚硫酰氯( )制备新型“明星分子”
)制备新型“明星分子” 固体的装置如下图所示:
固体的装置如下图所示: 后,先加热装置
后,先加热装置___________ (填“a”或“b”)。
②装置c、d连接在一起共同起到的作用___________ 。
③硬质玻璃试管b中发生反应的化学方程式___________ 。
④装置e中试剂为 的酸性
的酸性 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(1)由
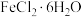 固体粗略配制
固体粗略配制 溶液,称取
溶液,称取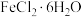 固体在
固体在 ,最后加入少量铁粉。
,最后加入少量铁粉。(2)“无汞定铁法”标定
 溶液浓度:
溶液浓度:①将
 标准
标准 溶液,其下一步操作是
溶液,其下一步操作是②用移液管准确量取
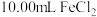 溶液注入锥形瓶中,并加入
溶液注入锥形瓶中,并加入 硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是
硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是③用
 标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗
标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗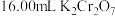 标准溶液,写出滴定反应的离子方程式
标准溶液,写出滴定反应的离子方程式 溶液的标定浓度为
溶液的标定浓度为(3)取
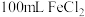 溶液加热、蒸干、灼烧至质量不变。固体质量为
溶液加热、蒸干、灼烧至质量不变。固体质量为(4)已知:亚硫酰氯(
 )沸点为
)沸点为 ,遇水极易水解。实验室利用
,遇水极易水解。实验室利用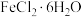 固体和亚硫酰氯(
固体和亚硫酰氯( )制备新型“明星分子”
)制备新型“明星分子” 固体的装置如下图所示:
固体的装置如下图所示: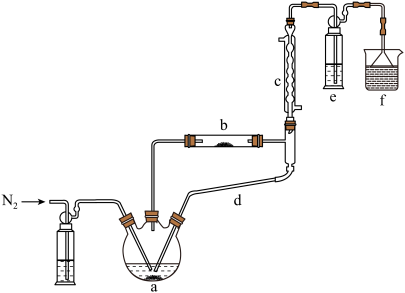
 后,先加热装置
后,先加热装置②装置c、d连接在一起共同起到的作用
③硬质玻璃试管b中发生反应的化学方程式
④装置e中试剂为
 的酸性
的酸性 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
您最近半年使用:0次
3 . 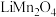 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿( ,含有少量Si、Fe、Ni、Al等元素)制备
,含有少量Si、Fe、Ni、Al等元素)制备 的流程如下:
的流程如下: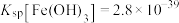 ,
, ,
,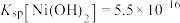 。(离子浓度小于
。(离子浓度小于 即认为完全除去)。
即认为完全除去)。
回答下列问题:
(1)反应器中加入少量 的作用是
的作用是_______ ,反应后溶液中存在的金属阳离子有_______ 。
(2)加入石灰乳调节pH应大于_______ 。
(3)加入少量BaS溶液除去 ,生成的沉淀有
,生成的沉淀有_______ 。
(4)煅烧窑中,生成 反应的化学方程式为
反应的化学方程式为_______ 。
(5)锰酸锂可充电电池的总反应为: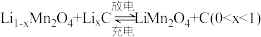 。充电时,电池的阳极反应式为
。充电时,电池的阳极反应式为_______ ,若转移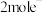 ,则石墨电极将增重
,则石墨电极将增重_______ g。
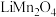 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(
作为一种新型锂电池正极材料受到广泛关注。由菱锰矿( ,含有少量Si、Fe、Ni、Al等元素)制备
,含有少量Si、Fe、Ni、Al等元素)制备 的流程如下:
的流程如下: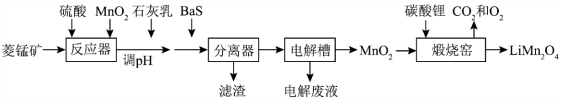
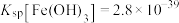 ,
, ,
,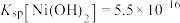 。(离子浓度小于
。(离子浓度小于 即认为完全除去)。
即认为完全除去)。回答下列问题:
(1)反应器中加入少量
 的作用是
的作用是(2)加入石灰乳调节pH应大于
(3)加入少量BaS溶液除去
 ,生成的沉淀有
,生成的沉淀有(4)煅烧窑中,生成
 反应的化学方程式为
反应的化学方程式为(5)锰酸锂可充电电池的总反应为:
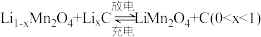 。充电时,电池的阳极反应式为
。充电时,电池的阳极反应式为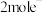 ,则石墨电极将增重
,则石墨电极将增重
您最近半年使用:0次
解题方法
4 . 氨基甲酸铵是一种有机化合物,化学式为 ,为白色固体,易分解,易水解,是化学工业中尿素生产过程的中间产物,也用于医药氨化剂。利用如图所示的装置制备氨基甲酸铵并测定其在室温下(25℃)分解的分压平衡常数。
,为白色固体,易分解,易水解,是化学工业中尿素生产过程的中间产物,也用于医药氨化剂。利用如图所示的装置制备氨基甲酸铵并测定其在室温下(25℃)分解的分压平衡常数。
已知: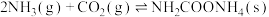
 ,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则容易发生副反应生成无机盐。
,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则容易发生副反应生成无机盐。
I.制备氨基甲酸铵,部分实验装置如图所示:_______ 。
(2)装置A和B中装有相同的固体,则该固体为_______ 。
(3)若缺少装置B,反应器中可能发生的副反应的化学方程式为_______ 。
(4)装置E中浓硫酸的作用为_______ 。
II.测定室温下(25℃)氨基甲酸铵分解的分压平衡常数:
①将氨基甲酸铵装入球泡中,调整旋塞位于d位置,调节恒温槽温度为25℃,将E处接至真空泵,打开K,降低体系内压强,利用水银压差计测得初始状态的压强为 ,关闭K。
,关闭K。
②达到分解平衡时,利用水银压差计测得体系内压强为 。
。
③反应结束后,调节旋塞的位置,然后E处接真空泵,经洗气瓶和干燥剂抽出氨基甲酸铵的分解产物。
(5)实验步骤③中调节旋塞位置为_______ (填“a”、“b”、“c”或“d”)。
(6)根据实验测得数据计算氨基甲酸铵固体分解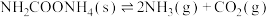 的分压平衡常数为
的分压平衡常数为_______ 。
(7)达到分解平衡时,氨基甲酸铵应有少量剩余,若实验结束时发现无固体剩余,可能会对结果产生影响,分析原因:_______ 。
 ,为白色固体,易分解,易水解,是化学工业中尿素生产过程的中间产物,也用于医药氨化剂。利用如图所示的装置制备氨基甲酸铵并测定其在室温下(25℃)分解的分压平衡常数。
,为白色固体,易分解,易水解,是化学工业中尿素生产过程的中间产物,也用于医药氨化剂。利用如图所示的装置制备氨基甲酸铵并测定其在室温下(25℃)分解的分压平衡常数。已知:
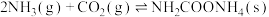
 ,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则容易发生副反应生成无机盐。
,该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则容易发生副反应生成无机盐。I.制备氨基甲酸铵,部分实验装置如图所示:
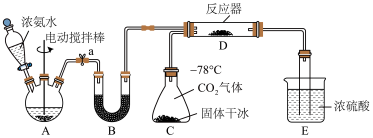
(2)装置A和B中装有相同的固体,则该固体为
(3)若缺少装置B,反应器中可能发生的副反应的化学方程式为
(4)装置E中浓硫酸的作用为
II.测定室温下(25℃)氨基甲酸铵分解的分压平衡常数:

①将氨基甲酸铵装入球泡中,调整旋塞位于d位置,调节恒温槽温度为25℃,将E处接至真空泵,打开K,降低体系内压强,利用水银压差计测得初始状态的压强为
 ,关闭K。
,关闭K。②达到分解平衡时,利用水银压差计测得体系内压强为
 。
。③反应结束后,调节旋塞的位置,然后E处接真空泵,经洗气瓶和干燥剂抽出氨基甲酸铵的分解产物。
(5)实验步骤③中调节旋塞位置为
(6)根据实验测得数据计算氨基甲酸铵固体分解
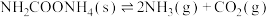 的分压平衡常数为
的分压平衡常数为(7)达到分解平衡时,氨基甲酸铵应有少量剩余,若实验结束时发现无固体剩余,可能会对结果产生影响,分析原因:
您最近半年使用:0次
解题方法
5 . 氯化铁常用于生物和矿物分析,可作为诊断试剂。某小组制备无水 并探究其性质。
并探究其性质。
实验(一)制备无水 。
。
资料显示:亚硫酰氯 沸点为
沸点为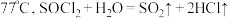 。
。
操作:将 和适量
和适量 混合共热制备无水
混合共热制备无水 ,装置如图所示。
,装置如图所示。_____ (填物质名称)。
(2)写出足量 和
和 反应的化学方程式:
反应的化学方程式:_____ 。
(3)反应完成后,取少量烧瓶中固体溶于蒸馏水中,滴加 溶液,产生蓝色沉淀,简要分析其原因:
溶液,产生蓝色沉淀,简要分析其原因:_____ 。
实验(二)测定 和
和 反应的热效应。
反应的热效应。
配制 溶液:取一定量
溶液:取一定量 固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
(4)浓盐酸的作用是_____ 。
(5)某小组设计两种方案测定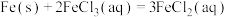
 。
。
方案1:直接法
取 溶液和
溶液和 反应,测量反应前、后溶液的温度计算反应热。
反应,测量反应前、后溶液的温度计算反应热。
方案2:间接法
分别测定
 和
和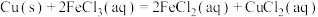
 ,利用盖斯定律计算反应热。
,利用盖斯定律计算反应热。
其中,方案_____ (填“1”或“2”)不可靠,原因是_____ 。
实验(三)探究 和
和 的反应。
的反应。
【查阅资料】 的氧化性大于
的氧化性大于 。
。
【提出假设】 和
和 的反应存在可逆性。
的反应存在可逆性。
【设计实验】如图所示。
(6)
_____ (填“>”“<”或“=”)0.上述实验说明,改变_____ 使反应向逆反应方向进行。
 并探究其性质。
并探究其性质。实验(一)制备无水
 。
。资料显示:亚硫酰氯
 沸点为
沸点为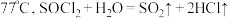 。
。操作:将
 和适量
和适量 混合共热制备无水
混合共热制备无水 ,装置如图所示。
,装置如图所示。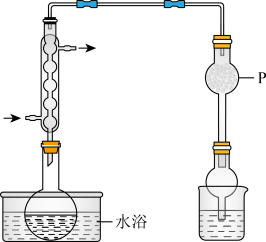
(2)写出足量
 和
和 反应的化学方程式:
反应的化学方程式:(3)反应完成后,取少量烧瓶中固体溶于蒸馏水中,滴加
 溶液,产生蓝色沉淀,简要分析其原因:
溶液,产生蓝色沉淀,简要分析其原因:实验(二)测定
 和
和 反应的热效应。
反应的热效应。配制
 溶液:取一定量
溶液:取一定量 固体溶于浓盐酸中,加蒸馏水稀释至指定体积。
固体溶于浓盐酸中,加蒸馏水稀释至指定体积。(4)浓盐酸的作用是
(5)某小组设计两种方案测定
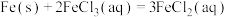
 。
。方案1:直接法
取
 溶液和
溶液和 反应,测量反应前、后溶液的温度计算反应热。
反应,测量反应前、后溶液的温度计算反应热。方案2:间接法
分别测定

 和
和
 ,利用盖斯定律计算反应热。
,利用盖斯定律计算反应热。其中,方案
实验(三)探究
 和
和 的反应。
的反应。【查阅资料】
 的氧化性大于
的氧化性大于 。
。【提出假设】
 和
和 的反应存在可逆性。
的反应存在可逆性。【设计实验】如图所示。
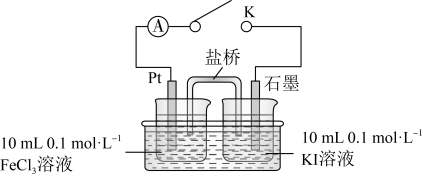
| 步骤 | 操作及现象 | 记录 |
| Ⅰ | 按装置图装好试剂,关闭 ,发现电流计指针向左偏转 ,发现电流计指针向左偏转 | 电流强度 为 为 |
| Ⅱ | 一段时间后,电流计指针慢慢回归原位 | 指针回归至原位时,电流强度 为 为 |
| Ⅲ | 再向左烧杯里加入 浓溶液,电流计指针向右偏转 浓溶液,电流计指针向右偏转 | 电流强度 为 为 |
(6)

您最近半年使用:0次
名校
解题方法
6 . 某课外活动小组在实验室制备氨气、验证氨气的某些性质。
Ⅰ.氨气的制备
(1)图中三套装置中能制备干燥NH3的装置和发生的化学方程式分别是____ 。_____ 。
(3)B中试剂为___________ ,NaOH溶液的作用是___________ 。
(4)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是___________ ,白烟的化学式是___________ 。
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为___________ 。
Ⅰ.氨气的制备
(1)图中三套装置中能制备干燥NH3的装置和发生的化学方程式分别是


(3)B中试剂为
(4)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为
您最近半年使用:0次
名校
解题方法
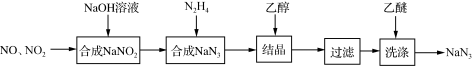
7 . 叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。___________ 。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为___________ ,1mol该阴离子中所含的电子总数为___________ mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
①该反应中的还原剂为___________ (填化学式)。
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克___________ ?(写出计算过程,保留一位小数,不考虑固体的体积)。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3
 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。①该反应中的还原剂为
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克
您最近半年使用:0次
解题方法
8 . 过氧化钙是一种温和的氧化剂,常温下为白色固体,易溶于酸,难溶于水、乙醇等溶剂。
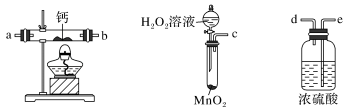
(1)某实验小组拟选用如图装置(部分固定装置略)制备过氧化钙,按气流方向连接顺序为___________ (填仪器接口的字母编号,装置可重复使用)。
实验步骤如下:
①___________ 后,装入药品;
②打开分液漏斗活塞,通入一段时间气体,加热药品;
③反应结束后,先熄灭酒精灯,待反应管冷却至室温后,停止通入气体;
④拆除装置,取出产物。
实验步骤③的操作目的是___________ 。
(2)利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH ,在碱性环境下制取CaO2·8H2O的装置如下:
,在碱性环境下制取CaO2·8H2O的装置如下:

①仪器C的名称为___________ ;反应结束后,经___________ (填操作名称)、洗涤、低温烘干可获得CaO2·8H2O。
②装置A试管中反应的化学方程式为___________ ;装置B中用冰水浴控制温度,其可能的原因是___________ 。
③化工生产中可用装置A所制气体的浓溶液检验氯气管道是否泄漏,能看到的现象是___________ 。
(1)某实验小组拟选用如图装置(部分固定装置略)制备过氧化钙,按气流方向连接顺序为

实验步骤如下:
①
②打开分液漏斗活塞,通入一段时间气体,加热药品;
③反应结束后,先熄灭酒精灯,待反应管冷却至室温后,停止通入气体;
④拆除装置,取出产物。
实验步骤③的操作目的是
(2)利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH
 ,在碱性环境下制取CaO2·8H2O的装置如下:
,在碱性环境下制取CaO2·8H2O的装置如下:
①仪器C的名称为
②装置A试管中反应的化学方程式为
③化工生产中可用装置A所制气体的浓溶液检验氯气管道是否泄漏,能看到的现象是
您最近半年使用:0次
解题方法
9 . 钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
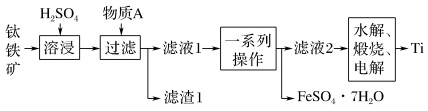
(1)溶浸过程中,为加快溶浸速率,通常可以采取的方法是___________ (写出1条即可)。物质A为___________ (填化学式)。
(2)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为___________ 。“一系列操作”为蒸发浓缩、___________ 、过滤。
(3)“水解”步骤中生成TiO2·xH2O,“水解”反应为TiO2++(x+1)H2O=TiO2·xH2O↓+2H+,为提高TiO2·xH2O的产率,可采取的措施有___________ 。(写出1条即可)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO(含O2-)为电解质,阴极制得金属Ti 。阴极的电极反应式为___________ ;若阴极制得金属Ti 9.60g,则阳极产生气体___________ mol。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,同时产生一种气体,请写出反应的离子方程式___________ 。

(1)溶浸过程中,为加快溶浸速率,通常可以采取的方法是
(2)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为
(3)“水解”步骤中生成TiO2·xH2O,“水解”反应为TiO2++(x+1)H2O=TiO2·xH2O↓+2H+,为提高TiO2·xH2O的产率,可采取的措施有
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO(含O2-)为电解质,阴极制得金属Ti 。阴极的电极反应式为
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,同时产生一种气体,请写出反应的离子方程式
您最近半年使用:0次
10 . 实验室制备乙酰乙酸乙酯(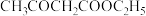 )的反应原理如下:
)的反应原理如下: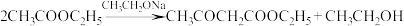 ,制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)如图所示。
,制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)如图所示。

已知:①几种物质的部分性质如表所示。
②10 乙酸乙酯粗品中含乙酸乙酯8.8g和少量乙醇。③
乙酸乙酯粗品中含乙酸乙酯8.8g和少量乙醇。③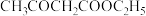 亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
回答下列问题:
(1)仪器X的名称是___________ 。仪器Z的名称是___________ ,其作用是___________ ,冷凝水从___________ (填“a”或“b”)端流进。
(2)制备反应需要加热才能发生,最适合的加热方式为___________(填序号)。
(3)仪器Y盛放碱石灰的作用是___________ 。
(4)反应结束后,滴加50%酸至混合液呈弱酸性的原因是___________ 。
(5)提纯产品时需要进行蒸馏,如图所示的装置中温度计位置正确的是___________ (填序号)。

(6)最终得到3.40g乙酰乙酸乙酯,则上述实验中乙酰乙酸乙酯的产率为___________ (保留两位有效数字)。
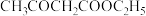 )的反应原理如下:
)的反应原理如下: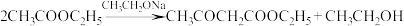 ,制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)如图所示。
,制备装置(烧瓶中物质充分反应后再滴加乙酸溶液)如图所示。
已知:①几种物质的部分性质如表所示。
| 物质 | 沸点/℃ | 相对分子质量 | 水中溶解性 |
| 乙酸乙酯 | 77.2 | 88 | 微溶 |
| 乙酰乙酸乙酯 | 181(温度超过95℃,易分解) | 130 | 微溶 |
| 乙酸 | 118 | 60 | 易溶 |
 乙酸乙酯粗品中含乙酸乙酯8.8g和少量乙醇。③
乙酸乙酯粗品中含乙酸乙酯8.8g和少量乙醇。③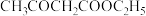 亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。
亚甲基上的H有一定的酸性,制备时部分形成乙酰乙酸乙酯的钠盐。回答下列问题:
(1)仪器X的名称是
(2)制备反应需要加热才能发生,最适合的加热方式为___________(填序号)。
| A.酒精灯直接加热 | B.水浴加热 |
| C.垫陶土网用酒精灯加热 | D.油浴加热 |
(3)仪器Y盛放碱石灰的作用是
(4)反应结束后,滴加50%酸至混合液呈弱酸性的原因是
(5)提纯产品时需要进行蒸馏,如图所示的装置中温度计位置正确的是

(6)最终得到3.40g乙酰乙酸乙酯,则上述实验中乙酰乙酸乙酯的产率为
您最近半年使用:0次



