名校
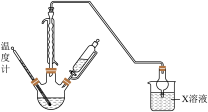
1 . 是中学重要的试剂。某小组以重晶石为原料制备氯化钡晶体。
实验(一)制备BaS并验证其气体产物(装置如图)。
主反应: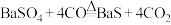
副反应:
(1)通入CO之前,先通入一段时间 ,这样操作的目的是
,这样操作的目的是_______ 。
(2)从a、b、c、d中选择合适的一组试剂:_______ (填标号)。
实验(二)制备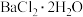 (装置如图)。
(装置如图)。_______ ,实验过程中观察到烧杯中产生黑色沉淀,写出相应的离子方程式为_______ 。
(4)实验完毕后,从 溶液中分离产品的操作是蒸发浓缩、
溶液中分离产品的操作是蒸发浓缩、_______ 、过滤、洗涤、低温干燥。
(5)实验室用11.65g (摩尔质量为233
(摩尔质量为233 )最终制得,9.76g
)最终制得,9.76g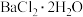 (摩尔质量为244
(摩尔质量为244 ),则该过程中Ba的损耗率为
),则该过程中Ba的损耗率为_______ 。
实验(一)制备BaS并验证其气体产物(装置如图)。

主反应:
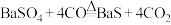
副反应:

(1)通入CO之前,先通入一段时间
 ,这样操作的目的是
,这样操作的目的是(2)从a、b、c、d中选择合适的一组试剂:
| B | C | D | E | |
| a | 品红溶液 | NaOH溶液 | 澄清石灰水 | 溴水 |
| b | 溴水 | 品红溶液 | 澄清石灰水 | 酸性高锰酸钾溶液 |
| c | 酸性高锰酸钾溶液 | 溴水 | NaOH溶液 | 品红溶液 |
| d | 品红溶液 | 溴水 | 品红溶液 | 澄清石灰水 |
实验(二)制备
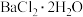 (装置如图)。
(装置如图)。
(4)实验完毕后,从
 溶液中分离产品的操作是蒸发浓缩、
溶液中分离产品的操作是蒸发浓缩、(5)实验室用11.65g
 (摩尔质量为233
(摩尔质量为233 )最终制得,9.76g
)最终制得,9.76g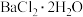 (摩尔质量为244
(摩尔质量为244 ),则该过程中Ba的损耗率为
),则该过程中Ba的损耗率为
您最近半年使用:0次
名校
解题方法
2 . 氮化硅(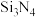 )是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是
)是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是 在潮湿的空气中易水解,产生白雾,
在潮湿的空气中易水解,产生白雾,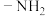 中各元素的化合价与
中各元素的化合价与 相同。
相同。
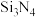 )是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是
)是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是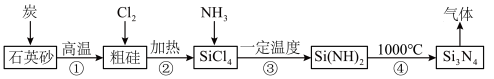
 在潮湿的空气中易水解,产生白雾,
在潮湿的空气中易水解,产生白雾,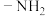 中各元素的化合价与
中各元素的化合价与 相同。
相同。A.该流程中可循环使用的物质是 |
| B.第①步反应中产生的气体能使澄清石灰水变浑浊 |
| C.图示①~④的变化中,属于氧化还原反应的是①②③ |
D.第③步反应可用氨水代替 |
您最近半年使用:0次
名校
3 . 乙苯是主要的有机化工产品。某课题组拟制备乙苯,其反应原理为: (已知:
(已知: 易升华,冷却易结块,易潮解)
易升华,冷却易结块,易潮解)
___________ 
___________ , 的作用是
的作用是___________ 。
(2)装置 为冷凝并收集
为冷凝并收集 。装置
。装置 、
、 存在的安全隐患为
存在的安全隐患为___________ 。
Ⅱ.制备乙苯
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热三颈烧瓶。
步骤3:向三颈烧瓶中加入 苯(过量)和
苯(过量)和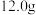 无水
无水 ,在搅拌下滴加
,在搅拌下滴加 溴乙烷,
溴乙烷,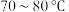 下加热
下加热 。
。
步骤4:提纯产品。
(3)本实验宜采用的加热方式为___________ ,为了证明三颈烧瓶中已发生了上述反应,烧杯中的“ 溶液”可以是
溶液”可以是___________ (填字母序号)。
A. 溶液B.石蕊试液C.品红溶液D.
溶液B.石蕊试液C.品红溶液D. 溶液
溶液
(4)提纯产品的步骤有:①用大量水洗;②用稀盐酸洗除;③少量蒸馏水水洗;④加入大量无水氯化钙;⑤___________ ;(填操作名称,下同)⑥___________ ,并收集 时的产品。
时的产品。
(5)实验中收集到 乙苯,则乙苯的产率为
乙苯,则乙苯的产率为___________ 。
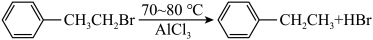
 (已知:
(已知: 易升华,冷却易结块,易潮解)
易升华,冷却易结块,易潮解)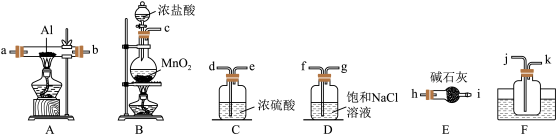


 的作用是
的作用是(2)装置
 为冷凝并收集
为冷凝并收集 。装置
。装置 、
、 存在的安全隐患为
存在的安全隐患为Ⅱ.制备乙苯
| 名称 | 分子量 | 沸点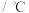 | 密度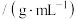 | 实验装置 |
| 苯 | 78 |  | 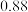 |
|
| 溴乙烷 | 109 |  |  | |
| 乙苯 | 106 | 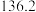 | 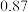 |
步骤2:用酒精灯微热三颈烧瓶。
步骤3:向三颈烧瓶中加入
 苯(过量)和
苯(过量)和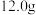 无水
无水 ,在搅拌下滴加
,在搅拌下滴加 溴乙烷,
溴乙烷,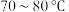 下加热
下加热 。
。步骤4:提纯产品。
(3)本实验宜采用的加热方式为
 溶液”可以是
溶液”可以是A.
 溶液B.石蕊试液C.品红溶液D.
溶液B.石蕊试液C.品红溶液D. 溶液
溶液(4)提纯产品的步骤有:①用大量水洗;②用稀盐酸洗除;③少量蒸馏水水洗;④加入大量无水氯化钙;⑤
 时的产品。
时的产品。(5)实验中收集到
 乙苯,则乙苯的产率为
乙苯,则乙苯的产率为
您最近半年使用:0次
名校
解题方法
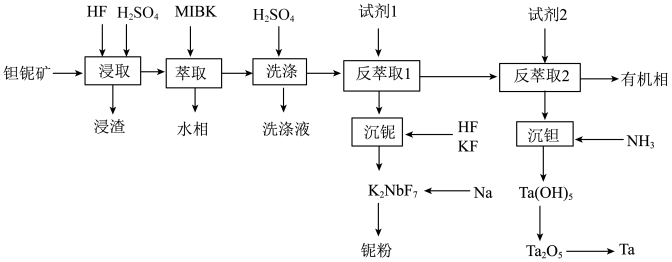
4 . 钽(Ta)和铌(Nb)的性质相似,因此常常共生于自然界的矿物中。一种以钽铌伴生矿(主要成分为SiO2、MnO2、Nb2O5、Ta2O5和少量的TiO2、FeO、CaO、MgO)为原料制取钽和铌的流程如下:
已知:①MIBK为甲基异丁基酮;
②KspCaF2=2.510-11,KspMgF2=6.410-9
(1)“浸取”时通常在_____材料的反应器中进行(填标号)。
(2)浸渣的主要成分是_____ ,Ta2O5与氢氟酸反应的离子方程式为_____ 。
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度为_____ 。
①流程中钠热还原法制备铌粉的化学方程式为_____ 。
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为_____ 。
已知:①MIBK为甲基异丁基酮;
②KspCaF2=2.510-11,KspMgF2=6.410-9
(1)“浸取”时通常在_____材料的反应器中进行(填标号)。
| A.陶瓷 | B.玻璃 | C.铅 | D.塑料 |
(2)浸渣的主要成分是
(3)“浸取”时,HF的浓度对铌、钽的浸出率的影响如下图所示,则HF的最佳浓度为

①流程中钠热还原法制备铌粉的化学方程式为
②传统的熔盐电解法采用的电解质体系通常为K2NbF7-NaCl,电解总化学反应方程式为
您最近半年使用:0次
名校
5 . 盐酸羟胺(NH2OH•HCl是一种重要的分析试剂,化学性质与铵盐相似。实验室以丁酮肟( )、盐酸为原料制备盐酸羟胺的装置如图所示(加热、夹持装置省略)。
)、盐酸为原料制备盐酸羟胺的装置如图所示(加热、夹持装置省略)。

②盐酸羟胺的熔点为152℃,丁酮肟的沸点为153℃,丁酮的沸点为79.6℃。回答下列问题:
(1)直形冷凝管的进水口为
(2)甲装置中生成盐酸羟胺和丁酮的化学反应方程式为
(3)从反应后的溶液中获取盐酸羟胺的方法为
(4)测定产品纯度。
称取mg盐酸羟胺产品,配制成100mL溶液,量取25.00mL于锥形瓶中,加入适量稀硫酸酸化,再加入过量硫酸铁溶液,发生反应:2[NH3OH]++4Fe3+=4Fe2++N2O↑+6H++H2O,充分反应后,用cmol•L-1K2Cr2O7标准溶液滴定Fe2+(滴定过程中
 转化为Cr3+,Cl-不反应),滴定达终点时消耗K2Cr2O7溶液VmL。则样品中NH2OH•HCl的质量分数为
转化为Cr3+,Cl-不反应),滴定达终点时消耗K2Cr2O7溶液VmL。则样品中NH2OH•HCl的质量分数为
您最近半年使用:0次
2024-04-13更新
|
434次组卷
|
2卷引用:山东省临沂市2024届高三一模化学试题
解题方法
6 . 某小组利用“氯气氧化法”制备溴酸钠(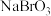 ),并测定产品纯度。
),并测定产品纯度。
Ⅰ、制备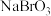
________________________________________ 。
(2)向装置Ⅲ通 前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开
前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开 、
、 ,通入
,通入 至pH传感器显示接近中性,关闭
至pH传感器显示接近中性,关闭 、
、 。装置Ⅲ中发生反应的总化学方程式为
。装置Ⅲ中发生反应的总化学方程式为________________ 。反应结束后,为避免Ⅰ中残留的 污染空气,在拆卸装置前应进行的操作是
污染空气,在拆卸装置前应进行的操作是________________________ 。
Ⅱ、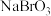 的分离提纯
的分离提纯
(3)溴酸钠和氯化钠的溶解度曲线如图所示。将装置Ⅲ中所得混合液趁热过滤,将滤液________________ 、过滤、洗涤、干燥,得到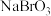 粗产品。
粗产品。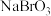 产品纯度
产品纯度
步骤1:取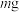 粗产品溶于蒸馏水配制成
粗产品溶于蒸馏水配制成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硫酸和过量
溶液于锥形瓶中,加入适量稀硫酸和过量 溶液,再用
溶液,再用
 ,标准溶液滴定,平均消耗
,标准溶液滴定,平均消耗 标准溶液的体积为
标准溶液的体积为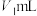 。
。
(已知 、
、 ,杂质不反应)
,杂质不反应)
步骤2:另取 蒸馏水做空白实验,消耗
蒸馏水做空白实验,消耗
 标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化
标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化 带来的影响)
带来的影响)
(4)产品纯度为________________________ (用含m,c, ,
, 的代数式表示)。
的代数式表示)。
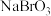 ),并测定产品纯度。
),并测定产品纯度。Ⅰ、制备
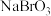
(2)向装置Ⅲ通
 前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开
前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开 、
、 ,通入
,通入 至pH传感器显示接近中性,关闭
至pH传感器显示接近中性,关闭 、
、 。装置Ⅲ中发生反应的总化学方程式为
。装置Ⅲ中发生反应的总化学方程式为 污染空气,在拆卸装置前应进行的操作是
污染空气,在拆卸装置前应进行的操作是Ⅱ、
 的分离提纯
的分离提纯(3)溴酸钠和氯化钠的溶解度曲线如图所示。将装置Ⅲ中所得混合液趁热过滤,将滤液
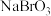 粗产品。
粗产品。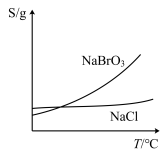
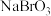 产品纯度
产品纯度步骤1:取
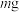 粗产品溶于蒸馏水配制成
粗产品溶于蒸馏水配制成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硫酸和过量
溶液于锥形瓶中,加入适量稀硫酸和过量 溶液,再用
溶液,再用
 ,标准溶液滴定,平均消耗
,标准溶液滴定,平均消耗 标准溶液的体积为
标准溶液的体积为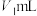 。
。(已知
 、
、 ,杂质不反应)
,杂质不反应)步骤2:另取
 蒸馏水做空白实验,消耗
蒸馏水做空白实验,消耗
 标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化
标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化 带来的影响)
带来的影响)(4)产品纯度为
 ,
, 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
7 . 乙苯是主要的化工产品。某课题组拟制备乙苯,
查阅资料如下:①几种有机物的沸点如下表:
②化学原理: +CH3CH2Br
+CH3CH2Br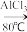
 +HBr。
+HBr。
③氯化铝易升华、易潮解。
I.制备氯化铝:甲同学选择下列装置制备氯化铝(装置不可重复使用):
(1)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当___________ 时(填实验现象)点燃F处酒精灯。
(2)气体流动方向是从左至右,装置导管接口连接顺序_________ 。
a→___________→k→i→f→g→___________
(3)D装置存在明显缺陷,若不改进,导致的实验后果是___________ 。
Ⅱ.制备乙苯
乙同学设计实验步骤如下:
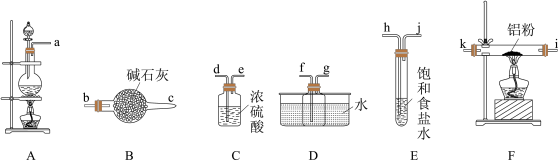
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(4)本实验加热方式宜采用___________ (填“酒精灯直接加热”或“水浴加热”)。
(5)确认本实验A中已发生了反应的试剂可以是___________。
(6)提纯产品的操作步骤有:
①过滤;②用稀盐酸洗涤;③少量蒸馏水水洗;④加入大量无水氯化钙;⑤用大量水洗;⑥蒸馏并收集136.2℃馏分;⑦分液。
操作的先后顺序为___________
⑤⑦___________⑦__________⑥(填其它代号)。
| 有机物 | 苯 | 溴乙烷 | 乙苯 |
| 沸点/℃ | 80 | 38.4 | 136.2 |
②化学原理:
 +CH3CH2Br
+CH3CH2Br
 +HBr。
+HBr。③氯化铝易升华、易潮解。
I.制备氯化铝:甲同学选择下列装置制备氯化铝(装置不可重复使用):

(1)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当
(2)气体流动方向是从左至右,装置导管接口连接顺序
a→___________→k→i→f→g→___________
(3)D装置存在明显缺陷,若不改进,导致的实验后果是
Ⅱ.制备乙苯
乙同学设计实验步骤如下:
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。

步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(4)本实验加热方式宜采用
(5)确认本实验A中已发生了反应的试剂可以是___________。
| A.硝酸银溶液 | B.石蕊试液 | C.品红溶液 | D.氢氧化钠溶液 |
(6)提纯产品的操作步骤有:
①过滤;②用稀盐酸洗涤;③少量蒸馏水水洗;④加入大量无水氯化钙;⑤用大量水洗;⑥蒸馏并收集136.2℃馏分;⑦分液。
操作的先后顺序为
⑤⑦___________⑦__________⑥(填其它代号)。
您最近半年使用:0次
名校
解题方法
8 . 回收利用废旧锂离子电池正极材料钴酸锂粗品来制备 产品,可实现资源的循环利用。其工艺流程如下。
产品,可实现资源的循环利用。其工艺流程如下。

已知:①氯化胆碱 是铵盐,熔点较低:
是铵盐,熔点较低: 熔点较高。
熔点较高。
② 在溶液中常以
在溶液中常以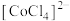 (蓝色)和
(蓝色)和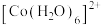 (粉红色)形式存在。
(粉红色)形式存在。
③常温下, 。
。
回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入NaCl溶液中,其目的是___________ 。
(2)“水浸”过程中溶液由蓝色逐渐变为粉红色,则“微波共熔”后获得的含Li、Co的化合物为___________ (填化学式)。“微波共熔”中氯化胆碱的作用是___________ 。
(3)“沉钴”过程发生反应的离子方程式为___________ 。常温下,钴离子恰好沉淀完全时溶液的
___________ [当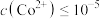 mol⋅L
mol⋅L 时可认为离子沉淀完全]。
时可认为离子沉淀完全]。
(4)“煅烧”过程生成 ,则消耗的
,则消耗的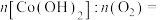
___________ 。
(5)“高温烧结”发生反应的化学方程式为___________ 。
 产品,可实现资源的循环利用。其工艺流程如下。
产品,可实现资源的循环利用。其工艺流程如下。
已知:①氯化胆碱
 是铵盐,熔点较低:
是铵盐,熔点较低: 熔点较高。
熔点较高。②
 在溶液中常以
在溶液中常以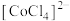 (蓝色)和
(蓝色)和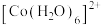 (粉红色)形式存在。
(粉红色)形式存在。③常温下,
 。
。回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入NaCl溶液中,其目的是
(2)“水浸”过程中溶液由蓝色逐渐变为粉红色,则“微波共熔”后获得的含Li、Co的化合物为
(3)“沉钴”过程发生反应的离子方程式为

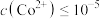 mol⋅L
mol⋅L 时可认为离子沉淀完全]。
时可认为离子沉淀完全]。(4)“煅烧”过程生成
 ,则消耗的
,则消耗的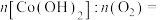
(5)“高温烧结”发生反应的化学方程式为
您最近半年使用:0次
解题方法
9 . 无水二氯化锰常用于铝合金冶炼、有机氯化物触媒制备等。某研究小组用四水醋酸锰[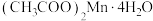 ]和乙酰氯(
]和乙酰氯(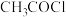 )为原料制备无水氯化锰,按如图流程和装置进行实验(夹持仪器已省略):
)为原料制备无水氯化锰,按如图流程和装置进行实验(夹持仪器已省略):
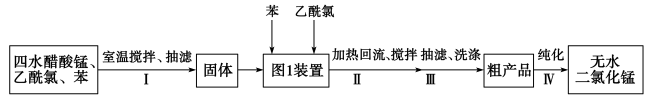

已知:①无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸,不溶于苯,沸点1190℃。乙酰氯是无色液体,沸点51℃,熔点-112℃,易水解。
②制备无水二氯化锰的主要反应: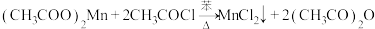
回答下列问题:
(1)图1装置中仪器a的名称为__________ ,作用是____________________ ,该装置存在缺陷,改进方法为______________________________ 。
(2)步骤Ⅰ反应化学方程式为____________________ ;步骤Ⅰ设置室温下反应,而步骤Ⅱ设置在加热回流下反应,原因是______________________________ 。
(3)步骤Ⅳ:将装有粗产品的圆底烧瓶接到纯化装置上(图2),打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化,纯化完成后的操作排序:纯化完成→关闭加热器,待烧瓶冷却至室温→__________ →将产品转至干燥器中保存(填标号)。
a.打开安全瓶上旋塞
b.拔出圆底烧瓶的瓶塞
c.关闭抽气泵
装置中U型管内NaOH固体的作用是__________ (写一条即可)。
(4)可通过沉淀法测定产品纯度,甲同学通过滴入 溶液测定生成的
溶液测定生成的 沉淀质量来计算纯度;乙同学通过滴入硝酸酸化的
沉淀质量来计算纯度;乙同学通过滴入硝酸酸化的 溶液测定生成的AgCl沉淀质量来计算纯度。方法更合理的是
溶液测定生成的AgCl沉淀质量来计算纯度。方法更合理的是__________ (填“甲同学”或“乙同学”)。
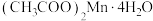 ]和乙酰氯(
]和乙酰氯(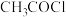 )为原料制备无水氯化锰,按如图流程和装置进行实验(夹持仪器已省略):
)为原料制备无水氯化锰,按如图流程和装置进行实验(夹持仪器已省略):

已知:①无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸,不溶于苯,沸点1190℃。乙酰氯是无色液体,沸点51℃,熔点-112℃,易水解。
②制备无水二氯化锰的主要反应:
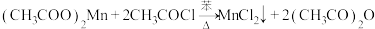
回答下列问题:
(1)图1装置中仪器a的名称为
(2)步骤Ⅰ反应化学方程式为
(3)步骤Ⅳ:将装有粗产品的圆底烧瓶接到纯化装置上(图2),打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化,纯化完成后的操作排序:纯化完成→关闭加热器,待烧瓶冷却至室温→
a.打开安全瓶上旋塞
b.拔出圆底烧瓶的瓶塞
c.关闭抽气泵
装置中U型管内NaOH固体的作用是
(4)可通过沉淀法测定产品纯度,甲同学通过滴入
 溶液测定生成的
溶液测定生成的 沉淀质量来计算纯度;乙同学通过滴入硝酸酸化的
沉淀质量来计算纯度;乙同学通过滴入硝酸酸化的 溶液测定生成的AgCl沉淀质量来计算纯度。方法更合理的是
溶液测定生成的AgCl沉淀质量来计算纯度。方法更合理的是
您最近半年使用:0次
2024-04-05更新
|
411次组卷
|
2卷引用:2024届山东省枣庄市高三下学期模拟考试(二调)化学试题
名校
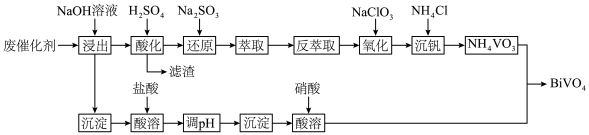
10 . 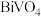 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、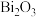 、NiO及少量
、NiO及少量 、
、 )制备
)制备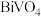 的工艺流程如下:
的工艺流程如下:
已知:Ⅰ.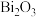 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物
Ⅱ.0.1
 溶液的pH=1.0
溶液的pH=1.0
Ⅲ.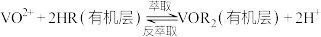
回答下列问题:
(1)滤渣的主要成分是___________ ;酸化时, 完全转化为
完全转化为 的最大pH为
的最大pH为___________ 。(已知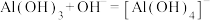
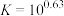 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)
(2)“酸化”后的溶液中存在 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为___________ 。
(3)反萃取剂应选用___________ (填“酸性”、“中性”或“碱性”)溶液;若“萃取”、“反萃取”的过程中钒的总回收率为90%,则“还原”时加入的 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为___________ 。
(4)生成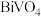 的化学方程式为
的化学方程式为___________ ,实验测得溶液pH、温度和 溶液浓度对生成
溶液浓度对生成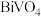 的粒径影响图像如下:
的粒径影响图像如下:
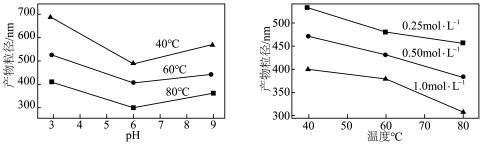
综合分析:制备粒径较小的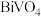 晶体的最佳条件是
晶体的最佳条件是___________ ;制备过程中需加入NaOH维持最佳pH,若 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是___________ 。
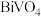 是一种光催化材料。工业利用某废催化剂(主要含
是一种光催化材料。工业利用某废催化剂(主要含 、
、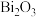 、NiO及少量
、NiO及少量 、
、 )制备
)制备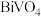 的工艺流程如下:
的工艺流程如下:
已知:Ⅰ.
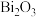 、NiO都是不溶于水的碱性氧化物
、NiO都是不溶于水的碱性氧化物Ⅱ.0.1

 溶液的pH=1.0
溶液的pH=1.0Ⅲ.
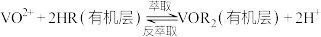
回答下列问题:
(1)滤渣的主要成分是
 完全转化为
完全转化为 的最大pH为
的最大pH为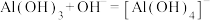
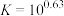 ;离子浓度≤10-5mol/L时沉淀完全)
;离子浓度≤10-5mol/L时沉淀完全)(2)“酸化”后的溶液中存在
 ,则“还原”时发生反应的离子方程式为
,则“还原”时发生反应的离子方程式为(3)反萃取剂应选用
 和“氧化”时加入的
和“氧化”时加入的 的物质的量之比为
的物质的量之比为(4)生成
 的化学方程式为
的化学方程式为 溶液浓度对生成
溶液浓度对生成 的粒径影响图像如下:
的粒径影响图像如下:
综合分析:制备粒径较小的
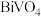 晶体的最佳条件是
晶体的最佳条件是 过量,需要增加NaOH的用量,原因是
过量,需要增加NaOH的用量,原因是
您最近半年使用:0次
2024-04-02更新
|
829次组卷
|
4卷引用:山东省烟台市2024届高三一模化学试题