名校
解题方法
1 . 利用如图的装置(省略部分加热装置)制备 (铋酸钠),已知
(铋酸钠),已知 不溶于冷水且在酸性溶液中迅速分解,
不溶于冷水且在酸性溶液中迅速分解, 是一种难溶于水的白色沉淀。下列说法正确的是
是一种难溶于水的白色沉淀。下列说法正确的是
 (铋酸钠),已知
(铋酸钠),已知 不溶于冷水且在酸性溶液中迅速分解,
不溶于冷水且在酸性溶液中迅速分解, 是一种难溶于水的白色沉淀。下列说法正确的是
是一种难溶于水的白色沉淀。下列说法正确的是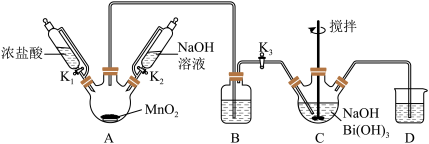
A.装置B应放入饱和 溶液,目的是吸收A中挥发的盐酸 溶液,目的是吸收A中挥发的盐酸 |
B.为使 完全转化为 完全转化为 ,反应过程中应向装置C通入过量 ,反应过程中应向装置C通入过量 |
C.拆除装置前必须进行的操作是关闭 、 、 ,打开 ,打开 |
D.上述反应中若消耗22.4L  则理论上可制得280g 则理论上可制得280g  |
您最近半年使用:0次
2 . 利用废旧锂电池可回收金属元素。已知废旧锂离子电池的主要成分为 以及
以及 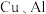 等单质,回收工艺流程如图:
等单质,回收工艺流程如图:
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
(2)“生化反应”后溶液中存在的主要阳离子有 、
、_______ 。“生化反应”最初使用的是 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为_______ ,使用细菌的优点是_______ 。
(3) 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因:_______ 。_______ 。
(5) (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 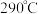 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 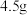 ,所得固体成分为
,所得固体成分为_______ (填化学式)。
(6)金属铜的晶胞如图所示,此晶胞的边长为 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ=_______ g∙cm-3 (用含  的代数式表示)。
的代数式表示)。
 以及
以及 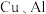 等单质,回收工艺流程如图:
等单质,回收工艺流程如图: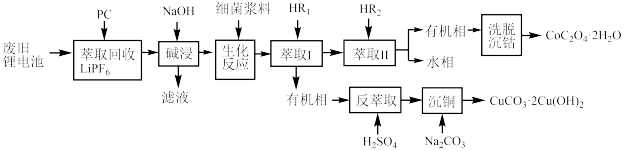
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
| A.漏斗 | B.胶头滴管 | C.分液漏斗 | D.蒸馏烧瓶 |
(2)“生化反应”后溶液中存在的主要阳离子有
 、
、 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为(3)
 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因: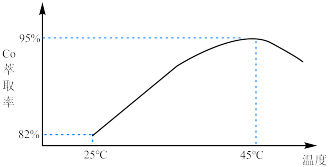
(5)
 (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 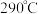 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 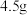 ,所得固体成分为
,所得固体成分为(6)金属铜的晶胞如图所示,此晶胞的边长为
 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ= 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
解题方法
3 . 亚硝酰氯的化学式为NOCl,主要用于合成洗涤剂、触媒,也可用作有机合成中间体。其熔点-64.5℃,沸点-5.5℃,易水解。某实验小组用以下实验来探究亚硝酰氯的制备。回答下列问题:
(1)文献中记载可利用浓盐酸和 浓溶液反应制取少量的NOCl,装置如下图所示,
浓溶液反应制取少量的NOCl,装置如下图所示,________ 。
②用仪器X代替分液漏斗的优点是________ 。
③装置B中盛放无水 的仪器名称为
的仪器名称为________ ,装置C的作用是________ 。
(2)亚硝酰氯也可以用NO与 混合制取。
混合制取。
①实验室用铜和稀硝酸反应来制备NO,标准状况下1.92gCu完全反应理论上可产生________ LNO。
②选用如下图所示的部分装置,用二氧化锰制备一瓶纯净且干燥的氯气,各玻璃导管接口连接顺序为________ →d→c→g(气流方向从左至右,每组仪器最多使用一次)。实验室用二氧化锰制备氯气的离子方程式为________ 。 制取实验过程中“先通入
制取实验过程中“先通入 ,待反应装置中充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是
,待反应装置中充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是________ 。
(1)文献中记载可利用浓盐酸和
 浓溶液反应制取少量的NOCl,装置如下图所示,
浓溶液反应制取少量的NOCl,装置如下图所示,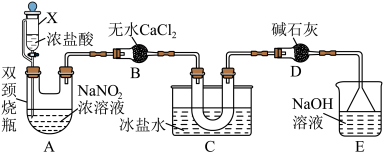
②用仪器X代替分液漏斗的优点是
③装置B中盛放无水
 的仪器名称为
的仪器名称为(2)亚硝酰氯也可以用NO与
 混合制取。
混合制取。①实验室用铜和稀硝酸反应来制备NO,标准状况下1.92gCu完全反应理论上可产生
②选用如下图所示的部分装置,用二氧化锰制备一瓶纯净且干燥的氯气,各玻璃导管接口连接顺序为
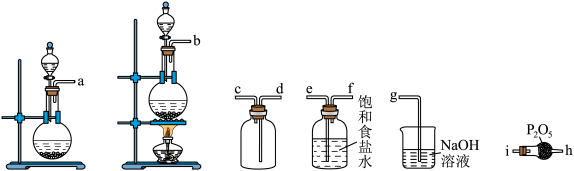
 制取实验过程中“先通入
制取实验过程中“先通入 ,待反应装置中充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是
,待反应装置中充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是
您最近半年使用:0次
名校
解题方法
4 . 三氯化铬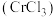 是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。 沸点为
沸点为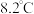 ,有毒,易水解。
,有毒,易水解。
(1)“热分解”发生反应的化学方程式为___________ 。
(2)“热反应”制无水 的实验装置如图所示(
的实验装置如图所示( 中加热装置略)。
中加热装置略)。 的目的是
的目的是___________ 。
②A中仪器X的名称是___________ ,其作用是___________ 。
③E中收集的物质含有___________ (写化学式)。
④尾气经___________ 处理后可循环使用。
(3)已知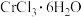 配合物
配合物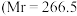 ,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取
溶于水,一定条件下结晶析出暗绿色晶体。称取 该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.
溶液,得到2. 白色沉淀。
白色沉淀。
① 中存在的化学键有
中存在的化学键有___________ (填序号)。
a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为___________ 。
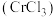 是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
 沸点为
沸点为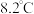 ,有毒,易水解。
,有毒,易水解。(1)“热分解”发生反应的化学方程式为
(2)“热反应”制无水
 的实验装置如图所示(
的实验装置如图所示( 中加热装置略)。
中加热装置略)。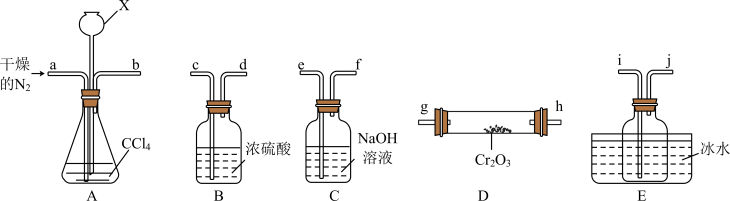
 的目的是
的目的是②A中仪器X的名称是
③E中收集的物质含有
④尾气经
(3)已知
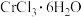 配合物
配合物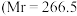 ,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取
溶于水,一定条件下结晶析出暗绿色晶体。称取 该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.
溶液,得到2. 白色沉淀。
白色沉淀。①
 中存在的化学键有
中存在的化学键有a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为
您最近半年使用:0次
5 . 三氯化铬( )在工业上广泛用作媒染剂、催化剂、电镀用铬试剂。某小组在实验室模拟工业制备
)在工业上广泛用作媒染剂、催化剂、电镀用铬试剂。某小组在实验室模拟工业制备 并测定纯度。
并测定纯度。
已知:①三氯化铬能升华,能水解,高温下能被氧气氧化。
② 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。
回答下列问题:
(1)制备
以 和
和 (沸点76.8℃)为原料,在高温下制备无水
(沸点76.8℃)为原料,在高温下制备无水 ,同时生成
,同时生成 气体。选用如下装置(加热及夹持装置略):
气体。选用如下装置(加热及夹持装置略):___________ ,装置F中长颈漏斗的作用为___________ 。
②实验装置合理的接口连接顺序为a→___________ 。
③实验前通入氮气的作用为___________ 。装置D中发生反应的化学方程式为___________ 。
(2)产品中 的纯度测定
的纯度测定
称取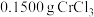 产品配成250 mL溶液,取25.00 mL样品溶液于锥形瓶中,加热至沸腾后加入稍过量
产品配成250 mL溶液,取25.00 mL样品溶液于锥形瓶中,加热至沸腾后加入稍过量 并酸化,将
并酸化,将 氧化为
氧化为 ,再次煮沸,冷却后再加入稍过量KI固体充分摇匀,使铬元素完全以
,再次煮沸,冷却后再加入稍过量KI固体充分摇匀,使铬元素完全以 形式存在。加入适量的指示剂,用
形式存在。加入适量的指示剂,用 的标准
的标准 溶液滴定至终点,平行测定三次,平均消耗标准
溶液滴定至终点,平行测定三次,平均消耗标准 溶液23.00 mL(已知
溶液23.00 mL(已知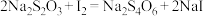 )。
)。
①滴定实验中加入的指示剂为___________ 。
②产品中 质量分数为
质量分数为___________ 。
③下列操作将导致产品中 质量分数测定值偏大的是
质量分数测定值偏大的是___________ 。(填字母标号)
A.加入KI固体量不足
B.加入稍过量 反应后未加热煮沸
反应后未加热煮沸
C.读数时滴定前平视,滴定后俯视
D.用于配制标准液的 固体部分变质
固体部分变质
 )在工业上广泛用作媒染剂、催化剂、电镀用铬试剂。某小组在实验室模拟工业制备
)在工业上广泛用作媒染剂、催化剂、电镀用铬试剂。某小组在实验室模拟工业制备 并测定纯度。
并测定纯度。已知:①三氯化铬能升华,能水解,高温下能被氧气氧化。
②
 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。回答下列问题:
(1)制备

以
 和
和 (沸点76.8℃)为原料,在高温下制备无水
(沸点76.8℃)为原料,在高温下制备无水 ,同时生成
,同时生成 气体。选用如下装置(加热及夹持装置略):
气体。选用如下装置(加热及夹持装置略):
②实验装置合理的接口连接顺序为a→
③实验前通入氮气的作用为
(2)产品中
 的纯度测定
的纯度测定称取
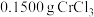 产品配成250 mL溶液,取25.00 mL样品溶液于锥形瓶中,加热至沸腾后加入稍过量
产品配成250 mL溶液,取25.00 mL样品溶液于锥形瓶中,加热至沸腾后加入稍过量 并酸化,将
并酸化,将 氧化为
氧化为 ,再次煮沸,冷却后再加入稍过量KI固体充分摇匀,使铬元素完全以
,再次煮沸,冷却后再加入稍过量KI固体充分摇匀,使铬元素完全以 形式存在。加入适量的指示剂,用
形式存在。加入适量的指示剂,用 的标准
的标准 溶液滴定至终点,平行测定三次,平均消耗标准
溶液滴定至终点,平行测定三次,平均消耗标准 溶液23.00 mL(已知
溶液23.00 mL(已知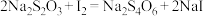 )。
)。①滴定实验中加入的指示剂为
②产品中
 质量分数为
质量分数为③下列操作将导致产品中
 质量分数测定值偏大的是
质量分数测定值偏大的是A.加入KI固体量不足
B.加入稍过量
 反应后未加热煮沸
反应后未加热煮沸C.读数时滴定前平视,滴定后俯视
D.用于配制标准液的
 固体部分变质
固体部分变质
您最近半年使用:0次
2024-04-18更新
|
301次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)
解题方法
6 . 氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色等。工业上常用辉铋矿(主要成分是 ,还含有少量
,还含有少量 、铁的氧化物等杂质)为原料制备氯氧化铋。
、铁的氧化物等杂质)为原料制备氯氧化铋。 在
在 时开始水解,
时开始水解,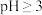 时几乎完全水解为白色的BiOCl沉淀;
时几乎完全水解为白色的BiOCl沉淀;
②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
(1)铋与氮同主族,且位于元素周期表的第六周期,基态Bi的价电子排布式为___________ 。
(2)“浸渣”的主要成分是S和___________ ,“浸取”时生成S的离子方程式为___________ 。
(3)“充分搅拌”时加入盐酸羟胺的目的是___________ 。
(4)加入碳酸钠粉末制取BiOCl时,溶液pH值需控制的合理范围为___________ ,发生反应的化学方程式为___________ 。
(5)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入 ,BiOCl被还原为Bi,则阴极的电极反应式是
,BiOCl被还原为Bi,则阴极的电极反应式是___________ 。
(6)铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 ,还含有少量
,还含有少量 、铁的氧化物等杂质)为原料制备氯氧化铋。
、铁的氧化物等杂质)为原料制备氯氧化铋。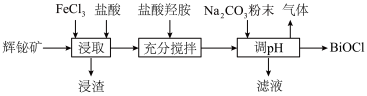
 在
在 时开始水解,
时开始水解,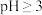 时几乎完全水解为白色的BiOCl沉淀;
时几乎完全水解为白色的BiOCl沉淀;②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
| 金属离子 |  |  |
| 开始沉淀的pH | 1.9 | 7.2 |
| 沉淀完全的pH | 2.9 | 8.2 |
(1)铋与氮同主族,且位于元素周期表的第六周期,基态Bi的价电子排布式为
(2)“浸渣”的主要成分是S和
(3)“充分搅拌”时加入盐酸羟胺的目的是
(4)加入碳酸钠粉末制取BiOCl时,溶液pH值需控制的合理范围为
(5)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入
 ,BiOCl被还原为Bi,则阴极的电极反应式是
,BiOCl被还原为Bi,则阴极的电极反应式是(6)铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。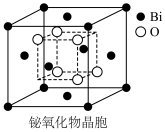
您最近半年使用:0次
2024-04-18更新
|
311次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)
解题方法
7 . 纳米氧化镁广泛应用于电子元器件、催化剂载体等领域,一种利用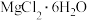 制备纳米氧化镁的工艺流程如图所示,下列说法错误的是
制备纳米氧化镁的工艺流程如图所示,下列说法错误的是 不参与化学反应.
不参与化学反应.
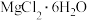 制备纳米氧化镁的工艺流程如图所示,下列说法错误的是
制备纳米氧化镁的工艺流程如图所示,下列说法错误的是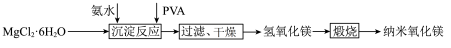
 不参与化学反应.
不参与化学反应.| A.纳米氧化镁分散在空气中能产生丁达尔效应 |
B.“煅烧”时,发生反应的化学方程式为 |
| C.“沉淀反应”时,有共价键的断裂 |
D.可以用坩埚蒸干氯化镁溶液的溶剂获得 |
您最近半年使用:0次
名校
8 . 硫代硫酸钠( )又名次亚硫酸钠、大苏打、海波,主要用于照相业作定影剂,某学习小组用如图装置制备硫代硫酸钠。
)又名次亚硫酸钠、大苏打、海波,主要用于照相业作定影剂,某学习小组用如图装置制备硫代硫酸钠。
①“绿矾”是指 ,高温受热可完全分解得红棕色固体和气体混合物;
,高温受热可完全分解得红棕色固体和气体混合物;
② 熔点-75.5℃,沸点-10℃;
熔点-75.5℃,沸点-10℃; 熔点16.8℃,沸点44.8℃
熔点16.8℃,沸点44.8℃
③硫代硫酸钠( )具有还原性,受热、遇酸易分解。
)具有还原性,受热、遇酸易分解。
请回答下列问题:
Ⅰ.制取硫代硫酸钠( )
)
(1)A装置中发生反应的化学方程式为___________________ 。
(2)检查装置气密性,加入药品。 和
和 混合溶液用煮沸过的蒸馏水配制,煮沸的目的是
混合溶液用煮沸过的蒸馏水配制,煮沸的目的是_______________ ;B装置的作用是_________________ 。
(3)从锥形瓶中得到 晶体需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是
晶体需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是_______________ 。
(4)将一定量的绿矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明:此固体产物不含二价铁:__________________ 。
Ⅱ.探究 的性质
的性质
为探究 的性质,小组将装置C换成钡盐溶液,并先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入
的性质,小组将装置C换成钡盐溶液,并先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入 流速一致。四次实验分别得到如表pH—t图:
流速一致。四次实验分别得到如表pH—t图:
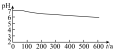
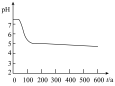
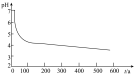
(5)分析pH—t图,写出②中发生反应的离子方程式___________________________ ,上述四次实验中有白色沉淀生成的是__________ (填编号)。
 )又名次亚硫酸钠、大苏打、海波,主要用于照相业作定影剂,某学习小组用如图装置制备硫代硫酸钠。
)又名次亚硫酸钠、大苏打、海波,主要用于照相业作定影剂,某学习小组用如图装置制备硫代硫酸钠。
①“绿矾”是指
 ,高温受热可完全分解得红棕色固体和气体混合物;
,高温受热可完全分解得红棕色固体和气体混合物;②
 熔点-75.5℃,沸点-10℃;
熔点-75.5℃,沸点-10℃; 熔点16.8℃,沸点44.8℃
熔点16.8℃,沸点44.8℃③硫代硫酸钠(
 )具有还原性,受热、遇酸易分解。
)具有还原性,受热、遇酸易分解。请回答下列问题:
Ⅰ.制取硫代硫酸钠(
 )
)(1)A装置中发生反应的化学方程式为
(2)检查装置气密性,加入药品。
 和
和 混合溶液用煮沸过的蒸馏水配制,煮沸的目的是
混合溶液用煮沸过的蒸馏水配制,煮沸的目的是(3)从锥形瓶中得到
 晶体需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是
晶体需水浴加热浓缩至液体表面出现结晶为止,使用水浴加热的原因是(4)将一定量的绿矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明:此固体产物不含二价铁:
Ⅱ.探究
 的性质
的性质为探究
 的性质,小组将装置C换成钡盐溶液,并先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入
的性质,小组将装置C换成钡盐溶液,并先后四次加入同浓度同体积不同情况的钡盐溶液,控制食用油油层厚度一致、通入 流速一致。四次实验分别得到如表pH—t图:
流速一致。四次实验分别得到如表pH—t图: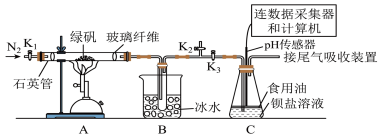
①已煮沸的 (aq) (aq) | ②未煮沸的 (aq) (aq) | ③已煮沸的 (aq) (aq) | ④未煮沸的 (aq) (aq) |
|
|
|
|
(5)分析pH—t图,写出②中发生反应的离子方程式
您最近半年使用:0次
名校
解题方法
9 . 以含钴废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示:_____________ 。“滤渣1”的化学式为___________ 。
(2)“酸浸”时 与
与 反应的化学方程式为
反应的化学方程式为__________________ 。如果用浓盐酸代替硫酸和 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是______________________ (任答一点)。
(3)“操作2”所得副产品的一种用途为_____________ 。
(4)“沉钴”时温度不能太高,原因是_____________________________ 。
(5)“沉钴”步骤中同时还会产生 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为_________________ 。
(6)实验室模拟“操作1”,需要将 转移到
转移到________ (填仪器名称)中加热分解,得到 。
。
 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示: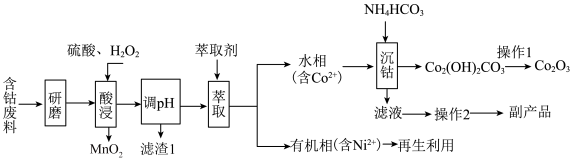
(2)“酸浸”时
 与
与 反应的化学方程式为
反应的化学方程式为 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是(3)“操作2”所得副产品的一种用途为
(4)“沉钴”时温度不能太高,原因是
(5)“沉钴”步骤中同时还会产生
 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为(6)实验室模拟“操作1”,需要将
 转移到
转移到 。
。
您最近半年使用:0次
解题方法
10 . 以废铬铁催化剂(主要成分为Cr2O3、FeO、Al2O3、MgO)为原料制备Cr(OH)3的工艺流程如图所示:
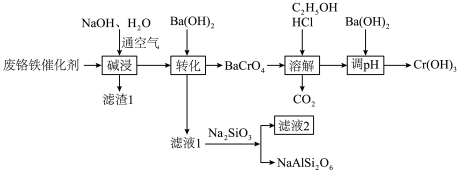
已知:Cr(OH)3与Al(OH)3类似,pH>12时发生反应Cr(OH)3+OH-= +2H2O。回答下列问题:
+2H2O。回答下列问题:
(1)基态Cr原子的价层电子的轨道表示式为_______ 。
(2)“碱浸”时加压的目的是_______ ,写出“碱浸”过程Cr2O3发生反应的化学方程式_______ 。
(3)“滤渣1”含有铁的化合物和_______ (填化学式)。
(4)“溶解”中乙醇的作用是将_______ 。
(5)常温下,Cr(OH)3的溶度积K=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。“调pH”时pH的范围是_______ 。
(6)向BaCrO4中加入Na2SO4和H2SO4混合溶液可以制备Na2Cr2O7,其中H2SO4调pH的目的是_______ (用离子方程式表示)。
(7)滤液2的主要成分是_______ ,经分离提纯后可返回_______ 工序循环利用。

已知:Cr(OH)3与Al(OH)3类似,pH>12时发生反应Cr(OH)3+OH-=
 +2H2O。回答下列问题:
+2H2O。回答下列问题:(1)基态Cr原子的价层电子的轨道表示式为
(2)“碱浸”时加压的目的是
(3)“滤渣1”含有铁的化合物和
(4)“溶解”中乙醇的作用是将
(5)常温下,Cr(OH)3的溶度积K=1.0×10-32,当c(Cr3+)降至1.0×10-5mol/L,认为Cr3+已经完全沉淀。“调pH”时pH的范围是
(6)向BaCrO4中加入Na2SO4和H2SO4混合溶液可以制备Na2Cr2O7,其中H2SO4调pH的目的是
(7)滤液2的主要成分是
您最近半年使用:0次