解题方法
1 . 碱式次氯酸镁[MgmClO(OH)n·H2O]微溶于水,不潮解,相对稳定,是一种有开发价值的无机抗菌剂,以菱镁矿(MgCO3,含少量FeCO3)为主要原料,制备碱式次氯酸镁的工艺流程如下,下列说法不正确的是
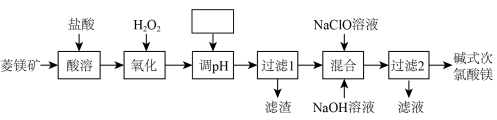
| A.流程中“酸溶”后溶液中含有Mg2+、Fe2+ |
| B.调pH时所选试剂可能是MgCO3 |
| C.“过滤1”所得的滤渣含有Fe(OH)3 |
| D.“混合”时反应的离子方程式只有Mg2++ClO-+OH-+H2O=MgClO(OH)·H2O↓ |
您最近半年使用:0次
解题方法
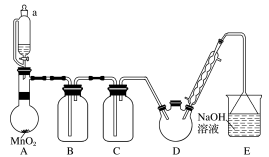
2 . 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
(1)仪器A中发生反应的化学方程式为:______ 。
(2)装置B中的试剂是______ ,若撤去装置B,可能导致装置D中副产物______ (填化学式)的量增加;装置D可采用______ 加热的方法控制反应温度在70℃左右。
(3)装置D中球形冷凝管的作用为______ 。写出E中所有可能发生的无机反应的离子方程式:______ 。
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为______ 。(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O =2I-+S4O
=2I-+S4O 。
。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是
(3)装置D中球形冷凝管的作用为
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。
您最近半年使用:0次
名校
解题方法
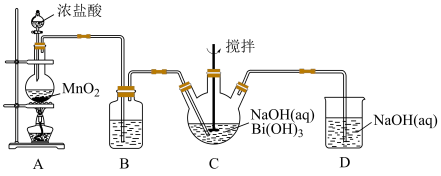
3 . 利用如图的装置制备NaBiO3(铋酸钠):
(1)A装置中反应的化学方程式:_______ 。
(2)B装置中试剂是_______ 。
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是_______ 。
(4)D装置中反应的离子方程式:_______ 。
(5)实验完毕后,为了提高产品纯度,需要的操作有_______ 、过滤、洗涤、干燥。
(6)写出装置C中发生反应的化学方程式:_______ 。
(7)探究NaBiO3的性质:
①在酸性条件下, 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是_______ 。
②结合第(3)小题C装置中的反应,分析NaBO3和Cl2氧化性强弱不一致的主要原因是_______ 。
| 物质 | NaBiO3 | Bi(OH)3 |
| 性质 | 不溶于冷水、在酸性溶液中迅速分解;浅黄色 | 难溶于水、白色 |
(2)B装置中试剂是
(3)C装置中白色固体完全反应后立即停止通入氯气,其原因是
(4)D装置中反应的离子方程式:
(5)实验完毕后,为了提高产品纯度,需要的操作有
(6)写出装置C中发生反应的化学方程式:
(7)探究NaBiO3的性质:
| 实验 | 操作 | 现象 |
| Ⅰ | 取少量NaBiO3于试管中,加入浓盐酸,振荡;用镊子夹一块湿润的淀粉KI试纸放置在试管口上方 | 浅黄色固体溶解,产生黄绿色气体,试纸变蓝色 |
| Ⅱ | 在稀硫酸酸化的MnSO4溶液中加入NaBiO3粉末,振荡 | 无色溶液变紫红色溶液 |
 、NaBiO3、Cl2中氧化性最强的是
、NaBiO3、Cl2中氧化性最强的是②结合第(3)小题C装置中的反应,分析NaBO3和Cl2氧化性强弱不一致的主要原因是
您最近半年使用:0次
4 .  可用于镀镍。某实验小组欲制备
可用于镀镍。某实验小组欲制备 ,并测定产品的化学式。
,并测定产品的化学式。
I.制备
①将镍粉用浓硝酸溶解,获得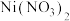 溶液;
溶液;
②向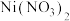 溶液中缓慢加入浓氨水,使
溶液中缓慢加入浓氨水,使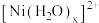 发生配体取代反应,冰水浴冷却结晶,减压过滤、用浓氨水洗涤;
发生配体取代反应,冰水浴冷却结晶,减压过滤、用浓氨水洗涤;
③向所得沉淀中加入浓盐酸,冷却后慢慢加入 的混合液,减压过滤,分别用三种洗涤剂依次洗涤、干燥,得到产品。
的混合液,减压过滤,分别用三种洗涤剂依次洗涤、干燥,得到产品。
Ⅱ.测定 的化学式
的化学式
④氯含量的测定:准确称取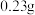 产品,用蒸馏水溶解后,加入过量强酸,用
产品,用蒸馏水溶解后,加入过量强酸,用 溶液调节
溶液调节 ,加入少量
,加入少量 作指示剂,用
作指示剂,用 标准溶液滴定,三次滴定平均消耗标准溶液
标准溶液滴定,三次滴定平均消耗标准溶液 。
。
⑤氨含量测定:准确称取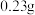 产品于锥形瓶中,加入
产品于锥形瓶中,加入 过量盐酸溶解,加入指示剂甲基红(变色
过量盐酸溶解,加入指示剂甲基红(变色 范围为4.4~6.2),三次滴定平均消耗
范围为4.4~6.2),三次滴定平均消耗 标准
标准 溶液
溶液 ;另取
;另取 上述盐酸,加入指示剂甲基红,三次滴定平均消耗0.5
上述盐酸,加入指示剂甲基红,三次滴定平均消耗0.5 标准
标准 溶液
溶液 。
。
已知: 易溶于冷水、稀氨水,不溶于浓氨水、乙醇、乙醚,在潮湿空气中易生成
易溶于冷水、稀氨水,不溶于浓氨水、乙醇、乙醚,在潮湿空气中易生成 ;乙醚的挥发性强于乙醇;
;乙醚的挥发性强于乙醇; 是一种难溶于水的砖红色晶体。
是一种难溶于水的砖红色晶体。
回答下列问题:______ (填接口标号),写出该连接装置中制备氨气的化学方程式______ 。
(2)步骤②中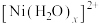 发生配体取代反应的离子方程式为
发生配体取代反应的离子方程式为______ 。
(3)步骤③所得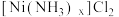 沉淀采用“减压过滤”而非“常压过滤”的原因是
沉淀采用“减压过滤”而非“常压过滤”的原因是______ ;选用的三种洗涤剂及使用顺序为______ (填标号)。
A.稀氨水 B.浓氨水 C.乙醚 D.乙醇
(4)步骤④中加入的过量强酸是______ (填“ ”或“
”或“ ”);判断滴定终点的现象是
”);判断滴定终点的现象是______ 。
(5)实验测得 的
的
______
 可用于镀镍。某实验小组欲制备
可用于镀镍。某实验小组欲制备 ,并测定产品的化学式。
,并测定产品的化学式。I.制备

①将镍粉用浓硝酸溶解,获得
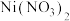 溶液;
溶液;②向
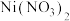 溶液中缓慢加入浓氨水,使
溶液中缓慢加入浓氨水,使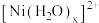 发生配体取代反应,冰水浴冷却结晶,减压过滤、用浓氨水洗涤;
发生配体取代反应,冰水浴冷却结晶,减压过滤、用浓氨水洗涤;③向所得沉淀中加入浓盐酸,冷却后慢慢加入
 的混合液,减压过滤,分别用三种洗涤剂依次洗涤、干燥,得到产品。
的混合液,减压过滤,分别用三种洗涤剂依次洗涤、干燥,得到产品。Ⅱ.测定
 的化学式
的化学式④氯含量的测定:准确称取
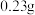 产品,用蒸馏水溶解后,加入过量强酸,用
产品,用蒸馏水溶解后,加入过量强酸,用 溶液调节
溶液调节 ,加入少量
,加入少量 作指示剂,用
作指示剂,用 标准溶液滴定,三次滴定平均消耗标准溶液
标准溶液滴定,三次滴定平均消耗标准溶液 。
。⑤氨含量测定:准确称取
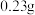 产品于锥形瓶中,加入
产品于锥形瓶中,加入 过量盐酸溶解,加入指示剂甲基红(变色
过量盐酸溶解,加入指示剂甲基红(变色 范围为4.4~6.2),三次滴定平均消耗
范围为4.4~6.2),三次滴定平均消耗 标准
标准 溶液
溶液 ;另取
;另取 上述盐酸,加入指示剂甲基红,三次滴定平均消耗0.5
上述盐酸,加入指示剂甲基红,三次滴定平均消耗0.5 标准
标准 溶液
溶液 。
。已知:
 易溶于冷水、稀氨水,不溶于浓氨水、乙醇、乙醚,在潮湿空气中易生成
易溶于冷水、稀氨水,不溶于浓氨水、乙醇、乙醚,在潮湿空气中易生成 ;乙醚的挥发性强于乙醇;
;乙醚的挥发性强于乙醇; 是一种难溶于水的砖红色晶体。
是一种难溶于水的砖红色晶体。回答下列问题:
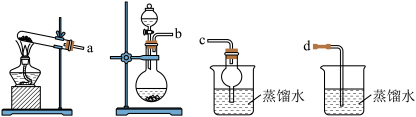
(2)步骤②中
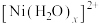 发生配体取代反应的离子方程式为
发生配体取代反应的离子方程式为(3)步骤③所得
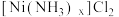 沉淀采用“减压过滤”而非“常压过滤”的原因是
沉淀采用“减压过滤”而非“常压过滤”的原因是A.稀氨水 B.浓氨水 C.乙醚 D.乙醇
(4)步骤④中加入的过量强酸是
 ”或“
”或“ ”);判断滴定终点的现象是
”);判断滴定终点的现象是(5)实验测得
 的
的
您最近半年使用:0次
名校
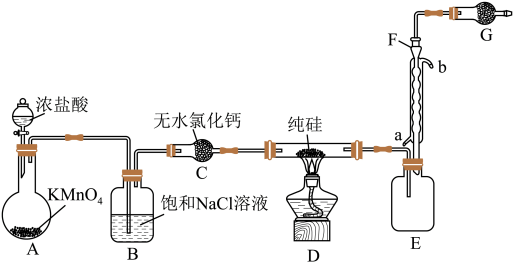
5 . 2023年9月华为推出了举世瞩目的“中国芯”——麒麟芯。“中国芯”的发展离不开单晶硅,四氯化硅是制备高纯硅的原料。某小组拟在实验室用下列装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
① ,
,
② 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。
③电负性Cl>H>Si, 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
请回答下列问题:
(1)写出A中发生反应的离子方程式:______ 。
(2)装置B的作用是______ 。
(3)仪器F的名称是______ ,冷却水应从______ (填“a”或“b”)口通入。
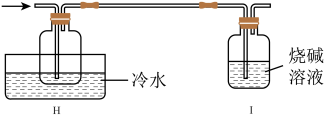
(4)有同学设计如图装置H、I替代上述E、G装置;______ 。
(5)测定产品纯度。取mg 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为______ %(用含m、c和V的代数式表示)。若产品中溶有少量 ,则测定结果
,则测定结果______ (填“偏高”、“偏低”或“无影响”)
(6) 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为______ 。
①
 ,
,
②
 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。③电负性Cl>H>Si,
 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。请回答下列问题:
(1)写出A中发生反应的离子方程式:
(2)装置B的作用是
(3)仪器F的名称是
(4)有同学设计如图装置H、I替代上述E、G装置;
(5)测定产品纯度。取mg
 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为 ,则测定结果
,则测定结果(6)
 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
您最近半年使用:0次
2024-04-19更新
|
162次组卷
|
2卷引用:云南省曲靖市第二中学学联体2024届高三第一次联考理综-化学试卷
解题方法
6 . 呋喃甲酸(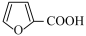 )是一种重要的有机合成中间体。实验室用呋喃甲醛(
)是一种重要的有机合成中间体。实验室用呋喃甲醛(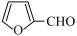 )制备呋喃甲酸,并获得副产品呋喃甲醇。
)制备呋喃甲酸,并获得副产品呋喃甲醇。
I.反应原理: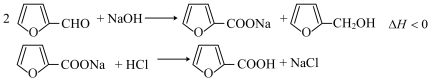
Ⅱ.实验装置: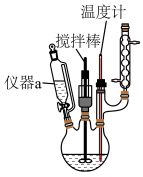
| 物质 | 相对分子质量 | 状态 | 熔点 | 沸点 | 溶解性 |
| 呋喃甲醛 | 96 | 油状液体 | 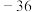 | 161.7 | 微溶于冷水,溶于热水、乙醇、乙醚 |
| 呋喃甲酸 | 112 | 白色晶体 | 130 | 易升华 | 难溶于冷水,易溶于乙醇、乙醚 |
| 呋喃甲醇 | 98 | 液体 |  | 171 | 溶于水,乙醇、乙醚 |
①向三颈烧瓶中加入
 呋喃甲醛,滴加
呋喃甲醛,滴加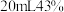 的
的 溶液,充分搅拌,保持反应温度在
溶液,充分搅拌,保持反应温度在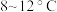 ,持续回流
,持续回流 。
。②冷却后,向三颈烧瓶中加入适量水使其完全溶解。
③将溶液转入分液漏斗中,少量多次加入乙醚萃取,合并乙醚萃取液,得到有机相(乙醚萃取液)和水相。
④向有机相中加入无水硫酸镁固体,再进一步分离乙醚和呋喃甲醇。
⑤向水相中滴加浓盐酸,冷却,结晶,抽滤,洗涤得到粗品
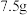 。
。回答下列问题:
(1)仪器a的名称为
A.
 B.
B. C.
C. D.
D.
(2)步骤①中反应温度保持在
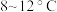 ,温度不宜过低的原因是
,温度不宜过低的原因是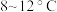 ,应采取的措施为
,应采取的措施为(3)步骤③中少量多次加入乙醚的目的是
(4)步骤④中加入硫酸镁固体的作用是
(5)纯度测定:称取
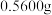 粗产品,配成
粗产品,配成 溶液。量取
溶液。量取 溶液,用
溶液,用 的
的 标准溶液滴定,三次滴定平均消耗
标准溶液滴定,三次滴定平均消耗 的
的 标准溶液。该产品中呋喃甲酸的纯度为
标准溶液。该产品中呋喃甲酸的纯度为
您最近半年使用:0次
名校
7 . 盐酸羟胺(NH2OH•HCl是一种重要的分析试剂,化学性质与铵盐相似。实验室以丁酮肟( )、盐酸为原料制备盐酸羟胺的装置如图所示(加热、夹持装置省略)。
)、盐酸为原料制备盐酸羟胺的装置如图所示(加热、夹持装置省略)。

②盐酸羟胺的熔点为152℃,丁酮肟的沸点为153℃,丁酮的沸点为79.6℃。回答下列问题:
(1)直形冷凝管的进水口为
(2)甲装置中生成盐酸羟胺和丁酮的化学反应方程式为
(3)从反应后的溶液中获取盐酸羟胺的方法为
(4)测定产品纯度。
称取mg盐酸羟胺产品,配制成100mL溶液,量取25.00mL于锥形瓶中,加入适量稀硫酸酸化,再加入过量硫酸铁溶液,发生反应:2[NH3OH]++4Fe3+=4Fe2++N2O↑+6H++H2O,充分反应后,用cmol•L-1K2Cr2O7标准溶液滴定Fe2+(滴定过程中
 转化为Cr3+,Cl-不反应),滴定达终点时消耗K2Cr2O7溶液VmL。则样品中NH2OH•HCl的质量分数为
转化为Cr3+,Cl-不反应),滴定达终点时消耗K2Cr2O7溶液VmL。则样品中NH2OH•HCl的质量分数为
您最近半年使用:0次
2024-04-13更新
|
434次组卷
|
2卷引用:云南省昆明市第三中学2023-2024学年高二下学期4月第二次综合测试化学试题
名校
解题方法
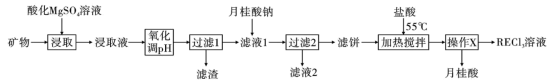
8 . 稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如图所示: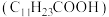 熔点为
熔点为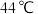 ;月桂酸和
;月桂酸和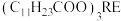 均难溶于水。该工艺条件下,稀土离子保持+3价不变;
均难溶于水。该工艺条件下,稀土离子保持+3价不变;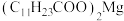 的
的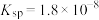 ,
, 开始溶解时的
开始溶解时的 为8.8;有关金属离子沉淀的相关
为8.8;有关金属离子沉淀的相关 见下表。
见下表。
(1)“氧化调 ”中,化合价有变化的金属离子是
”中,化合价有变化的金属离子是___________ 。
(2)“过滤1”前,用 溶液调
溶液调 至
至___________ 的范围内,该过程中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)“过滤2”后,滤饼中检测不到 元素,滤液2中
元素,滤液2中 浓度为
浓度为 。为尽可能多地提取
。为尽可能多地提取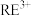 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中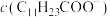 低于
低于___________ 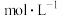 。
。
(4)“操作 ”的过程为先
”的过程为先___________ ,再固液分离。
(5)该工艺中,可再生循环利用的物质有___________ (写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂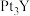 。
。
①还原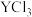 和
和 熔融盐制备
熔融盐制备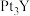 时,生成
时,生成 转移
转移___________ mol电子。
②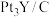 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为
的还原,发生的电极反应为___________ 。
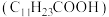 熔点为
熔点为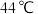 ;月桂酸和
;月桂酸和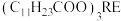 均难溶于水。该工艺条件下,稀土离子保持+3价不变;
均难溶于水。该工艺条件下,稀土离子保持+3价不变;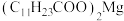 的
的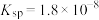 ,
, 开始溶解时的
开始溶解时的 为8.8;有关金属离子沉淀的相关
为8.8;有关金属离子沉淀的相关 见下表。
见下表。| 离子 |  |  |  | 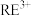 |
开始沉淀时的 | 8.8 | 1.5 | 3.6 |  |
沉淀完全时的 | 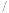 | 3.2 | 4.7 | 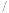 |
 ”中,化合价有变化的金属离子是
”中,化合价有变化的金属离子是(2)“过滤1”前,用
 溶液调
溶液调 至
至 发生反应的离子方程式为
发生反应的离子方程式为(3)“过滤2”后,滤饼中检测不到
 元素,滤液2中
元素,滤液2中 浓度为
浓度为 。为尽可能多地提取
。为尽可能多地提取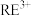 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中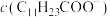 低于
低于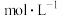 。
。(4)“操作
 ”的过程为先
”的过程为先(5)该工艺中,可再生循环利用的物质有
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂
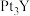 。
。①还原
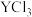 和
和 熔融盐制备
熔融盐制备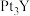 时,生成
时,生成 转移
转移②
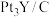 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为
的还原,发生的电极反应为
您最近半年使用:0次
解题方法
9 . 氧化铋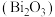 是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分
是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:

已知:① 不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有
不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有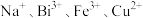 等。
等。
②盐酸羟胺常用作还原剂。
③ 在
在 时开始水解,
时开始水解,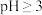 时
时 几乎完全水解为白色的
几乎完全水解为白色的 沉淀。
沉淀。
④常温下部分阳离子以氢氧化物形式沉淀时溶液的 见下表:
见下表:
回答下列问题:
(1) 与
与 同主族,
同主族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为____________ 形。
(2)“滤渣1”的主要成分有 、
、____________ ,工业上以纯碱、石灰石、____________ (填化学式)为原料生产普通玻璃。
(3)写出“酸浸”步骤中 发生氧化还原反应的离子方程式:
发生氧化还原反应的离子方程式:____________ 。
(4)“转化”步骤中加入盐酸羟胺 的目的是
的目的是____________ 。“调 ”步骤中加入
”步骤中加入 调节溶液的
调节溶液的 ,其合理范围为
,其合理范围为____________ 。
(5)“滤液2”中主要的金属阳离子有____________ (填离子符号);流程中生成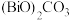 的化学方程式为
的化学方程式为____________ 。
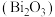 是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分
是一种淡黄色、低毒的氧化物俗称铋黄,广泛应用于医药合成、能源材料等领域,也是制作防火纸的材料之一。以铋精矿(主要成分 ,还含有
,还含有 、
、 等杂质)为原料制备
等杂质)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
已知:①
 不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有
不溶于稀盐酸,“酸浸”后溶液中金属阳离子主要有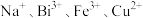 等。
等。②盐酸羟胺常用作还原剂。
③
 在
在 时开始水解,
时开始水解,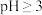 时
时 几乎完全水解为白色的
几乎完全水解为白色的 沉淀。
沉淀。④常温下部分阳离子以氢氧化物形式沉淀时溶液的
 见下表:
见下表:| 金属离子 |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.7 |
| 完全沉淀 | 3.7 | 9.6 | 6.7 |
(1)
 与
与 同主族,
同主族, 原子处于基态时电子占据最高能级的电子云轮廓图为
原子处于基态时电子占据最高能级的电子云轮廓图为(2)“滤渣1”的主要成分有
 、
、(3)写出“酸浸”步骤中
 发生氧化还原反应的离子方程式:
发生氧化还原反应的离子方程式:(4)“转化”步骤中加入盐酸羟胺
 的目的是
的目的是 ”步骤中加入
”步骤中加入 调节溶液的
调节溶液的 ,其合理范围为
,其合理范围为(5)“滤液2”中主要的金属阳离子有
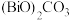 的化学方程式为
的化学方程式为
您最近半年使用:0次
2024-04-02更新
|
241次组卷
|
2卷引用:2024届云南省楚雄彝族自治州高三下学期二模理综试题-高中化学
10 . 8-羟基喹啉可用于植物营养液的配制。实验室制备8-羟基喹啉的反应原理如下:

相关信息列表如下:
已知:水蒸气蒸馏是分离提纯有机物的重要方法之一,可使难溶或微溶于水的物质在温度低于100℃下随水蒸气一起出来,从而达到分离提纯的目的。
实验步骤如下:
I.在圆底烧瓶中依次加入0.2mol甘油、0.03mol邻硝基苯酚、0.05mol邻氨基苯酚,混合均匀后缓慢加入浓硫酸,间歇加热并保持溶液微沸1.5h。
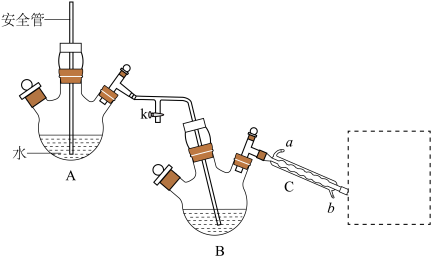
Ⅱ.稍冷后,将上述反应得到的混合液倒入下图所示装置的三颈烧瓶B中,进行水蒸气蒸馏,除去剩余的邻硝基苯酚。(加热及夹持装置已略去)
Ⅲ.待三颈烧瓶B内液体冷却后,依次用 、
、 调节溶液
调节溶液 为7~8,再进行水蒸气蒸馏,得到大量含8-羟基喹啉的粗品。
为7~8,再进行水蒸气蒸馏,得到大量含8-羟基喹啉的粗品。
Ⅳ.用80%的乙醇分离提纯粗品,最终得到5g白色晶体。
回答下列问题:
(1)步骤I不采用持续加热的原因是___________ (写出一条即可)。
(2)仪器C的名称是___________ ,冷却水应从___________ (填“a”或“b”)口通入。
(3)若观察到安全管中液面上升,除暂停加热外,还可采取的措施是___________ 。
(4)步骤Ⅲ中加碱调节时, 过高可能会导致产率降低的原因是
过高可能会导致产率降低的原因是___________ 。
(5)步骤Ⅳ中从粗品获得8-羟基喹啉晶体所用方法的名称为___________ 。
(6)图中虚线框内合适的装置可以为___________ (填序号)。
(7)本实验的产率最接近___________(填序号)。

相关信息列表如下:
| 物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 水 | 乙醇 | ||||
| 丙三醇(甘油) | 92 | 17.4 | 290 | 易溶 | 易溶 |
| 邻氨基苯酚 | 109 | 177 | (易升华) | 微溶 | 微溶 |
| 邻硝基苯酚 | 139 | 43~45 | 214~216 | 微溶 | 易溶 |
| 8-羟基喹啉 | 145 | 70~73 | 267 | 不溶 | 易溶 |
实验步骤如下:
I.在圆底烧瓶中依次加入0.2mol甘油、0.03mol邻硝基苯酚、0.05mol邻氨基苯酚,混合均匀后缓慢加入浓硫酸,间歇加热并保持溶液微沸1.5h。
Ⅱ.稍冷后,将上述反应得到的混合液倒入下图所示装置的三颈烧瓶B中,进行水蒸气蒸馏,除去剩余的邻硝基苯酚。(加热及夹持装置已略去)

Ⅲ.待三颈烧瓶B内液体冷却后,依次用
 、
、 调节溶液
调节溶液 为7~8,再进行水蒸气蒸馏,得到大量含8-羟基喹啉的粗品。
为7~8,再进行水蒸气蒸馏,得到大量含8-羟基喹啉的粗品。Ⅳ.用80%的乙醇分离提纯粗品,最终得到5g白色晶体。
回答下列问题:
(1)步骤I不采用持续加热的原因是
(2)仪器C的名称是
(3)若观察到安全管中液面上升,除暂停加热外,还可采取的措施是
(4)步骤Ⅲ中加碱调节时,
 过高可能会导致产率降低的原因是
过高可能会导致产率降低的原因是(5)步骤Ⅳ中从粗品获得8-羟基喹啉晶体所用方法的名称为
(6)图中虚线框内合适的装置可以为
(7)本实验的产率最接近___________(填序号)。
| A.60% | B.55% | C.50% | D.46% |
您最近半年使用:0次



