1 . 碲(Te)是半导体、红外探测等领域的重要战略元素。从阳极泥或冶炼烟尘中提取的粗二氧化碲中含有 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
(1)“浸出”步骤中,碲和硒两种元素分别转化为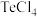 和
和 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是___________ 。
(2)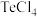 的沸点(387℃)高于
的沸点(387℃)高于 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是___________ 。
(3)“净化”步骤中产生的滤渣主要含___________ (写化学式)和少量硒单质。
(4)化学反应的吉布斯自由能变 。
。 还原
还原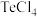 和
和 的
的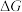 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过___________ K,该步骤控制在此温度以下的原因是___________ 。___________ 。
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是___________ (填标号)。
A.铁粉 B.氢气 C.硫化钠
 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。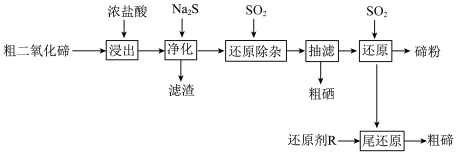
(1)“浸出”步骤中,碲和硒两种元素分别转化为
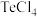 和
和 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是(2)
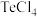 的沸点(387℃)高于
的沸点(387℃)高于 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是(3)“净化”步骤中产生的滤渣主要含
(4)化学反应的吉布斯自由能变
 。
。 还原
还原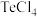 和
和 的
的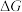 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是
A.铁粉 B.氢气 C.硫化钠
您最近半年使用:0次
昨日更新
|
184次组卷
|
2卷引用:河南省周口市2024届高三二模理综-化学试题
解题方法
2 . 某化学兴趣小组对钠和钠的化合物进行了一系列的实验探究,请回答下列问题。
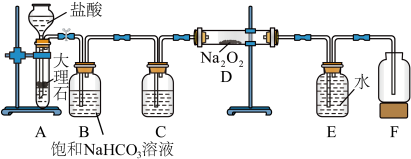
实验Ⅰ:探究二氧化碳与过氧化钠的反应是否有氧气生成,设计了如图所示的实验装置。_______ ,作用是_______ 。
(2)指出装置 中的错误之处:
中的错误之处:_______ 。
(3)取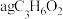 在氧气中完全燃烧,将其产物与足量
在氧气中完全燃烧,将其产物与足量 固体完全反应,反应后固体质量的增加量
固体完全反应,反应后固体质量的增加量_______ (填“大于”“等于”或“小于”) 。
。
实验Ⅱ:利用如图所示装置(省略夹持装置)模拟工业级 的制备。
的制备。 。
。
(4)装置 中盛放的药品为
中盛放的药品为_______ 。
(5)实验中使用油浴加热而不使用水浴加热的原因是_______ 。
(6)氨气与熔融钠反应生成 的化学方程式为
的化学方程式为_______ 。
实验Ⅰ:探究二氧化碳与过氧化钠的反应是否有氧气生成,设计了如图所示的实验装置。
(2)指出装置
 中的错误之处:
中的错误之处:(3)取
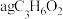 在氧气中完全燃烧,将其产物与足量
在氧气中完全燃烧,将其产物与足量 固体完全反应,反应后固体质量的增加量
固体完全反应,反应后固体质量的增加量 。
。实验Ⅱ:利用如图所示装置(省略夹持装置)模拟工业级
 的制备。
的制备。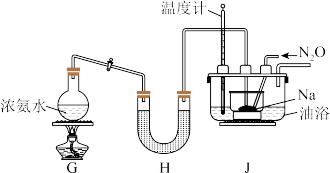
 。
。(4)装置
 中盛放的药品为
中盛放的药品为(5)实验中使用油浴加热而不使用水浴加热的原因是
(6)氨气与熔融钠反应生成
 的化学方程式为
的化学方程式为
您最近半年使用:0次
名校
解题方法
3 . 过二硫酸钠(Na2S2O8)是白色晶状粉末,易溶于水,不溶于乙醇,加热至65℃就会发生分解,常用作漂白剂,金属表面处理剂等。实验室以过氧化氢、浓硫酸和碳酸钠为原料制备过二硫酸钠。
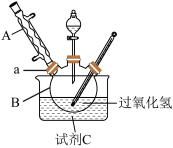
I.过一硫酸(H2SO5)的合成
原理:H2O2+H2SO4=H2SO5+H2O。________ 。
(2)水槽中盛放的试剂C是________ (填“冰水”或“热水”)。
Ⅱ.过二硫酸钠(Na2S2O8)的合成
取下球形冷凝管A,在适当搅拌的条件下,沿瓶口a向仪器B中加入一定量的无水碳酸钠,控制加入速度,并控制反应温度在60℃左右,待碳酸钠完全溶解后继续恒温搅拌20min使之反应完全,这个过程中瓶口a不能封闭。
(3)合成反应分两步完成:________ ,2Na2SO4+H2SO5=2Na2S2O8+H2O。
(4)反应完毕,将仪器B中的溶液减压浓缩;结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是_________________ 。
(5)1mol Na2S2O8中存在的-O-O-数目为________ 。
(6)Na2S2O8具有强氧化性,可将I-氧化为I2: +2I-=2
+2I-=2 +I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:
+I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:_____________ 、__________ 。
(7)取适量过二硫酸钠,装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。取硬质玻璃管少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中发生反应的化学方程式:____________ 。
I.过一硫酸(H2SO5)的合成
原理:H2O2+H2SO4=H2SO5+H2O。
(2)水槽中盛放的试剂C是
Ⅱ.过二硫酸钠(Na2S2O8)的合成
取下球形冷凝管A,在适当搅拌的条件下,沿瓶口a向仪器B中加入一定量的无水碳酸钠,控制加入速度,并控制反应温度在60℃左右,待碳酸钠完全溶解后继续恒温搅拌20min使之反应完全,这个过程中瓶口a不能封闭。
(3)合成反应分两步完成:
(4)反应完毕,将仪器B中的溶液减压浓缩;结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是
(5)1mol Na2S2O8中存在的-O-O-数目为
(6)Na2S2O8具有强氧化性,可将I-氧化为I2:
 +2I-=2
+2I-=2 +I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:
+I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:(7)取适量过二硫酸钠,装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。取硬质玻璃管少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中发生反应的化学方程式:

您最近半年使用:0次
名校
4 . 三氯化铬主要用作媒染剂及催化剂,在高温下能被氧气氧化。
I.实验室以重铬酸铵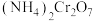 为原料合成三氯化铬
为原料合成三氯化铬
步骤1.加热使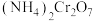 晶体分解为
晶体分解为 。
。
步骤2.取2.5 g干燥的 置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL
置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL ,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的
,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的 ,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。
,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。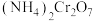 加热分解的化学方程式:
加热分解的化学方程式:___________ 。
(2)制备 时,反应管中生成
时,反应管中生成 的同时还生成有毒的、易水解的
的同时还生成有毒的、易水解的 。可用NaOH溶液吸收
。可用NaOH溶液吸收 ,其离子方程式为
,其离子方程式为___________ 。
(3)向A中通入 的作用为
的作用为___________ 、___________ 。其流速不能太快的原因是___________ 。
II.样品中三氯化铬质量分数的测定
称取样品0.3000 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g ,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
 至溶液呈强酸性,此时铬以
至溶液呈强酸性,此时铬以 存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以
存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以 存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L
存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L 标准
标准 溶液滴定至终点,平行测定三次,平均消耗标准
溶液滴定至终点,平行测定三次,平均消耗标准 溶液21.00 mL。已知:
溶液21.00 mL。已知: 。
。
(4)下列说法正确的是___________ (填字母)。
A.该实验可选用的指示剂为淀粉溶液,滴定终点的现象是溶液由蓝色变为无色,且半分钟内不恢复蓝色
B.若实验过程中未充分加热煮沸,则测定结果偏低
C.加入KI时,发生反应的氧化剂与还原剂的物质的量之比为1∶6
(5)样品中无水三氯化铬的质量分数为___________ (保留三位有效数字)。
I.实验室以重铬酸铵
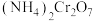 为原料合成三氯化铬
为原料合成三氯化铬步骤1.加热使
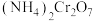 晶体分解为
晶体分解为 。
。步骤2.取2.5 g干燥的
 置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL
置于小瓷舟中(装置如下),将小瓷舟置于石英管内并使它们正好位于管式炉的中部。在锥形瓶中加入50∼60 mL ,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的
,然后将锥形瓶置于水浴中,并维持水浴温度60∼65℃,同时加热管式炉。当管式炉温度升至500℃左右时,开始通入适当流速的 ,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。
,当管式炉加热至700℃时,停止升温,保温2小时。然后关闭管式炉电源,撤去锥形瓶下水浴,在氮气气氛中冷却。
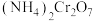 加热分解的化学方程式:
加热分解的化学方程式:(2)制备
 时,反应管中生成
时,反应管中生成 的同时还生成有毒的、易水解的
的同时还生成有毒的、易水解的 。可用NaOH溶液吸收
。可用NaOH溶液吸收 ,其离子方程式为
,其离子方程式为(3)向A中通入
 的作用为
的作用为II.样品中三氯化铬质量分数的测定
称取样品0.3000 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g
 ,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
,充分加热煮沸,适当稀释,然后加入过量2 mol⋅L
 至溶液呈强酸性,此时铬以
至溶液呈强酸性,此时铬以 存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以
存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以 存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L
存在,于暗处静置5 min后,加入适量指示剂,用0.0250 mol⋅L 标准
标准 溶液滴定至终点,平行测定三次,平均消耗标准
溶液滴定至终点,平行测定三次,平均消耗标准 溶液21.00 mL。已知:
溶液21.00 mL。已知: 。
。(4)下列说法正确的是
A.该实验可选用的指示剂为淀粉溶液,滴定终点的现象是溶液由蓝色变为无色,且半分钟内不恢复蓝色
B.若实验过程中未充分加热煮沸,则测定结果偏低
C.加入KI时,发生反应的氧化剂与还原剂的物质的量之比为1∶6
(5)样品中无水三氯化铬的质量分数为
您最近半年使用:0次
解题方法
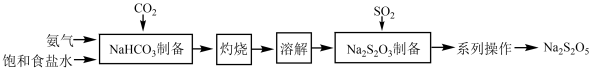
5 . 焦亚硫酸钠(Na2S2O5)在化学工业中用途广泛。其一种制备流程如下:
(1)SO2分子的VSEPR模型为___________ 。
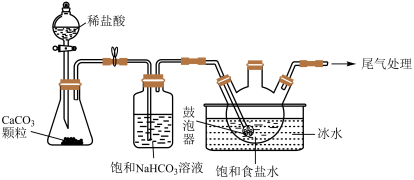
(2)“NaHCO3制备”所用实验装置(夹持仪器已省略)如下图:___________ 。
②饱和碳酸氢钠溶液的作用是___________ 。
③三颈烧瓶中生成NaHCO3反应的化学方程式为___________ (NaHCO3为沉淀物)。
(3)“Na2S2O5制备”反应过程分四步:
步骤I.在碳酸钠溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
步骤Ⅱ.停止通SO2,向NaHSO3溶液中再加入Na2CO3溶液调至pH为7~8,转化为Na2SO3;
步骤Ⅲ.继续通入SO2至pH达4.1,又生成NaHSO3溶液;
步骤Ⅳ.当溶液中NaHSO3含量达到过饱和浓度时析出Na2S2O5。
①步骤I测量溶液的pH=4.1所用仪器是___________ 。
②写出步骤Ⅱ中反应的离子方程式:___________ 。
③写出I~Ⅳ步骤中总反应的化学方程式:___________ 。
(1)SO2分子的VSEPR模型为
(2)“NaHCO3制备”所用实验装置(夹持仪器已省略)如下图:
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成NaHCO3反应的化学方程式为
(3)“Na2S2O5制备”反应过程分四步:
步骤I.在碳酸钠溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
步骤Ⅱ.停止通SO2,向NaHSO3溶液中再加入Na2CO3溶液调至pH为7~8,转化为Na2SO3;
步骤Ⅲ.继续通入SO2至pH达4.1,又生成NaHSO3溶液;
步骤Ⅳ.当溶液中NaHSO3含量达到过饱和浓度时析出Na2S2O5。
①步骤I测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出I~Ⅳ步骤中总反应的化学方程式:
您最近半年使用:0次
名校
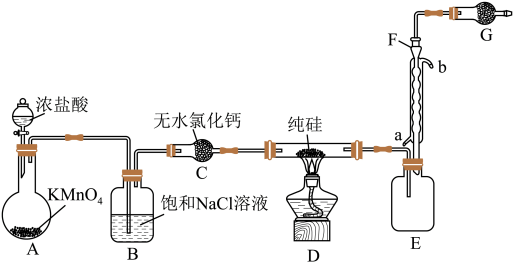
6 . 2023年9月华为推出了举世瞩目的“中国芯”——麒麟芯。“中国芯”的发展离不开单晶硅,四氯化硅是制备高纯硅的原料。某小组拟在实验室用下列装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
① ,
,
② 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。
③电负性Cl>H>Si, 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
请回答下列问题:
(1)写出A中发生反应的离子方程式:______ 。
(2)装置B的作用是______ 。
(3)仪器F的名称是______ ,冷却水应从______ (填“a”或“b”)口通入。
(4)有同学设计如图装置H、I替代上述E、G装置;______ 。
(5)测定产品纯度。取mg 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为______ %(用含m、c和V的代数式表示)。若产品中溶有少量 ,则测定结果
,则测定结果______ (填“偏高”、“偏低”或“无影响”)
(6) 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为______ 。
①
 ,
,
②
 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。③电负性Cl>H>Si,
 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。请回答下列问题:
(1)写出A中发生反应的离子方程式:
(2)装置B的作用是
(3)仪器F的名称是
(4)有同学设计如图装置H、I替代上述E、G装置;
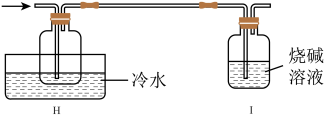
(5)测定产品纯度。取mg
 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为 ,则测定结果
,则测定结果(6)
 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
您最近半年使用:0次
2024-04-19更新
|
161次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高三下学期4月月考化学试题
7 . 黄丹粉可外用拔毒生肌、杀虫止痒等。以铅膏(主要成分 、
、 、PbO、Pb,还有少量
、PbO、Pb,还有少量 等)为原料制备黄丹粉的流程如下:
等)为原料制备黄丹粉的流程如下:
回答下列问题:
(1)“脱硫”中,为了提高反应速率宜采用的措施有_______ (填两条)。
(2)已知平衡常数大于10⁵的反应为不可逆反应(完全反应)。通过计算说明 能完全转化为
能完全转化为 的原因:
的原因:____ ; 开始转化
开始转化 的条件是
的条件是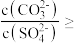
_______ 。
(3)已知: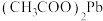 易溶于水、难电离。“酸浸”中,如果用浓盐酸替代醋酸,会产生有毒气体,写出生成该气体时发生反应的离子方程式:
易溶于水、难电离。“酸浸”中,如果用浓盐酸替代醋酸,会产生有毒气体,写出生成该气体时发生反应的离子方程式:___ (不考虑 转化为
转化为 )。
)。
(4)若“还原”时用木炭替代 ,其主要缺点是
,其主要缺点是_______ 。
(5)已知:“还原”步骤中测得如下数据:(甲)PbO起始质量为x g;(乙)消耗 总体积为V L(折合标准状况)(假设上述反应完全)。选择上述数据,计算理论上所得铅粉的质量
总体积为V L(折合标准状况)(假设上述反应完全)。选择上述数据,计算理论上所得铅粉的质量
_______ g。
(6)铅晶胞结构如图所示。已知 为阿伏加德罗常数的值,铅晶体密度为ρ g⋅cm
为阿伏加德罗常数的值,铅晶体密度为ρ g⋅cm ,则铅原子半径为
,则铅原子半径为_______ nm。
 、
、 、PbO、Pb,还有少量
、PbO、Pb,还有少量 等)为原料制备黄丹粉的流程如下:
等)为原料制备黄丹粉的流程如下: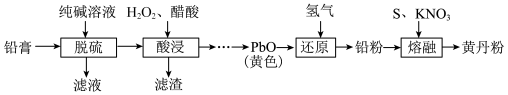
| 难溶电解质 |  |  |  |  |  |
 | 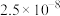 | 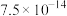 | 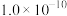 |  | 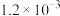 |
(1)“脱硫”中,为了提高反应速率宜采用的措施有
(2)已知平衡常数大于10⁵的反应为不可逆反应(完全反应)。通过计算说明
 能完全转化为
能完全转化为 的原因:
的原因: 开始转化
开始转化 的条件是
的条件是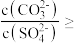
(3)已知:
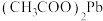 易溶于水、难电离。“酸浸”中,如果用浓盐酸替代醋酸,会产生有毒气体,写出生成该气体时发生反应的离子方程式:
易溶于水、难电离。“酸浸”中,如果用浓盐酸替代醋酸,会产生有毒气体,写出生成该气体时发生反应的离子方程式: 转化为
转化为 )。
)。(4)若“还原”时用木炭替代
 ,其主要缺点是
,其主要缺点是(5)已知:“还原”步骤中测得如下数据:(甲)PbO起始质量为x g;(乙)消耗
 总体积为V L(折合标准状况)(假设上述反应完全)。选择上述数据,计算理论上所得铅粉的质量
总体积为V L(折合标准状况)(假设上述反应完全)。选择上述数据,计算理论上所得铅粉的质量
(6)铅晶胞结构如图所示。已知
 为阿伏加德罗常数的值,铅晶体密度为ρ g⋅cm
为阿伏加德罗常数的值,铅晶体密度为ρ g⋅cm ,则铅原子半径为
,则铅原子半径为
您最近半年使用:0次
名校
8 . 亚硫酸钠和硫代硫酸钠(Na2S2O3)都是重要的含硫化合物。某化学兴趣小组进行以下有关实验,填写下列空白。
实验Ⅰ:证明Na2SO3中硫元素的价态能发生+4→+6转化
(1)实验中,不需要用到的试剂有___________ (填标号)。
a.稀硫酸 b.H2O2溶液 c.稀盐酸 d.淀粉碘化钾溶液 e.BaCl2溶液
观察到的现象是___________ 。
实验Ⅱ:制取硫代硫酸钠
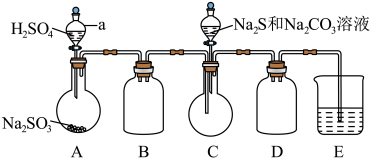
利用如图所示装置进行实验___________ 。
(3)装置D的作用是___________ 。
(4)实验中,为使 缓慢通入烧瓶C,采取的操作是
缓慢通入烧瓶C,采取的操作是___________ 。
实验Ⅲ:测定某硫代硫酸钠样品的纯度(设样品中只含Na2SO3杂质)
设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品7.9g,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na2SO3与I2反应)和少量淀粉溶液,用0.1mol·L-1I2标准溶液滴定(发生反应:2S2O +I2=S4O
+I2=S4O +2I-),至滴定终点共消耗标准溶液23.60mL。
+2I-),至滴定终点共消耗标准溶液23.60mL。
(5)样品中Na2S2O3的百分含量为___________ (保留三位有效数字)。
实验Ⅰ:证明Na2SO3中硫元素的价态能发生+4→+6转化
(1)实验中,不需要用到的试剂有
a.稀硫酸 b.H2O2溶液 c.稀盐酸 d.淀粉碘化钾溶液 e.BaCl2溶液
观察到的现象是
实验Ⅱ:制取硫代硫酸钠
利用如图所示装置进行实验
(3)装置D的作用是
(4)实验中,为使
 缓慢通入烧瓶C,采取的操作是
缓慢通入烧瓶C,采取的操作是实验Ⅲ:测定某硫代硫酸钠样品的纯度(设样品中只含Na2SO3杂质)
设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品7.9g,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na2SO3与I2反应)和少量淀粉溶液,用0.1mol·L-1I2标准溶液滴定(发生反应:2S2O
 +I2=S4O
+I2=S4O +2I-),至滴定终点共消耗标准溶液23.60mL。
+2I-),至滴定终点共消耗标准溶液23.60mL。(5)样品中Na2S2O3的百分含量为
您最近半年使用:0次
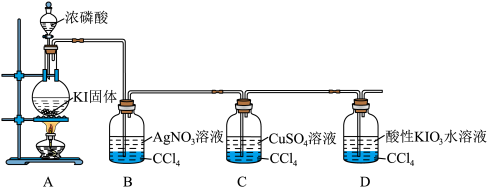
9 . 某课外兴趣小组设计实验探究氢碘酸(HI)的制备及其性质,有关装置如图所示。
已知:①磷酸沸点是261℃,不容易分解,几乎没有氧化性;②HI易溶于水,不溶于非极性溶剂,分解温度为300℃。
回答下列问题:
(1)装置A中装有浓磷酸的仪器名称是_______ 。广口瓶里四氯化碳层的作用是_______ 。
(2)实验室制备HCl选用浓硫酸[ ],而制备HI不能用浓硫酸,其原因是
],而制备HI不能用浓硫酸,其原因是_______ 。
(3)加热温度控制在300℃以下,其原因是_______ 。若装置A中除HI气体外,只生成两种酸式盐,且其物质的量之比为1∶1,写出该反应的化学方程式:_______ 。
(4)装置B中现象是_______ , 有较强氧化性,但是装置B中发生复分解反应,其主要原因可能是
有较强氧化性,但是装置B中发生复分解反应,其主要原因可能是_______ 。
(5)装置C中观察到溶液由蓝色变为棕色,产生沉淀,经检测沉淀为CuI。写出装置C中发生反应的离子方程式:_______ 。
(6)实验完毕后,取少量装置D中溶液于试管中,滴加淀粉溶液,溶液变为蓝色。则装置D中100 mL 0.5 mol⋅L 酸性
酸性 溶液最多能氧化
溶液最多能氧化_______ mol HI。

已知:①磷酸沸点是261℃,不容易分解,几乎没有氧化性;②HI易溶于水,不溶于非极性溶剂,分解温度为300℃。
回答下列问题:
(1)装置A中装有浓磷酸的仪器名称是
(2)实验室制备HCl选用浓硫酸[
 ],而制备HI不能用浓硫酸,其原因是
],而制备HI不能用浓硫酸,其原因是(3)加热温度控制在300℃以下,其原因是
(4)装置B中现象是
 有较强氧化性,但是装置B中发生复分解反应,其主要原因可能是
有较强氧化性,但是装置B中发生复分解反应,其主要原因可能是(5)装置C中观察到溶液由蓝色变为棕色,产生沉淀,经检测沉淀为CuI。写出装置C中发生反应的离子方程式:
(6)实验完毕后,取少量装置D中溶液于试管中,滴加淀粉溶液,溶液变为蓝色。则装置D中100 mL 0.5 mol⋅L
 酸性
酸性 溶液最多能氧化
溶液最多能氧化
您最近半年使用:0次
名校
解题方法
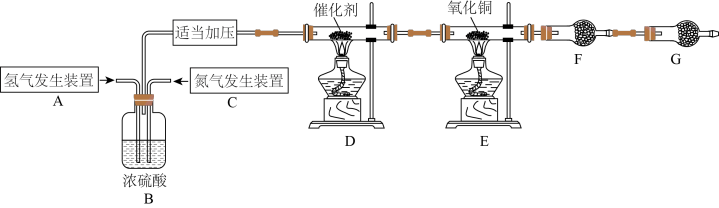
10 . 某学习小组根据氨气还原氧化铜的反应,设计实验测定铜元素相对原子质量Ar(Cu)(近似值)。甲同学模拟合成氨工业制备氨气,反应前先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。装置图如下: 。请回答下列问题:
。请回答下列问题:
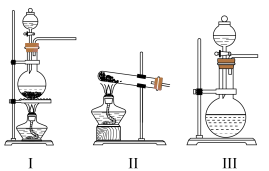
(1)C装置应选用______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)装置B的作用是:①使气体混合均匀;②______ ;③______ 。
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为____________________ 。
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
(5)G装置的作用是①______ ;②______ 。
若没有G装置,测得结果Ar(Cu)______ (填“偏大”“偏小”或“无影响”)。
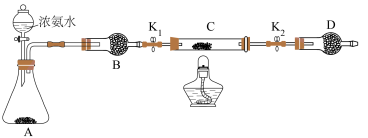
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。______ (填化学式)
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=______ (用含有m1、m2、m3的式子表示)。
 。请回答下列问题:
。请回答下列问题:(1)C装置应选用
(2)装置B的作用是:①使气体混合均匀;②
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
| A.五氧化二磷 | B.无水CuSO4 | C.碱石灰 | D.无水CaCl2 |
(5)G装置的作用是①
若没有G装置,测得结果Ar(Cu)
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=
您最近半年使用:0次
2024-04-03更新
|
517次组卷
|
4卷引用:河南省郑州市宇华实验学校2023-2024学年高一下学期3月月考化学试题



