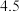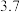名校
解题方法
1 . 铌 的原子序数为41,其单质具有良好的超导性,可应用于原子能领域。烧绿石精矿可用于冶炼金属铌,某烧绿石精矿的成分为
的原子序数为41,其单质具有良好的超导性,可应用于原子能领域。烧绿石精矿可用于冶炼金属铌,某烧绿石精矿的成分为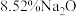 ,
,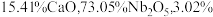 其他不反应的杂质。从烧绿石中提取
其他不反应的杂质。从烧绿石中提取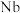 的工艺流程如图所示:
的工艺流程如图所示:
(1)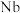 在元素周期表中的位置是
在元素周期表中的位置是___________ 。
(2)上述烧绿石中铌元素的含量为___________ 。
(3)“酸浸”时,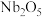 转化为
转化为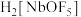 的化学方程式为
的化学方程式为___________ 。
(4)“沉淀”时,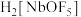 与氨水反应生成
与氨水反应生成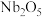 、
、___________ 、 。
。
(5)“还原”时,发生反应的化学方程式为___________ 。
(6)“萃取”“反萃取”后都需要进行的分离操作是___________ 。
(7)废液中的 ,在一定条件可转化为可溶于酸的难溶性盐
,在一定条件可转化为可溶于酸的难溶性盐 。某温度下,用
。某温度下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中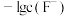 或
或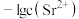 与
与 的关系如图所示。则该温度下难溶盐
的关系如图所示。则该温度下难溶盐 的溶度积常数为
的溶度积常数为___________ 。
 的原子序数为41,其单质具有良好的超导性,可应用于原子能领域。烧绿石精矿可用于冶炼金属铌,某烧绿石精矿的成分为
的原子序数为41,其单质具有良好的超导性,可应用于原子能领域。烧绿石精矿可用于冶炼金属铌,某烧绿石精矿的成分为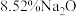 ,
,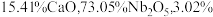 其他不反应的杂质。从烧绿石中提取
其他不反应的杂质。从烧绿石中提取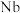 的工艺流程如图所示:
的工艺流程如图所示: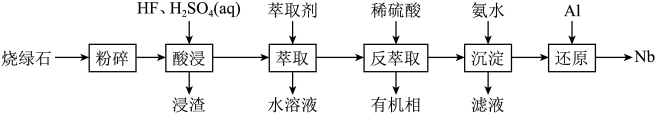
(1)
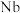 在元素周期表中的位置是
在元素周期表中的位置是(2)上述烧绿石中铌元素的含量为
(3)“酸浸”时,
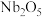 转化为
转化为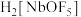 的化学方程式为
的化学方程式为(4)“沉淀”时,
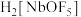 与氨水反应生成
与氨水反应生成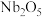 、
、 。
。(5)“还原”时,发生反应的化学方程式为
(6)“萃取”“反萃取”后都需要进行的分离操作是
(7)废液中的
 ,在一定条件可转化为可溶于酸的难溶性盐
,在一定条件可转化为可溶于酸的难溶性盐 。某温度下,用
。某温度下,用 调节
调节 浊液的
浊液的 ,测得体系中
,测得体系中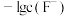 或
或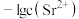 与
与 的关系如图所示。则该温度下难溶盐
的关系如图所示。则该温度下难溶盐 的溶度积常数为
的溶度积常数为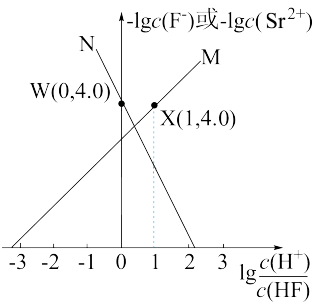
您最近半年使用:0次
2 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的 以上。工业制硅,先制得粗硅,再制得高纯硅。
以上。工业制硅,先制得粗硅,再制得高纯硅。
I.请回答:
(1)工业制粗硅反应的化学方程式为_______ ,制取的高纯硅可用于_______ (写出硅的一种用途)。
(2)工业制粗硅的中间产物 遇水剧烈反应生成
遇水剧烈反应生成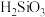 、
、 和一种气体单质,请写出化学反应方程式
和一种气体单质,请写出化学反应方程式_______ 。
II.某小组拟在实验室用如图所示装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
① ,
,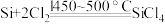
② 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为
的熔点、沸点分别为 、
、 。
。
请回答下列问题:
(3)A中装浓盐酸的仪器名称是_______ 。
(4)装置B的作用是_______ 。
(5)为了更好的收集产品,可以将试剂瓶E放在_______ 中使四氯化硅液化收集。
(6)能否将装置G改成如图装置来吸收尾气?_______ (填“能”或“不能”),原因:_______ 。
 以上。工业制硅,先制得粗硅,再制得高纯硅。
以上。工业制硅,先制得粗硅,再制得高纯硅。I.请回答:
(1)工业制粗硅反应的化学方程式为
(2)工业制粗硅的中间产物
 遇水剧烈反应生成
遇水剧烈反应生成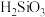 、
、 和一种气体单质,请写出化学反应方程式
和一种气体单质,请写出化学反应方程式II.某小组拟在实验室用如图所示装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。

①
 ,
,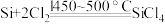
②
 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为
的熔点、沸点分别为 、
、 。
。请回答下列问题:
(3)A中装浓盐酸的仪器名称是
(4)装置B的作用是
(5)为了更好的收集产品,可以将试剂瓶E放在
(6)能否将装置G改成如图装置来吸收尾气?
您最近半年使用:0次
3 . 青蒿素为无色晶体,易溶于有机溶剂,难溶于水,熔点156~157℃,温度超过60℃完全失去药效(已知:乙醚沸点为35℃)。从青蒿中提取青蒿素的工艺如下所示:

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至装置,冷凝后滴入滤纸套筒1中,与青蒿粉末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿粉末的连续萃取。回答下列问题:

(1)装置a的名称为___________ 。
(2)索氏提取装置提取出来的青蒿素位于___________ (填“圆底烧瓶”或“索氏提取器”)中;与常规的萃取相比,索氏提取的优点是___________ 。
(3)提取液蒸馏过程中选用图中哪种装置更好?___________ (填“甲”或“乙”),原因是___________ 。

(4)粗品提纯的过程可能是___________ (填标号)。
a.加水溶解、过滤
b.加95%的乙醇溶解、水浴加热、冷却结晶、过滤
c.加入乙醚进行萃取分液
(5)青蒿素分子(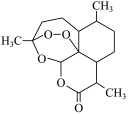 )中的含氧官能团除过氧基(-O-O-)外,还有
)中的含氧官能团除过氧基(-O-O-)外,还有___________ (写名称)。

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至装置,冷凝后滴入滤纸套筒1中,与青蒿粉末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿粉末的连续萃取。回答下列问题:

(1)装置a的名称为
(2)索氏提取装置提取出来的青蒿素位于
(3)提取液蒸馏过程中选用图中哪种装置更好?

(4)粗品提纯的过程可能是
a.加水溶解、过滤
b.加95%的乙醇溶解、水浴加热、冷却结晶、过滤
c.加入乙醚进行萃取分液
(5)青蒿素分子(
 )中的含氧官能团除过氧基(-O-O-)外,还有
)中的含氧官能团除过氧基(-O-O-)外,还有
您最近半年使用:0次
名校
解题方法
4 . 高铁酸钾 具有强氧化性,是一种新型、绿色、高效的多功能饮用水处理剂,一种以Mn、Fe及
具有强氧化性,是一种新型、绿色、高效的多功能饮用水处理剂,一种以Mn、Fe及 为原料制备高铁酸钾和
为原料制备高铁酸钾和 的流程如图所示。
的流程如图所示。
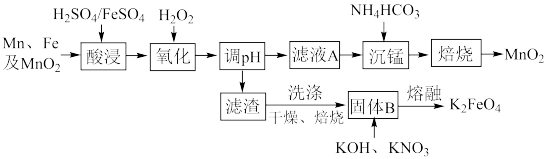
回答下列问题:
(1) 中Fe的化合价为
中Fe的化合价为___________ 。
(2)高铁酸钾溶液中存在反应: ,已知该反应的
,已知该反应的 ,则该反应在
,则该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(3)用惰性电极电解 酸性溶液可制得
酸性溶液可制得 ,写出电解法制备
,写出电解法制备 时的阳极反应式:
时的阳极反应式:___________ 。
(4)已知固体B制取 的过程中会生成两种盐,写出该反应的化学方程式:
的过程中会生成两种盐,写出该反应的化学方程式:___________ 。
(5) 可作为新型多功能水处理剂的原因:
可作为新型多功能水处理剂的原因:___________ 。
(6) 的晶胞结构示意图如图所示。其中O围绕Fe和P分别形成正八面体和正四面体空隙,它们通过共顶点、共棱形成空间链状结构。
的晶胞结构示意图如图所示。其中O围绕Fe和P分别形成正八面体和正四面体空隙,它们通过共顶点、共棱形成空间链状结构。
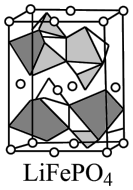
①下列状态锂中,失去一个电子所需能量最大的是___________ (填序号)。
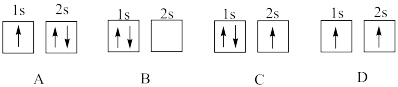
②该晶胞呈长方体,晶胞边长分别为apm、bpm、cpm,阿伏加德罗常数的值为 ,该晶体的密度可表示为
,该晶体的密度可表示为___________  。
。
 具有强氧化性,是一种新型、绿色、高效的多功能饮用水处理剂,一种以Mn、Fe及
具有强氧化性,是一种新型、绿色、高效的多功能饮用水处理剂,一种以Mn、Fe及 为原料制备高铁酸钾和
为原料制备高铁酸钾和 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)
 中Fe的化合价为
中Fe的化合价为(2)高铁酸钾溶液中存在反应:
 ,已知该反应的
,已知该反应的 ,则该反应在
,则该反应在(3)用惰性电极电解
 酸性溶液可制得
酸性溶液可制得 ,写出电解法制备
,写出电解法制备 时的阳极反应式:
时的阳极反应式:(4)已知固体B制取
 的过程中会生成两种盐,写出该反应的化学方程式:
的过程中会生成两种盐,写出该反应的化学方程式:(5)
 可作为新型多功能水处理剂的原因:
可作为新型多功能水处理剂的原因:(6)
 的晶胞结构示意图如图所示。其中O围绕Fe和P分别形成正八面体和正四面体空隙,它们通过共顶点、共棱形成空间链状结构。
的晶胞结构示意图如图所示。其中O围绕Fe和P分别形成正八面体和正四面体空隙,它们通过共顶点、共棱形成空间链状结构。
①下列状态锂中,失去一个电子所需能量最大的是
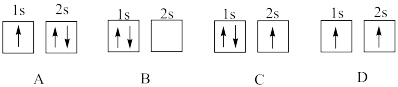
②该晶胞呈长方体,晶胞边长分别为apm、bpm、cpm,阿伏加德罗常数的值为
 ,该晶体的密度可表示为
,该晶体的密度可表示为 。
。
您最近半年使用:0次
5 . 2023年8月1日起,中国对镓、锗相关物项进行出口管制。金属镓有“电子工业脊梁”的美誉,与铝的化学性质类似,广泛应用于电子、航空航天、光学等领域。从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的流程如图所示:
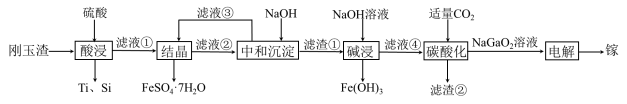
室温时,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时( )的pH )的pH |
|
|
|
|
沉淀完全时( )的pH )的pH |
|
|
|
|
回答下列问题:
(1)基态镓原子的价电子排布式为
(2)从溶液中得到
 的具体操作为
的具体操作为(3)“中和沉淀”过程中分离出的滤渣①有
 和
和 ,“中和沉淀”过程中pH应调节的范围为
,“中和沉淀”过程中pH应调节的范围为(4)“碱浸”时镓元素发生的离子方程式为
(5)“碳酸化”过程中为防止镓损耗,不能通入过量
 的原因为
的原因为(6)以纯镓为原料可制得GaN,GaN晶体的一种立方晶胞如图所示,Ga的配位数为
 ,则GaN的晶体密度为
,则GaN的晶体密度为 (列出计算式)。
(列出计算式)。
您最近半年使用:0次
2024-03-22更新
|
327次组卷
|
2卷引用:贵州省贵阳市2024届高三下学期适应性测试(一)化学试题
解题方法
6 . ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法制备NaClO2固体的实验装置如图所示。
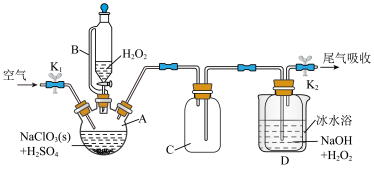
已知:①2NaClO3+ H2O2 + H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;
②ClO2熔点-59℃、沸点11℃;H2O2沸点150℃。
请回答:
(1)仪器A的名称_______ ,仪器B支管的作用为_______ 。
(2)仪器C的作用是防倒吸,则冰水浴冷却的目的是_______ (任写一条)。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因_______ 。
(4)装置D中发生反应的化学方程式为_______ 。
(5)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_______ (用离子方程式表示);
②H2O2+Cl2=2Cl- +O2 + 2H+。

已知:①2NaClO3+ H2O2 + H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;
②ClO2熔点-59℃、沸点11℃;H2O2沸点150℃。
请回答:
(1)仪器A的名称
(2)仪器C的作用是防倒吸,则冰水浴冷却的目的是
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因
(4)装置D中发生反应的化学方程式为
(5)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①
②H2O2+Cl2=2Cl- +O2 + 2H+。
您最近半年使用:0次
解题方法
7 . 实验室模拟工业制备硫氰化钾(KSCN)的实验装置如图所示(部分夹持装置已略去):
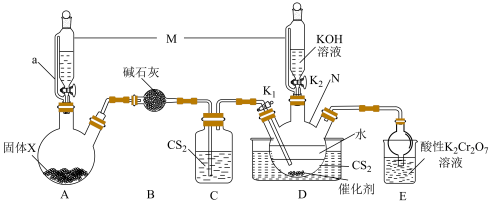
已知:① 是密度比水大且不溶于水的液体,
是密度比水大且不溶于水的液体, 不溶于
不溶于 。
。
②在一定条件下发生反应: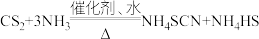 ,生成物中
,生成物中 的热稳定性较NH4SCN差。
的热稳定性较NH4SCN差。
请回答下列问题:
(1)仪器M的名称为“恒压滴液漏斗”,A装置中的M装的是浓氨水(已分解、易挥发),在A装置中导管a的作用是___________ ;A中固体X可以是___________ (填“字母编号”)。
a.CaO b.CaCl2 c.NaOH d.CaCO3
(2)D装置中仪器N的名称是___________ ;N仪器内盛放有CS2、H2O和催化剂进气导管口必须插入下层CS2液体中,目的是___________ 。
(3)反应一段时间后,关闭K1,保持三颈烧瓶内液体温度105℃一段时间,其目的是___________ ;然后打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,制得较纯净的KSCN溶液,该反应的化学方程式为___________ 。
(4)装置E用来吸收尾气,防止污染环境,其中吸收NH3生成无色无味气体的无污染气体,Cr2O 被还原成Cr3+,其反应的离子方程式为
被还原成Cr3+,其反应的离子方程式为___________ 。

已知:①
 是密度比水大且不溶于水的液体,
是密度比水大且不溶于水的液体, 不溶于
不溶于 。
。②在一定条件下发生反应:
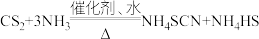 ,生成物中
,生成物中 的热稳定性较NH4SCN差。
的热稳定性较NH4SCN差。请回答下列问题:
(1)仪器M的名称为“恒压滴液漏斗”,A装置中的M装的是浓氨水(已分解、易挥发),在A装置中导管a的作用是
a.CaO b.CaCl2 c.NaOH d.CaCO3
(2)D装置中仪器N的名称是
(3)反应一段时间后,关闭K1,保持三颈烧瓶内液体温度105℃一段时间,其目的是
(4)装置E用来吸收尾气,防止污染环境,其中吸收NH3生成无色无味气体的无污染气体,Cr2O
 被还原成Cr3+,其反应的离子方程式为
被还原成Cr3+,其反应的离子方程式为
您最近半年使用:0次
解题方法
8 . 富马酸亚铁(结构简式为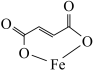 ,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
步骤I:富马酸亚铁晶体的制备
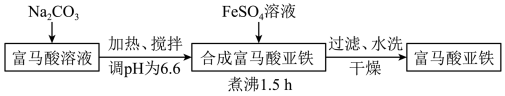
(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。仪器A的名称是_______ ,球形冷凝管的作用为_______ 。

(2)调pH时最好选用的酸为_______ 。
a.盐酸 b.硫酸 c.硝酸
(3)合成富马酸亚铁的化学方程式为_______ 。
(4)煮沸过程中会持续通入氮气,其目的是_______ 。
(5)水洗环节中,判断富马酸亚铁产品已洗净的实验方法是_______ 。
步骤Ⅱ:产品纯度的测定
取0.4000g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液星红色;立即用0.1000mol/L的硫酸铈铵(NH4)2Ce(SO4)3标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。
(6)滴定过程的硫酸铈铵[(NH4)2Ce(SO4)3]标准液应装入_______ (填“酸式”或“碱式”)滴定管。根据上述实验数据,测得产品的纯度是_______ %。
 ,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:步骤I:富马酸亚铁晶体的制备

(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。仪器A的名称是

(2)调pH时最好选用的酸为
a.盐酸 b.硫酸 c.硝酸
(3)合成富马酸亚铁的化学方程式为
(4)煮沸过程中会持续通入氮气,其目的是
(5)水洗环节中,判断富马酸亚铁产品已洗净的实验方法是
步骤Ⅱ:产品纯度的测定
取0.4000g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液星红色;立即用0.1000mol/L的硫酸铈铵(NH4)2Ce(SO4)3标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。
(6)滴定过程的硫酸铈铵[(NH4)2Ce(SO4)3]标准液应装入
您最近半年使用:0次
2024-03-08更新
|
65次组卷
|
2卷引用:贵州省贵阳市白云区第二高级中学2023-2024学年高三上学期质量监测化学试卷
9 . 钒酸铋(BiVO4)是一种亮黄色无机化学品,应用于众多领域。某小组以辉铋矿粉(主要成分是Bi2S3,含少量Bi2O3、Bi、FeS2和SiO2等杂质)为原料制备BiVO4的流程如图所示。
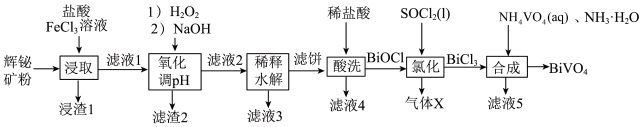
已知部分信息如下:
①滤液1中的主要阳离子有Bi3+、Fe2+、Fe3+和H+;
②水解能力:Bi3+>Fe3+;
③常温下,几种离子生成氢氧化物沉淀的pH如表所示。
回答下列问题:
(1)“浸取”时可以适当加热,但温度不宜过高,其原因是_______ ,写出浸取过程生成S渣的主要离子方程式_______ 。
(2)加H2O2氧化的目的是_______ ,调pH的范围是_______ 。
(3)滤液3可以循环用于_______ (填名称)工序。
(4)SOCl2的空间构型是_______ ,气体X是_______ (填写化学式)。
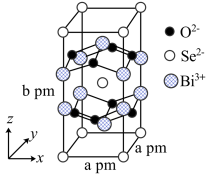
(5)我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm、apm、bpm。该晶体的密度为_______ g。cm-3(列出计算式,设NA为阿伏加德罗常数的值)。

已知部分信息如下:
①滤液1中的主要阳离子有Bi3+、Fe2+、Fe3+和H+;
②水解能力:Bi3+>Fe3+;
③常温下,几种离子生成氢氧化物沉淀的pH如表所示。
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Bi(OH)3 |
| 开始沉淀的pH | 7.7 | 1.6 | 4.0 |
| 完全沉淀的pH | 9.6 | 3.1 | 5.5 |
(1)“浸取”时可以适当加热,但温度不宜过高,其原因是
(2)加H2O2氧化的目的是
(3)滤液3可以循环用于
(4)SOCl2的空间构型是
(5)我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm、apm、bpm。该晶体的密度为

您最近半年使用:0次
2024-03-03更新
|
94次组卷
|
2卷引用:贵州省贵阳市白云区第二高级中学2023-2024学年高三上学期质量监测化学试卷
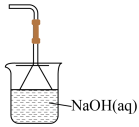
10 . 磷酸亚铁锂(LiFePO4)是生产锂电池的重要材料。实验室中用如图装置制备LiFePO4:在仪器A中加入40mL蒸馏水、少量抗坏血酸,再加入0.01molH3PO4和0.01molFeSO4•7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH•H2O,继续搅拌5min。快速将反应液装入反应釜中,保持170℃恒温5h。
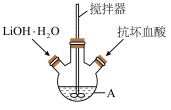
(1)仪器A的名称是___________ ;实验所用蒸馏水若未经煮沸直接使用,则可能发生反应的离子方程式为 ___________ 。
(2)实验中可用Na2SO3代替抗坏血酸,其原理是___________ (用离子方程式表示);不能用铁粉代替抗坏血酸的原因是 ___________ 。
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是___________ 、 ___________ 、过滤、洗涤、干燥。
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是___________ 。
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。

(1)仪器A的名称是
(2)实验中可用Na2SO3代替抗坏血酸,其原理是
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。
| A.85% | B.80% | C.75% | D.70% |
您最近半年使用:0次