1 . 硝酸镍、硝酸钠在陶瓷、玻璃工业应用广泛。以废弃镍板(含有少量的氧化铝杂质)生产硝酸镍、硝酸钠工艺流程如下:
(1)工业生产普通玻璃的主要原料有石英砂、__________ 、__________ 。
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是__________ ;若温度太高,可能导致的后果是__________ 。
(3)假如Ni与浓硝酸反应产生的混合气体中 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)向“浸取液”中加入 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为_______ 。__________ 。
(6)向“转化器”中加入稀硝酸的目的是__________ 。
(7)已知:①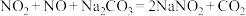 ;
;
②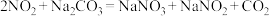 。
。
若将一定体积的 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为__________ 。

(1)工业生产普通玻璃的主要原料有石英砂、
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是
(3)假如Ni与浓硝酸反应产生的混合气体中
 ,该反应的离子方程式为
,该反应的离子方程式为(4)向“浸取液”中加入
 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为__________+
 +
+ __________
__________ +
+ _________+
_________+
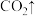 。
。
(6)向“转化器”中加入稀硝酸的目的是
(7)已知:①
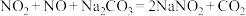 ;
;②
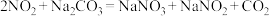 。
。若将一定体积的
 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
您最近半年使用:0次
解题方法
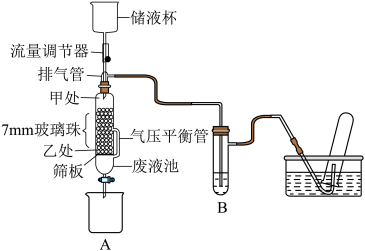
2 . 利用传统方式制备乙炔的过程中,存在一些问题难以解决,如反应速率过快、放热过多不易控制,生成的糊状物难以实现固液分离导致乙炔气流不平稳,甚至发生堵塞等问题。为解决上述问题,某校化学兴趣小组设计出一套乙炔制备、净化和收集实验的一体化实验装置。______ 。
(2)①仪器B的名称是______ ;
②向 反应器中填装固体反应物时,电石放置位置为
反应器中填装固体反应物时,电石放置位置为______ (填“甲处”或“乙处”);反应器中装有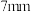 玻璃珠,其作用为
玻璃珠,其作用为______ ;
③B装置中可用次氯酸钠吸收混杂在乙炔中的 ,反应中
,反应中 被氧化为最高价氧化物对应的水化物,请写出次氯酸钠与
被氧化为最高价氧化物对应的水化物,请写出次氯酸钠与 反应的离子方程式:
反应的离子方程式:______ 。
(3)兴趣小组在制备乙炔时对反应液进行了一系列筛选(如下图),依据图表选择最合适的反应液为______ (填标号),原因是______ 。
a.饱和食盐水 b. 醋酸 c.
醋酸 c. 盐酸 d.饱和氯化铵溶液
盐酸 d.饱和氯化铵溶液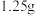 (杂质的质量分数为
(杂质的质量分数为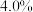 )完成实验,除杂后测得乙炔气体体积为
)完成实验,除杂后测得乙炔气体体积为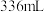 (标准状况下),计算该实验中乙炔的产率:
(标准状况下),计算该实验中乙炔的产率:______  (结果保留两位有效数字)。
(结果保留两位有效数字)。
(2)①仪器B的名称是
②向
 反应器中填装固体反应物时,电石放置位置为
反应器中填装固体反应物时,电石放置位置为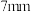 玻璃珠,其作用为
玻璃珠,其作用为③B装置中可用次氯酸钠吸收混杂在乙炔中的
 ,反应中
,反应中 被氧化为最高价氧化物对应的水化物,请写出次氯酸钠与
被氧化为最高价氧化物对应的水化物,请写出次氯酸钠与 反应的离子方程式:
反应的离子方程式:(3)兴趣小组在制备乙炔时对反应液进行了一系列筛选(如下图),依据图表选择最合适的反应液为
a.饱和食盐水 b.
 醋酸 c.
醋酸 c. 盐酸 d.饱和氯化铵溶液
盐酸 d.饱和氯化铵溶液
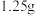 (杂质的质量分数为
(杂质的质量分数为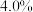 )完成实验,除杂后测得乙炔气体体积为
)完成实验,除杂后测得乙炔气体体积为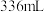 (标准状况下),计算该实验中乙炔的产率:
(标准状况下),计算该实验中乙炔的产率: (结果保留两位有效数字)。
(结果保留两位有效数字)。
您最近半年使用:0次
解题方法
3 . 碲、锑广泛应用光伏、半导体领域。某科研小组从阳极泥分铜液净化渣[主要含铜、碲(Te)、锑(Sb)等元素的化合物]分别回收碲和锑的工艺流程如下图所示: 浸渣。
浸渣。
②“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有 。
。
回答下列问题:
(1)基态Sb原子的价层电子排布式为___________ 。
(2)“碱浸”时,二氧化碲与碱溶液反应的离子方程式为___________ 。
(3)“氯盐酸浸”时,通入 的目的是
的目的是___________ ;“氯盐酸浸”时温度过高会使Sb的浸出率降低,原因是___________ 。
(4)向“碱浸液”中加双氧水需分批加入,目的是___________ 。
(5)写出“热还原”时发生反应的化学方程式___________ 。
(6)粗碲粉中碲质量分数的测定:取3.2g粗碲粉,加入硝酸使其转化为亚碲酸(H2TeO3),将溶液置于冰盐冷剂中冷却至273K过滤、冰水洗涤等得到亚碲酸。将亚碲酸配制成250mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入20.00mL0.04mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为原碲酸(H6TeO6)。用0.03mol·L-1硫酸亚铁铵[ (NH4)2 Fe(SO4)2 ]标准溶液滴定剩余的酸性K2Cr2O7溶液,滴定至终点时消耗20.00mL硫酸亚铁铵标准溶液。则粗碲粉中碲的质量分数为___________ ;如滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,则测定结果___________ (填“偏高”、“偏低”或“无影响”)。

 浸渣。
浸渣。②“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有
 。
。回答下列问题:
(1)基态Sb原子的价层电子排布式为
(2)“碱浸”时,二氧化碲与碱溶液反应的离子方程式为
(3)“氯盐酸浸”时,通入
 的目的是
的目的是(4)向“碱浸液”中加双氧水需分批加入,目的是
(5)写出“热还原”时发生反应的化学方程式
(6)粗碲粉中碲质量分数的测定:取3.2g粗碲粉,加入硝酸使其转化为亚碲酸(H2TeO3),将溶液置于冰盐冷剂中冷却至273K过滤、冰水洗涤等得到亚碲酸。将亚碲酸配制成250mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入20.00mL0.04mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为原碲酸(H6TeO6)。用0.03mol·L-1硫酸亚铁铵[ (NH4)2 Fe(SO4)2 ]标准溶液滴定剩余的酸性K2Cr2O7溶液,滴定至终点时消耗20.00mL硫酸亚铁铵标准溶液。则粗碲粉中碲的质量分数为
您最近半年使用:0次
4 . 世界上95%的铝业公司均使用拜耳法(原料为铝土矿,主要成分为 ,含少量
,含少量 、
、 等)生产
等)生产 ,其工艺流程如下:
,其工艺流程如下:
下列说法错误的是
 ,含少量
,含少量 、
、 等)生产
等)生产 ,其工艺流程如下:
,其工艺流程如下: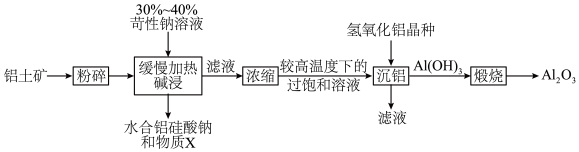
下列说法错误的是
A.物质X为 |
B.可用过量 代替氢氧化铝晶种 代替氢氧化铝晶种 |
C.“缓慢加热”可促使 转化为水合铝硅酸钠 转化为水合铝硅酸钠 |
| D.该流程中可循环利用的物质主要有氢氧化铝晶种 |
您最近半年使用:0次
名校
解题方法
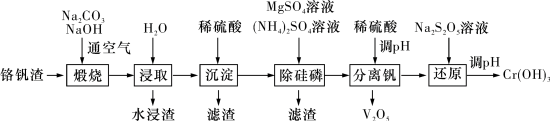
5 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示: 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;
ii) 时,硅元素以
时,硅元素以 形式存在;
形式存在;
iii) 在
在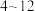 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。
回答下列问题:
(1) 的基态价层电子轨道表示式为
的基态价层电子轨道表示式为_______ 。
(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为_______ 。
(3)水浸渣中主要物质为_______ (填化学式)。
(4)“沉淀”步骤调 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为_______ (填化学式)。
(5)“除硅磷”步骤中,使硅、磷分别以 和
和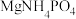 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是_______ (填标号)。
a.若 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀
b.若 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质
d.若 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀
(6)“分离钒”步骤中,将溶液 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或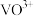 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有_______ (填标号)。
A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。
 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;ii)
 时,硅元素以
时,硅元素以 形式存在;
形式存在;iii)
 在
在 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。回答下列问题:
(1)
 的基态价层电子轨道表示式为
的基态价层电子轨道表示式为(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为
(3)水浸渣中主要物质为
(4)“沉淀”步骤调
 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为(5)“除硅磷”步骤中,使硅、磷分别以
 和
和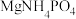 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是a.若
 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀b.若
 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀c.若
 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质d.若
 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀(6)“分离钒”步骤中,将溶液
 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或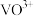 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠
 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近半年使用:0次
解题方法
6 . 氮的氧化物 是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。回答下列问题:
是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。回答下列问题:
(1)工业上在一定温度和催化剂条件下用 将
将 还原生成
还原生成 。
。
①如果选择图中A作为氨气的发生装置,对应反应的化学方程式为:_______ 。_______ 。(按气流方向,用小写字母表示),F中倒置漏斗的作用是_______ 。
③若用通式 表示氮氧化物,则
表示氮氧化物,则_______  氨气可将1
氨气可将1 的
的 转化为
转化为 。
。
(2) 和
和 可用
可用 溶液吸收,主要反应:
溶液吸收,主要反应: ,
,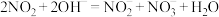
①下列措施能提高尾气中 和
和 去除率的有
去除率的有_______ (填标号)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量 溶液
溶液
②将 、
、 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制
。该工艺需控制 和
和 物质的量之比接近
物质的量之比接近 。若
。若 ,则会导致
,则会导致_______ :若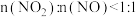 ,则会导致
,则会导致_______ 。
 是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。回答下列问题:
是大气污染物之一,含有氮氧化物的尾气需处理后才能排放。回答下列问题:(1)工业上在一定温度和催化剂条件下用
 将
将 还原生成
还原生成 。
。①如果选择图中A作为氨气的发生装置,对应反应的化学方程式为:

③若用通式
 表示氮氧化物,则
表示氮氧化物,则 氨气可将1
氨气可将1 的
的 转化为
转化为 。
。(2)
 和
和 可用
可用 溶液吸收,主要反应:
溶液吸收,主要反应: ,
,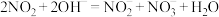
①下列措施能提高尾气中
 和
和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量
 溶液
溶液②将
 、
、 通入石灰乳中可制备重要的工业原料
通入石灰乳中可制备重要的工业原料 。该工艺需控制
。该工艺需控制 和
和 物质的量之比接近
物质的量之比接近 。若
。若 ,则会导致
,则会导致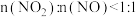 ,则会导致
,则会导致
您最近半年使用:0次
名校
解题方法
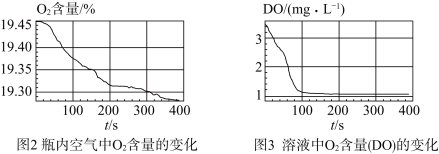
7 . 某小组同学为了获取在 制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。

【进行实验】
实验步骤:
I.向瓶中加入饱和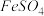 溶液,按图1所示连接装置;
溶液,按图1所示连接装置;
II.打开磁力搅拌器,立即加入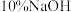 溶液;
溶液;
III.采集瓶内空气中 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:
【解释与结论】
(1)盛放 的仪器为
的仪器为_________________ 。
(2)搅拌的目的是_________________ 。
(3)生成白色沉淀的离子方程式是_________________ 。
(4)红褐色沉淀是_________________ 。
(5)通过上述实验,可得到“在 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是_________________ 。
(6)结合上述实验,提出制备 过程中应注意的事项
过程中应注意的事项_________________ (回答一项即可)。
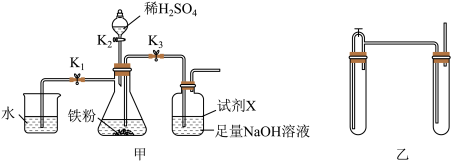
(7)某实验小组用如图甲所示装置制备 。下列说法正确的是( )
。下列说法正确的是( )
 制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
制备过程中,沉淀颜色的改变与氧气有关的实验证据,用图1所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
【进行实验】
实验步骤:
I.向瓶中加入饱和
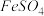 溶液,按图1所示连接装置;
溶液,按图1所示连接装置;II.打开磁力搅拌器,立即加入
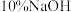 溶液;
溶液;III.采集瓶内空气中
 含量和溶液中
含量和溶液中 含量(DO)的数据。
含量(DO)的数据。实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:

【解释与结论】
(1)盛放
 的仪器为
的仪器为(2)搅拌的目的是
(3)生成白色沉淀的离子方程式是
(4)红褐色沉淀是
(5)通过上述实验,可得到“在
 制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是(6)结合上述实验,提出制备
 过程中应注意的事项
过程中应注意的事项(7)某实验小组用如图甲所示装置制备
 。下列说法正确的是( )
。下列说法正确的是( )
| A.甲装置在使用前需检查气密性 |
B.实验时打开旋塞的顺序依次为 |
| C.试剂X可选用植物油,其主要作用是隔绝空气 |
D.甲选用装置中除水外的药品,可用乙装置代替甲装置制备 |
您最近半年使用:0次
解题方法
8 . 亚氯酸钠 是一种强氧化剂,常用作漂白剂、脱色剂、消毒剂、拔染剂等,能溶于水。某学习小组通过如图装置(夹持装置略)制备
是一种强氧化剂,常用作漂白剂、脱色剂、消毒剂、拔染剂等,能溶于水。某学习小组通过如图装置(夹持装置略)制备 。已知:
。已知: 饱和溶液在温度低于
饱和溶液在温度低于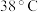 时析出晶体是
时析出晶体是 ,高于
,高于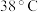 时析出晶体是
时析出晶体是 ,高于
,高于 时
时 分解成
分解成 和
和 。回答下列问题:
。回答下列问题:
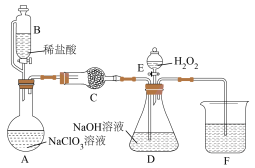
(1)仪器B的名称是_______ ,仪器B左侧导管的作用是_______ 。
(2)A中发生反应: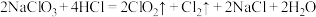 ,该反应中氧化剂与还原剂物质的量之比为
,该反应中氧化剂与还原剂物质的量之比为_______ 。
(3) 比
比 更易溶于水的原因是
更易溶于水的原因是_______ 。
(4)该同学在实验时,打开活塞E,发现 滴入几滴后即停止,此时该同学的操作是
滴入几滴后即停止,此时该同学的操作是___ 。
(5)D中发生反应的离子方程式为_______ ;
(6)该同学获得 晶体的操作步骤为:取反应后D中液体,减压,
晶体的操作步骤为:取反应后D中液体,减压, 蒸发结晶,
蒸发结晶,___ ,在 干燥,得到成品。
干燥,得到成品。
(7)样品中 (杂质为
(杂质为 )纯度的测定。取
)纯度的测定。取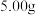 所得晶体配成溶液,用过量的草酸将其还原为
所得晶体配成溶液,用过量的草酸将其还原为 ,再加入足量的硝酸酸化的
,再加入足量的硝酸酸化的 溶液,经过滤、洗涤、干燥,得到白色沉淀
溶液,经过滤、洗涤、干燥,得到白色沉淀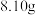 。
。
①加入草酸时反应的化学方程式为_______ 。
② 的纯度为
的纯度为_______ (保留三位有效数字)。
 是一种强氧化剂,常用作漂白剂、脱色剂、消毒剂、拔染剂等,能溶于水。某学习小组通过如图装置(夹持装置略)制备
是一种强氧化剂,常用作漂白剂、脱色剂、消毒剂、拔染剂等,能溶于水。某学习小组通过如图装置(夹持装置略)制备 。已知:
。已知: 饱和溶液在温度低于
饱和溶液在温度低于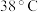 时析出晶体是
时析出晶体是 ,高于
,高于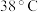 时析出晶体是
时析出晶体是 ,高于
,高于 时
时 分解成
分解成 和
和 。回答下列问题:
。回答下列问题:
(1)仪器B的名称是
(2)A中发生反应:
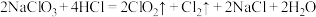 ,该反应中氧化剂与还原剂物质的量之比为
,该反应中氧化剂与还原剂物质的量之比为(3)
 比
比 更易溶于水的原因是
更易溶于水的原因是(4)该同学在实验时,打开活塞E,发现
 滴入几滴后即停止,此时该同学的操作是
滴入几滴后即停止,此时该同学的操作是(5)D中发生反应的离子方程式为
(6)该同学获得
 晶体的操作步骤为:取反应后D中液体,减压,
晶体的操作步骤为:取反应后D中液体,减压, 蒸发结晶,
蒸发结晶, 干燥,得到成品。
干燥,得到成品。(7)样品中
 (杂质为
(杂质为 )纯度的测定。取
)纯度的测定。取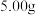 所得晶体配成溶液,用过量的草酸将其还原为
所得晶体配成溶液,用过量的草酸将其还原为 ,再加入足量的硝酸酸化的
,再加入足量的硝酸酸化的 溶液,经过滤、洗涤、干燥,得到白色沉淀
溶液,经过滤、洗涤、干燥,得到白色沉淀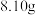 。
。①加入草酸时反应的化学方程式为
②
 的纯度为
的纯度为
您最近半年使用:0次
名校
9 . 二氧化氯( )是一种黄绿色气体,是国际上公认的安全、无毒的绿色消毒剂。二氧化氯的制备以及由二氧化氯制备一种重要的含氯消毒剂——亚氯酸钠(
)是一种黄绿色气体,是国际上公认的安全、无毒的绿色消毒剂。二氧化氯的制备以及由二氧化氯制备一种重要的含氯消毒剂——亚氯酸钠( )的工艺流程如图:
)的工艺流程如图:
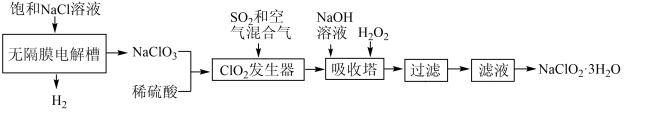
已知:① 的溶解度随温度升高而增大,适当条件下可结晶析出
的溶解度随温度升高而增大,适当条件下可结晶析出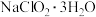 ;
;
②纯 易分解爆炸,一般用稀有气体或空气稀释到10%以下以保证安全。
易分解爆炸,一般用稀有气体或空气稀释到10%以下以保证安全。
下列说法正确的是
 )是一种黄绿色气体,是国际上公认的安全、无毒的绿色消毒剂。二氧化氯的制备以及由二氧化氯制备一种重要的含氯消毒剂——亚氯酸钠(
)是一种黄绿色气体,是国际上公认的安全、无毒的绿色消毒剂。二氧化氯的制备以及由二氧化氯制备一种重要的含氯消毒剂——亚氯酸钠( )的工艺流程如图:
)的工艺流程如图:
已知:①
 的溶解度随温度升高而增大,适当条件下可结晶析出
的溶解度随温度升高而增大,适当条件下可结晶析出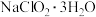 ;
;②纯
 易分解爆炸,一般用稀有气体或空气稀释到10%以下以保证安全。
易分解爆炸,一般用稀有气体或空气稀释到10%以下以保证安全。下列说法正确的是
| A.工业上的氯碱工业(制备烧碱和氯气)用的是阴离子交换膜 |
B.“ 发生器”中鼓入空气的作用是将 发生器”中鼓入空气的作用是将 氧化成 氧化成 |
C.“吸收塔”内发生反应的化学方程式为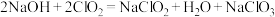 |
D.对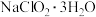 晶体进行重结晶可获得纯度更高的晶体 晶体进行重结晶可获得纯度更高的晶体 |
您最近半年使用:0次
解题方法
10 . 高纯度硝酸高铈铵主要用作有机合成的催化剂和氧化剂、集成电路的腐蚀剂等。它的化学式为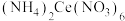 ,易溶于水,几乎不溶于浓硝酸。实验室用
,易溶于水,几乎不溶于浓硝酸。实验室用 溶液制备硝酸高铈铵的主要步骤如下:
溶液制备硝酸高铈铵的主要步骤如下:
Ⅰ.由 与
与 反应制备
反应制备 。
。
制备 的装置如图所示:
的装置如图所示:
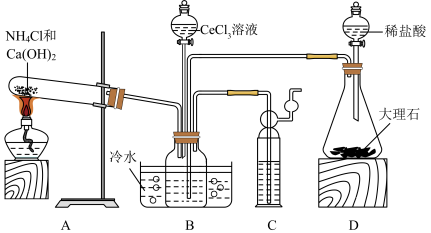
将装置A和D中所产生的气体通入装置B一段时间,再将 溶液滴入下方反应后的溶液中,从而制备
溶液滴入下方反应后的溶液中,从而制备 固体。
固体。
已知: 易被空气氧化成
易被空气氧化成 。
。
回答下列问题:
(1)装置D中盛放稀盐酸的实验仪器名称为___________ ,装置C的作用是___________ 。
(2)若装置A和装置D中所产生的气体物质的量之比超过___________ ,则B中会产生一种含铈的沉淀杂质。
(3)装置B中制备 反应的离子方程式为
反应的离子方程式为___________ 。
(4) 在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品
在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品 。检验是否洗涤干净的方法为
。检验是否洗涤干净的方法为___________ 。
Ⅱ.制备硝酸高铈铵并测其纯度。
取适量碳酸铈[ ]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入过氧化氢、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到(黄色难溶物)。将于一定温度下加入硝酸加热至浆状,生成
]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入过氧化氢、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到(黄色难溶物)。将于一定温度下加入硝酸加热至浆状,生成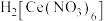 ,再加入稍过量的
,再加入稍过量的 晶体从而生成硝酸高铈铵沉淀,经过滤、洗涤、自然烘干后得到产品。取25.00g烘干后的产品,溶于水配成500mL待测溶液,取25.00mL待测液于锥形瓶中,加入足量酸性KI溶液,滴入2~3滴淀粉溶液;用0.1mol/L
晶体从而生成硝酸高铈铵沉淀,经过滤、洗涤、自然烘干后得到产品。取25.00g烘干后的产品,溶于水配成500mL待测溶液,取25.00mL待测液于锥形瓶中,加入足量酸性KI溶液,滴入2~3滴淀粉溶液;用0.1mol/L  溶液进行滴定,记录读数。重复实验后,平均消耗
溶液进行滴定,记录读数。重复实验后,平均消耗 溶液的体积为20.00mL。已知发生的反应为
溶液的体积为20.00mL。已知发生的反应为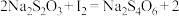
 。
。
(5)①写出生成 的离子方程式:
的离子方程式:___________ 。
②“氧化沉淀”时,加热的温度不宜过高,原因是___________ 。
③产品中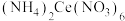 的质量分数为
的质量分数为___________ 。
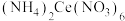 ,易溶于水,几乎不溶于浓硝酸。实验室用
,易溶于水,几乎不溶于浓硝酸。实验室用 溶液制备硝酸高铈铵的主要步骤如下:
溶液制备硝酸高铈铵的主要步骤如下:Ⅰ.由
 与
与 反应制备
反应制备 。
。制备
 的装置如图所示:
的装置如图所示:
将装置A和D中所产生的气体通入装置B一段时间,再将
 溶液滴入下方反应后的溶液中,从而制备
溶液滴入下方反应后的溶液中,从而制备 固体。
固体。已知:
 易被空气氧化成
易被空气氧化成 。
。回答下列问题:
(1)装置D中盛放稀盐酸的实验仪器名称为
(2)若装置A和装置D中所产生的气体物质的量之比超过
(3)装置B中制备
 反应的离子方程式为
反应的离子方程式为(4)
 在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品
在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到纯品 。检验是否洗涤干净的方法为
。检验是否洗涤干净的方法为Ⅱ.制备硝酸高铈铵并测其纯度。
取适量碳酸铈[
 ]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入过氧化氢、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到(黄色难溶物)。将于一定温度下加入硝酸加热至浆状,生成
]于铂皿中,用硝酸溶解生成硝酸铈溶液,然后加入过氧化氢、氨水进行氧化沉淀,加热后过滤、洗涤、烘干得到(黄色难溶物)。将于一定温度下加入硝酸加热至浆状,生成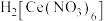 ,再加入稍过量的
,再加入稍过量的 晶体从而生成硝酸高铈铵沉淀,经过滤、洗涤、自然烘干后得到产品。取25.00g烘干后的产品,溶于水配成500mL待测溶液,取25.00mL待测液于锥形瓶中,加入足量酸性KI溶液,滴入2~3滴淀粉溶液;用0.1mol/L
晶体从而生成硝酸高铈铵沉淀,经过滤、洗涤、自然烘干后得到产品。取25.00g烘干后的产品,溶于水配成500mL待测溶液,取25.00mL待测液于锥形瓶中,加入足量酸性KI溶液,滴入2~3滴淀粉溶液;用0.1mol/L  溶液进行滴定,记录读数。重复实验后,平均消耗
溶液进行滴定,记录读数。重复实验后,平均消耗 溶液的体积为20.00mL。已知发生的反应为
溶液的体积为20.00mL。已知发生的反应为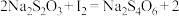
 。
。(5)①写出生成
 的离子方程式:
的离子方程式:②“氧化沉淀”时,加热的温度不宜过高,原因是
③产品中
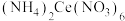 的质量分数为
的质量分数为
您最近半年使用:0次



