河北省衡水市安平县安平中学2019届高三上学期期中考试化学试题
河北
高三
期中
2018-12-17
752次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、化学反应原理、物质结构与性质、化学实验基础
一、单选题 添加题型下试题
| A.《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2 |
| B.“火树银花”中的焰火实质上是金属元素的焰色反应 |
| C.《汉书》中“高奴县有洧水可燃”这里的“洧水”指的是石油 |
| D.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 |
| A.煤的液化是物理变化 | B.天然气为可再生能源 |
| C.食盐溶于水会显著放热 | D.电解水的反应中含有电能转化为化学能的过程 |
| A.2O3(g)=3O2(g) ΔH<0 | B.2CO(g)=2C(s)+O2(g) ΔH>0 |
| C.N2(g)+3H2(g)⇌2NH3(g) ΔH<0 | D.CaCO3(s)=CaO(s)+CO2(g) ΔH>0 |
【知识点】 化学反应进行方向的判据 复合判据解读 反应进行方向判据的应用解读
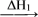 水
水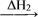 冰的转化中能量变化的叙述正确的是
冰的转化中能量变化的叙述正确的是| A.ΔH1>0,ΔH2>0 | B.ΔH1<0,ΔH2<0 |
| C.ΔH1>0,ΔH2<0 | D.ΔH1<0,ΔH2>0 |
A.质子数为8、中子数为10的氧原子: | B.氧原子的结构示意图: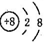 |
C.CaCl2的电子式: 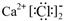 | D.明矾的化学式: KAl(SO4)2 |

| A.②①③④⑤⑥ | B.⑤④③①②⑥ |
| C.⑤④②①③⑥ | D.⑤③②④①⑥ |
【知识点】 金属的电化学腐蚀与防护 金属的化学腐蚀与电化学腐蚀解读
| A.放电时,Na+向负极迁移 |
| B.放电时,负极反应式为:Na-e-=Na+ |
| C.充电时,Na2CO3在阳极发生氧化反应 |
| D.TEGDME可用醇、羧酸类有机物代替 |
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1
H-H、O=O和O-H的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
| A.-332 | B.-118 | C.+350 | D.+130 |
| A.CO2、甲烷都属于温室气体 |
| B.用甘蔗生产的燃料乙醇属可再生能源,利用乙醇燃料不会产生温室气体 |
| C.太阳能、风能和生物质能属于新能源 |
| D.太阳能电池可将太阳能直接转化为电能 |
| A.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附 |
| B.“水滴石穿”不仅包含着“量变到质变”的哲学思想,同时也包含物理和化学变化 |
| C.节日燃放的烟花,是碱金属、锶、钡、铂、铁等金属元素焰色反应呈现的 |
| D.工厂中常用的静电除尘装置是根据胶体带电性的性质而设计的 |
| A.干冰升华和液氯气化时,都只需克服分子间作用力 |
| B.硫酸氢钠晶体溶于水,需要克服离子键和共价键 |
| C.氯化氢气体溶于水时,只有共价键的断裂,没有化学键的形成 |
| D.石墨转化金刚石,既有化学键的断裂,又有化学键的形成 |
| A.海带提碘 | B.氯碱工业 |
| C.氨碱法制碱 | D.海水提溴 |
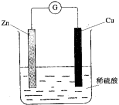
| A.Zn是负极,发生还原反应 |
| B.Cu是负极,发生氧化反应 |
| C.铜片上有气体逸出 |
| D.电子由铜片通过导线流向锌片 |

| A.该安装方式的水表更容易被腐蚀 |
| B.发生腐蚀过程中,电子从接头流向水表 |
C.腐蚀时水表发生的电极反应为: 2H2O+O2+4e− 4OH− 4OH− |
D.腐蚀过程还涉及反应:4Fe(OH)2+2H2O+O2 4Fe(OH)3 4Fe(OH)3 |
【知识点】 金属的电化学腐蚀与防护
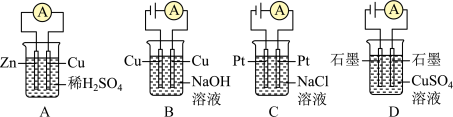
| A.A | B.B | C.C | D.D |
【知识点】 原电池原理 电解池电极反应式及化学方程式的书写与判断解读
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | |||
| A.在pH<4溶液中,碳钢主要发生析氢腐蚀 |
| B.在pH>6溶液中,碳钢主要发生吸氧腐蚀 |
| C.在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会减缓 |
| D.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O |
| A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,E反应物<E生成物 |
| B.CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.2kJ·mol-1,E反应物<E生成物 |
| C.2HCl(g)=H2(g)+Cl2(s) ΔH=+92.3kJ•mol-1,1molHCl在密闭容器中分解后放出92.3kJ的能量 |
D.将0.5molN2和1.5molH2置于密闭的容器中充分反应后生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6kJ·mol-1 2NH3(g) ΔH=-38.6kJ·mol-1 |
| A.阴极附近溶液呈红色 | B.阴极逸出气体 |
| C.阳极附近溶液呈蓝色 | D.溶液的pH变小 |
【知识点】 电解原理的应用 根据电解产物进行相关推断解读
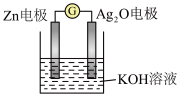
| A.Zn电极是负极 |
| B.Ag2O电极发生还原反应 |
| C.Zn电极的电极反应式:Zn-2e-+2OH-=Zn(OH)2 |
| D.放电前后电解质溶液的pH保持不变 |
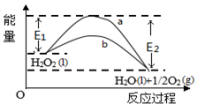
| A.有MnO2 条件下的反应曲线是a曲线 |
| B.该反应能量变化类型与CaCO3分解反应相同 |
| C.加催化剂后,正反应速率加快,逆反应速率减小 |
| D.b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH=( E1 - E2 )kJ•mol-1 |

| A.用装置甲进行中和热的测定 |
| B.用装置乙制取CO2气体 |
| C.用装置丙蒸发CH3COONa溶液得CH3COONa晶体 |
| D.用装置丁模拟工业制氨气并检验产物 |
| A.反应速率主要取决于Ⅰ步反应 |
| B.该反应逆反应的活化能大于198kJ/mol |
| C.2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量 |
| D.VO2在反应中起催化剂的作用降低了反应活化能加快反应速率 |
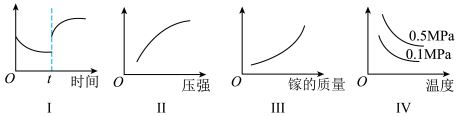
| A.Ⅰ图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压 |
| B.Ⅱ图像中纵坐标可以为镓的转化率 |
| C.Ⅲ图像中纵坐标可以为化学反应速率 |
| D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量 |
 完全燃烧生成一氧化碳放出
完全燃烧生成一氧化碳放出 的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
A.碳 的燃烧热 的燃烧热 为 为 |
B. 分解生成 分解生成 时放出 时放出 的热量 的热量 |
C.反应 的 的 为 为 |
D.足量炭粉与 反应生成 反应生成 的热化学方程式为 的热化学方程式为  |
【知识点】 化学反应热的计算 热化学方程式书写及正误判断解读
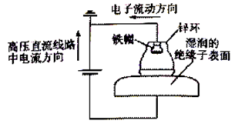
| A.阳极电极反应为Zn—2eˉ=Zn2+ |
| B.阴极电极反应为4OHˉ-4eˉ=O2↑+2H2O |
| C.该装置为牺牲阳极的阴极保护法 |
| D.绝缘子表面产生的OH- 向阴极移动 |
【知识点】 金属的电化学腐蚀与防护 电解原理的理解及判断解读 吸氧腐蚀解读
二、填空题 添加题型下试题
(1)N2和O2在一定条件下反应生成NO2的热化学方程式为:
1/2N2(g)+O2(g)====NO2(g) ΔH=+34 kJ·mol-1。该反应为
(2)化学反应中的能量变化源自于化学反应中化学键变化时产生的能量变化。下表为一些化学键的键能:
化学键 | 键能( kJ·mol-1) | 化学键 | 键能( kJ·mol-1) |
N≡N | 942 | H—O | 460 |
N—H | 391 | O==O | 499 |
H—H | 437 |
①写出N2和H2反应合成氨的热化学方程式
② 已知:1 mol H2O(g)转化为1 mol H2O(l)时放出44.0 kJ的热量。计算1 g H2完全燃烧时放出的热量
(3)写出NH3(g)在O2(g)中完全燃烧生成NO2(g)和H2O(g)的热化学方程式

(1)甲装置中,a电极的反应式为
(2)乙装置中,阴极区产物为
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为
(5)某工厂采用电解法处理含 Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为 Cr3+,Cr3+在阴极区生成 Cr(OH)3 沉淀除去,工作原理如图
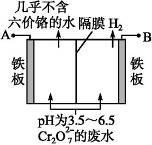
①写出电解时阴极的电极反应式
②写出 Cr2O72-被还原为 Cr3+的离子方程式
① N2 (g) +2O2 (g) == 2NO2(g) ΔH = +68 kJ•mol-1
② N2H4(l) + 3O2 (g) == 2NO2(g) + 2H2O (l) ΔH= -622kJ•mol-1
③ H2O (g) == H2O (l) ΔH = - 44 kJ•mol-1
(1)火箭发射时可用肼作燃料,NO2 作氧化剂,生成 N2 ( g) 和 H2O (g)。写出该反应的热化学方程式:
(2)肼具有弱碱性和强还原性,工业上利用尿素[CO(NH2)2]、NaClO 在 NaOH 溶液中发生反应生成水合肼(N2H4·H2O)、Na2CO3 等产物。上述生成水合肼的反应中尿素是
(3)肼已应用于燃料电池。以 N2H4(l)为燃料和O2(g)为氧化剂,Pt 为电极催化剂,阳离子交换膜(只允许H+ 透过)为电解质。电池反应产物只有 N2(g)和H2O(l)。通入肼的一极是电池的
(4)As2S3 和 HNO3 有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O。若生成 2 mol H3AsO4,则反应中转移电子的物质的量为
【知识点】 氧化还原反应方程式的配平解读 盖斯定律的应用解读 燃料电池
三、解答题 添加题型下试题
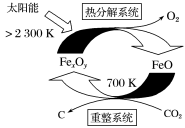
①“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为
(2)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则以CO2和H2反应合成甲醚的热化学方程式为
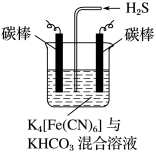
(3)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S===2[Fe(CN)6]4-+2HCO3-+S↓。电解时,阳极的电极反应式为
四、填空题 添加题型下试题
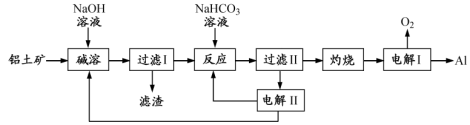
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是
(2)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为
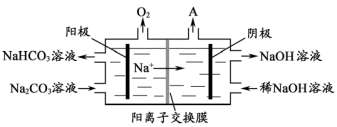
II.焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。制备Na2S2O5可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为
试卷分析
试卷题型(共 30题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 物理变化与化学变化 焰色试验 化学科学对人类文明发展的意义 | |
| 2 | 0.85 | 能量的相互转化 电解池概念及组成 化石能源 煤的液化 | |
| 3 | 0.65 | 化学反应进行方向的判据 复合判据 反应进行方向判据的应用 | |
| 4 | 0.85 | 能量的相互转化 常见能量转化形式 | |
| 5 | 0.85 | 元素符号、元素名称的书写 有关粒子结构的化学用语 化学用语综合判断 | |
| 6 | 0.65 | 金属的电化学腐蚀与防护 金属的化学腐蚀与电化学腐蚀 | |
| 7 | 0.65 | 原电池电极反应式书写 原电池原理的综合应用 其他二次电池 原电池、电解池综合考查 | |
| 8 | 0.65 | 盖斯定律的应用 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |
| 9 | 0.94 | 能源开发利用新理念 太阳能的利用 生物质能的利用 新能源的开发 | |
| 10 | 0.85 | 胶体的性质和应用 焰色试验 碳酸钠与碳酸氢钠的相互转化 铁 | |
| 11 | 0.4 | 化学反应中能量变化的原因 共价键与离子键的比较 化学键与物质类别关系的判断 分子间作用力概念及特征 | |
| 12 | 0.65 | 氧化还原反应基本概念 氯气的工业制法 海水提取溴 海带中碘的提取及检验 | |
| 13 | 0.65 | 原电池 原电池原理理解 原电池电子流向判断及应用 原电池正负极判断 | |
| 14 | 0.65 | 金属的电化学腐蚀与防护 | |
| 15 | 0.65 | 原电池原理 电解池电极反应式及化学方程式的书写与判断 | |
| 16 | 0.85 | 析氢腐蚀 吸氧腐蚀 | |
| 17 | 0.85 | 吸热反应和放热反应 | |
| 18 | 0.65 | 电解原理的应用 根据电解产物进行相关推断 | |
| 19 | 0.65 | 新型电池 | |
| 20 | 0.65 | 焓变 根据△H=反应物的键能之和-生成物的键能之和进行计算 催化剂对化学反应速率的影响 | |
| 21 | 0.65 | 氨气 中和热的测定与误差分析 蒸发与结晶 常见无机物的制备 | |
| 22 | 0.65 | 化学能与热能的相互转化 焓变产生原因及表示 盖斯定律理解 | |
| 23 | 0.65 | 影响化学反应速率的因素 化学平衡的移动及其影响因素 化学平衡图像分析 化学反应速率与化学平衡的综合应用 | |
| 24 | 0.65 | 化学反应热的计算 热化学方程式书写及正误判断 | |
| 25 | 0.4 | 金属的电化学腐蚀与防护 电解原理的理解及判断 吸氧腐蚀 | |
| 二、填空题 | |||
| 26 | 0.65 | 盖斯定律及其有关计算 吸热反应和放热反应 盖斯定律与热化学方程式 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |
| 27 | 0.4 | 电化学计算 电解池电极反应式及化学方程式的书写与判断 电解原理的应用实验 电解池有关计算 | |
| 28 | 0.4 | 氧化还原反应方程式的配平 盖斯定律的应用 燃料电池 | |
| 30 | 0.4 | 电解原理的应用 电解过程中溶液pH的变化 电解池电极反应式及化学方程式的书写与判断 | |
| 三、解答题 | |||
| 29 | 0.65 | 氧化还原反应有关计算 盖斯定律的应用 电解池电极反应式及化学方程式的书写与判断 | 原理综合题 |



