1 .  与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
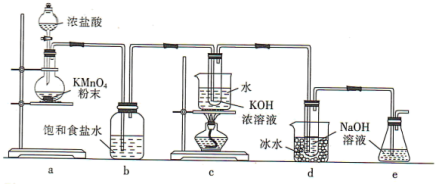
回答下列问题:
(1)a装置所用玻璃仪器的名称为______ (任意写一种);发生反应的离子方程式为____________ 。
(2)b装置的作用是____________ ;e装置的作用是____________ 。
(3)已知:c装置中得到的是 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。
①由此判断氯气与碱反应时,影响产物的因素有____________ 。
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时, 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为____________ 。
(4)取少量c、d装置中生成的 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显_______ 色。由此可推知,在碱性条件下, 的氧化能力
的氧化能力______ (填“>”或“<”)NaClO的氧化能力。
(5)该兴趣小组在40℃条件下,将一定量的 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为______ mol。
 与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
回答下列问题:
(1)a装置所用玻璃仪器的名称为
(2)b装置的作用是
(3)已知:c装置中得到的是
 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。①由此判断氯气与碱反应时,影响产物的因素有
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时,
 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为(4)取少量c、d装置中生成的
 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显 的氧化能力
的氧化能力(5)该兴趣小组在40℃条件下,将一定量的
 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为
您最近一年使用:0次
2022-07-12更新
|
113次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州2021-2022学年高二下学期期末质量检测化学试题
解题方法
2 . 锆产品的主要原料是锆英砂,全球90%的氧氯化锆(ZrOCl2)来源于中国。氧氯化锆可溶于水,微溶于盐酸,工业上以锆英砂(含91.5%ZrSiO4,杂质不与NaOH溶液反应)为原料生产ZrOCl2的一种工艺流程如图所示。
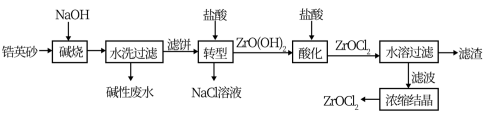
已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是____ ,“碱烧”时ZrSiO4生成了Na2ZrO3和另一种钠盐X,X的化学式为___ ,X的用途是___ (写一种)。
(2)“转型”时发生反应的化学方程式为___ 。
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是___ 。
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是___ 。
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成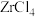 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为___ 。
(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为___ t。

已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是
(2)“转型”时发生反应的化学方程式为
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成
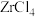 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为
您最近一年使用:0次
2021-10-01更新
|
516次组卷
|
5卷引用:贵州省黔西南州2021~2022学年高二上学期期中考试化学试题
贵州省黔西南州2021~2022学年高二上学期期中考试化学试题河南省偃师市第一高级中学2022届高三阶段性测试化学试题福建省南平市2022届高三10月联考化学试卷重庆市2021-2022学年高二上学期期中考试化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-测试
3 . 黄铜矿(主要成分为CuFeS2,还含有少量的SiO2和Al2O3)是制取铜及其化合物的主要原料之一,还可用于制备绿矾(化学式为FeSO4·7H2O)。
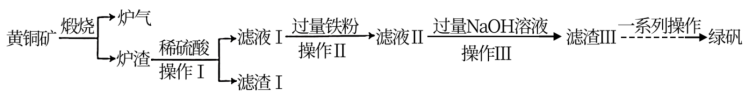
(1)黄铜矿“煅烧”时发生的反应为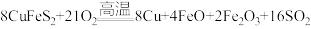 。若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是
。若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是___________ (填元素符号)。
(2)“滤渣Ⅰ”的主要成分为___________ ,“滤渣Ⅲ”的主要成分为___________ 。(填化学式)
(3)“滤液Ⅱ”中含有的金属阳离子有___________ (填离子符号)。
(4)上述“煅烧”过程会产生“炉气”(主要成分为SO2)。下列对“炉气”的处理方案中合理的是___________ (填标号)。
A.高空排放 B.用于制备硫酸
C.用纯碱溶液吸收制Na2SO3 D.用浓硫酸吸收
(5)“操作Ⅰ”的名称为___________ 。

(1)黄铜矿“煅烧”时发生的反应为
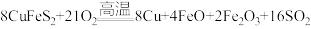 。若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是
。若CuFeS2中Fe的化合价为+2价,则该反应中被还原的元素是(2)“滤渣Ⅰ”的主要成分为
(3)“滤液Ⅱ”中含有的金属阳离子有
(4)上述“煅烧”过程会产生“炉气”(主要成分为SO2)。下列对“炉气”的处理方案中合理的是
A.高空排放 B.用于制备硫酸
C.用纯碱溶液吸收制Na2SO3 D.用浓硫酸吸收
(5)“操作Ⅰ”的名称为
您最近一年使用:0次
4 . 下表是元素周期表的一部分。根据表中的8种元素,用元素符号或化学式填空。
(1)元素f、g的最高价氧化物对应水化物的酸性:___________ >___________ 。
(2)元素d、g、h的简单离子中,半径最大的是___________ (填离子符号)。
(3)c和h形成的化合物 中含有的化学键类型为
中含有的化学键类型为___________ 。
(4)写出元素a和c形成原子个数比为1∶1的化合物的电子式:___________ 。
(5)写出d的最高价氧化物对应的水化物与h的最高价氧化物对应的水化物反应的离子方程式:___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | |||||||
| 2 | b | c | ||||||
| 3 | d | e | f | g | ||||
| 4 | h |
(2)元素d、g、h的简单离子中,半径最大的是
(3)c和h形成的化合物
 中含有的化学键类型为
中含有的化学键类型为(4)写出元素a和c形成原子个数比为1∶1的化合物的电子式:
(5)写出d的最高价氧化物对应的水化物与h的最高价氧化物对应的水化物反应的离子方程式:
您最近一年使用:0次
5 . Cl2既是实验室中的一种重要试剂,又是工业生产中的一种重要原料。
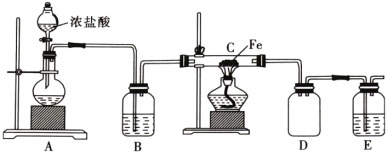
(1)实验室中利用铁屑与氯气反应制备 ,实验装置如图所示。
,实验装置如图所示。
①实验开始前,首先应________________________ 。
②盛浓盐酸的仪器的名称为________ 。
③装置A中观察到溶液紫色变浅,则发生反应的离子方程式为________________ ,还原剂为________ (填化学式,下同),氧化产物为________ 。
④每生成 时,消耗的
时,消耗的 为
为________ L (标准状况下),转移的电子数为________ 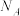 。
。
(2)E中所盛装的试剂为________ (填“氢氧化钙”或“氢氧化钠”)溶液,原因是________________________ 。

(1)实验室中利用铁屑与氯气反应制备
 ,实验装置如图所示。
,实验装置如图所示。①实验开始前,首先应
②盛浓盐酸的仪器的名称为
③装置A中观察到溶液紫色变浅,则发生反应的离子方程式为
④每生成
 时,消耗的
时,消耗的 为
为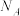 。
。(2)E中所盛装的试剂为
您最近一年使用:0次
名校
6 . 有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
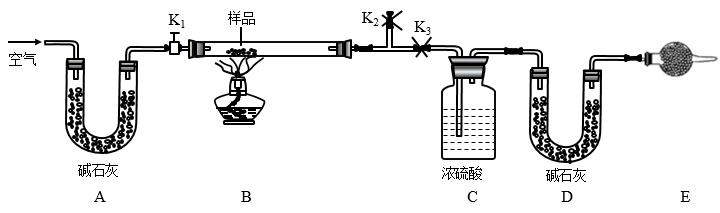
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是______ 。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是______ 。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为______ 、______ 。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对NaCl质量测定结果的影响是______ 。(填“偏大”“偏小”或“无影响”)。
②E处干燥管中盛放的药品是碱石灰,其作用是______ ,如果实验中没有该装置,则会导致测量结果NaHCO3的质量______ (填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为______ (用含w、m1、m2的代数式表示)。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对NaCl质量测定结果的影响是
②E处干燥管中盛放的药品是碱石灰,其作用是
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为
您最近一年使用:0次
2021-02-20更新
|
428次组卷
|
20卷引用:贵州省贞丰县第二中学2019-2020学年高一上学期期末考试化学试题
贵州省贞丰县第二中学2019-2020学年高一上学期期末考试化学试题云南省通海三中2019-2020学年高一上学期期末考试化学试题云南省玉溪市通海二中2019-2020学年高一上学期期末考试化学试题云南省迪庆州维西县第二中学2019-2020学年高一上学期期末考试化学试题云南省富宁县三中2019-2020学年高一上学期期末考试化学试题云南省普洱市镇沅县第一中学2019—2020学年高一上学期期末考试化学试题云南省丽江市永胜县第二中学2019—2020学年高一上学期期末考试化学试题云南省盐津县第三中学2019-2020学年高一上学期期末考试化学试题云南省昭通市彝良县一中2019—2020学年高一上学期期末考试化学试题云南省昭通市大关县第二中学2019-2020学年高一上学期期末考试化学试题贵州省榕江县第三高级中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市马龙区第二中学2019-2020学年 高一上学期期末考试化学试题云南省曲靖市富源县第六中学2019-2020学年高一上学期期末考试化学试题云南省昆明市寻甸县第五中学2019-2020学年高一上学期期末考试化学试题广西河池市都安第五高中2019-2020学年高一上学期期末考试化学试题广西来宾市象州县中学2019-2020学年高一上学期期末考试化学试题四川省泸县第五中学2019-2020学年高一下学期第一次在线月考化学试题安徽省滁州市定远县重点中学2020-2021学年高一10月月考化学试题重庆实验中学2020-2021学年高一上学期第一阶段测试化学试题四川省遂宁中学校2020-2021学年高一上学期12月月考化学试题
7 . 如表列出了①~⑥六种元素在周期表中的位置:
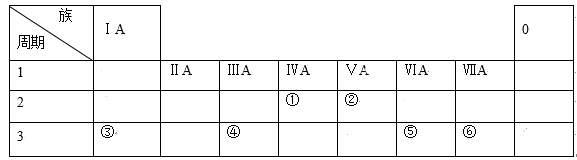
请按要求回答下列问题。
(1)元素①的元素符号是___ 。
(2)元素②的单质电子式是___ 。
(3)元素⑤的原子结构示意图是___ 。
(4)这六种元素中,位于第三周期且原子半径最小的是___ (填元素符号)。
(5)这六种元素的最高价氧化物中,属于两性氧化物的元素是___ (填元素符号)。
(6)请用电子式表示③⑥组成化合物的形成过程___ 。

请按要求回答下列问题。
(1)元素①的元素符号是
(2)元素②的单质电子式是
(3)元素⑤的原子结构示意图是
(4)这六种元素中,位于第三周期且原子半径最小的是
(5)这六种元素的最高价氧化物中,属于两性氧化物的元素是
(6)请用电子式表示③⑥组成化合物的形成过程
您最近一年使用:0次
解题方法
8 . 某校化学兴趣小组为研究Cl2的性质并制备氯水,用如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
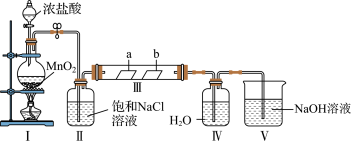
(1)加入药品前,检查I中气体发生装置气密性的操作是__ 。
(2)装置Ⅰ中发生反应的化学方程式为__ 。
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在__ 和___ (填装置序号)之间添加洗气装置,该装置的作用是___ 。
(4)装置V中NaOH溶液的作用是__ ,相关反应的化学方程式为___ 。
(5)反应完毕,为探究装置Ⅳ中溶质的成分,需要的试剂主要有__ 。

(1)加入药品前,检查I中气体发生装置气密性的操作是
(2)装置Ⅰ中发生反应的化学方程式为
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在
(4)装置V中NaOH溶液的作用是
(5)反应完毕,为探究装置Ⅳ中溶质的成分,需要的试剂主要有
您最近一年使用:0次
2020-02-24更新
|
86次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州晴隆县第二中学2019-2020学年高一上学期期末考试化学试题
解题方法
9 . 某化学实验小组利用实验室中的一瓶未知白色固体粉末进行了如下实验:
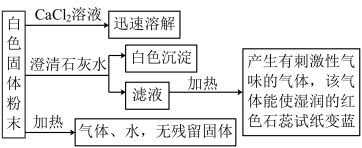
请回答下列问题:
(1)白色沉淀为______________________ (填化学式,下同),产生的有刺激性气味的气体是_____________________ 。
(2)该白色固体粉末是___________________ (填化学式)。
(3)写出该白色固体粉末受热分解的化学方程式:_______________________________

请回答下列问题:
(1)白色沉淀为
(2)该白色固体粉末是
(3)写出该白色固体粉末受热分解的化学方程式:
您最近一年使用:0次
2020-02-24更新
|
345次组卷
|
4卷引用:贵州省黔西南布依族苗族自治州望谟民族中学2019-2020学年高一上学期期末考试化学试题
贵州省黔西南布依族苗族自治州望谟民族中学2019-2020学年高一上学期期末考试化学试题人教版(2019)必修第二册第五章第二节 课时2 氨和铵盐(已下线)3.3.2 氨的转化与生成练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)必修第二册RJ第5章第二节 氮及其化合物 课时2 氨和铵盐
名校
解题方法
10 . 有一包固体可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展如图所示的实验:

已知:①步骤Ⅰ中固体全部溶解,溶液呈蓝色,且无气泡产生。
②步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。
请回答下列问题:
(1)原固体中一定含有的物质是___________________________________________ (填化学式)。
(2)原固体中一定不含有的物质是________________________________________ (填化学式),原因是________________________________________________________________________ 。
(3)写出步骤Ⅱ、Ⅲ中生成白色沉淀的离子方程式:___________________________________ 。
(4)步骤Ⅲ所得蓝色溶液中一定含有的溶质是_____________________________ (填化学式)。

已知:①步骤Ⅰ中固体全部溶解,溶液呈蓝色,且无气泡产生。
②步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。
请回答下列问题:
(1)原固体中一定含有的物质是
(2)原固体中一定不含有的物质是
(3)写出步骤Ⅱ、Ⅲ中生成白色沉淀的离子方程式:
(4)步骤Ⅲ所得蓝色溶液中一定含有的溶质是
您最近一年使用:0次
2020-02-23更新
|
194次组卷
|
4卷引用:贵州省黔西南布依族苗族自治州册亨县第三中学2019-2020学年高一上学期期末考试化学试题



