解题方法
1 . 无机研究开创绝不无“钴”的时代,例如: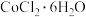 是一种饲料营养强化剂,草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为
是一种饲料营养强化剂,草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 工艺流程如图所示:
工艺流程如图所示:
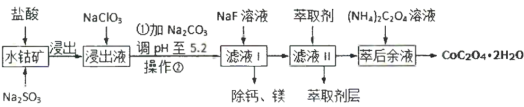
已知:①浸出液含有的阳离子主要有 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;
②酸性条件下, 不会氧化
不会氧化 ,
, 转化为
转化为 ;
;
③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
回答下列问题:
(1)酸浸过程中, 参与反应的离子方程式为:
参与反应的离子方程式为:___________ 。
(2) 的作用是
的作用是___________ 。
(3)操作②的名称是___________ ,在实验室完成此操作所用到的玻璃仪器有:___________ 。
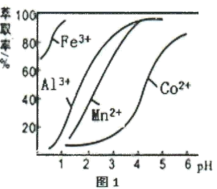
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的选择的标准是___________ (至少答两点);其使用的适宜pH范围是___________ (填字母代号)。
A.1.0~2.0 B.3.0~3.5 C.4.5~5.0
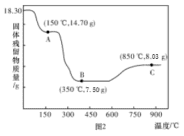
(5) 热分解质量变化过程如图2所示。A、B、C三点所得产物均为纯净物,其中600℃以前是隔绝空气加热,反应后最终可以得到金属钴;600℃以后是在空气中加热。则C点所示产物的化学式是
热分解质量变化过程如图2所示。A、B、C三点所得产物均为纯净物,其中600℃以前是隔绝空气加热,反应后最终可以得到金属钴;600℃以后是在空气中加热。则C点所示产物的化学式是___________ 。
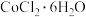 是一种饲料营养强化剂,草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为
是一种饲料营养强化剂,草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 工艺流程如图所示:
工艺流程如图所示:
已知:①浸出液含有的阳离子主要有
 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;②酸性条件下,
 不会氧化
不会氧化 ,
, 转化为
转化为 ;
;③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
| 沉淀物 |  |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
回答下列问题:
(1)酸浸过程中,
 参与反应的离子方程式为:
参与反应的离子方程式为:(2)
 的作用是
的作用是(3)操作②的名称是
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的选择的标准是
A.1.0~2.0 B.3.0~3.5 C.4.5~5.0


(5)
 热分解质量变化过程如图2所示。A、B、C三点所得产物均为纯净物,其中600℃以前是隔绝空气加热,反应后最终可以得到金属钴;600℃以后是在空气中加热。则C点所示产物的化学式是
热分解质量变化过程如图2所示。A、B、C三点所得产物均为纯净物,其中600℃以前是隔绝空气加热,反应后最终可以得到金属钴;600℃以后是在空气中加热。则C点所示产物的化学式是
您最近半年使用:0次
2 . 下列离子检验说法正确的是
A.某溶液中滴加Ba(NO3)2溶液产生白色沉淀,该溶液中有SO |
B.某溶液中滴加HNO3溶液产生气体,该溶液中一定有CO |
| C.某溶液中滴加酸性KMnO4溶液,酸性KMnO4溶液褪色,该溶液一定有Fe2+ |
| D.某溶液中滴加KSCN溶液,溶液变为红色,该溶液中一定有Fe3+ |
您最近半年使用:0次
名校
解题方法
3 . 硫元素的价类二维图如图所示。下列说法错误的是
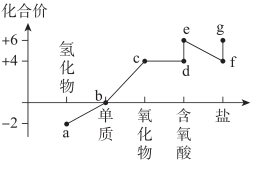

| A.a与c、d、e都有可能反应生成b |
B.d溶液久置于空气中会生成e,溶液的 减小 减小 |
| C.盐g与盐f之间也可能发生反应 |
D.铜与e的浓溶液共热产生的气体通入 溶液中,无明显现象 溶液中,无明显现象 |
您最近半年使用:0次
2021-05-11更新
|
2526次组卷
|
12卷引用: 重庆市2023-2024学年高三下学期2月月度质量检测化学试题
重庆市2023-2024学年高三下学期2月月度质量检测化学试题山东省青岛市2021届高三二模化学试题(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练(已下线)专题06 物质结构 元素周期律-备战2022年高考化学真题及地市好题专项集训【山东专用】辽宁省实验中学2022届高三第一次阶段性考试化学试题(已下线)第03讲 硫酸根离子的检验 含硫物质的转化(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)(已下线)第四章 非金属及其化合物 第21练 硫酸 含硫物质的转化吉林省长春市第八中学2022-2023学年高一下学期4月考试化学试题(已下线)选择题6-10宁夏石嘴山市第三中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
4 . 下列溶液在空气中因发生化学反应而质量增大的是
| A.Na2SO3溶液 | B.盐酸 | C.浓硫酸 | D.稀硫酸 |
您最近半年使用:0次
2021-04-21更新
|
199次组卷
|
4卷引用:重庆市乌江新高考协作体2022-2023学年高一下学期7月期末考试化学试题
2021·上海崇明·二模
名校
解题方法
5 . 在溶液中加入少量Na2O2后仍能大量共存的离子组是
A. 、 、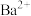 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近半年使用:0次
2021-04-12更新
|
1124次组卷
|
8卷引用:2022年重庆高考真题化学试题变式题(选择题1-5)
(已下线)2022年重庆高考真题化学试题变式题(选择题1-5)上海市崇明区2021届高三下学期二模化学试题(已下线)专题04 离子反应(热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练江苏省响水中学2021-2022学年高一下学期第三次学情分析考试化学试题北京市顺义牛栏山第一中学2021-2022学年高一下学期居家学习成果展示化学测试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高一下学期期末考试化学试题辽宁省北镇市满族高级中学2022-2023学年高三上学期第一次质量检测化学试题内蒙古自治区乌兰浩特第一中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
6 . 为了检验某溶液中是否含有硫酸根离子,下列操作最合理的是
| A.先加硝酸钡溶液产生白色沉淀,再加盐酸,白色沉淀不溶解则原溶液中含有硫酸根 |
| B.先加硝酸钡溶液产生白色沉淀,再加稀硝酸,白色沉淀不溶解则原溶液中含有硫酸根 |
| C.先用盐酸酸化无明显现象,再加氯化钡溶液,若有白色沉淀则原溶液中含有硫酸根 |
| D.先用硝酸酸化无明显现象,再加氯化钡溶液,若有白色沉淀则原溶液中含有硫酸根 |
您最近半年使用:0次
2021-04-08更新
|
242次组卷
|
3卷引用:重庆市巴蜀中学2020-2021学年高一3月月考化学试题
重庆市巴蜀中学2020-2021学年高一3月月考化学试题(已下线)期中01-2020-2021学年高一化学章末集训必刷卷(人教版2019必修第二册)黑龙江省漠河市高级中学2021-2022学年高一上学期第一次月考化学试题
名校
7 . 下列溶液加热蒸干后,能析出溶质固体的是
| A.AlCl3 | B.KHCO3 | C.Fe2(SO4)3 | D.Na2SO3 |
您最近半年使用:0次
名校
解题方法
8 . 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
已知: (橙色) +H2O
(橙色) +H2O
 (黄色) + 2H+
(黄色) + 2H+
(1)进行实验ⅰ和ⅱ:
①用离子方程式表示饱和Na2SO3溶液pH约为9的原因:______________________ 。
②用离子方程式解释i中现象:______________________ 。
(2)继续进行实验ⅲ:
为了说明产生上述现象的原因,补充实验ⅳ:
向2 mL蒸馏水中滴加pH=2的0.05 mol/L K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验ⅳ的目的是______________________ 。
②用化学平衡移动原理解释iii中现象:______________________ 。
③根据实验ⅰ~ⅲ,可推测:Na2SO3溶液和铬( VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬( VI)盐溶液不发生氧化还原反应;
b.______________________ 。
④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是______________ 。
已知:
 (橙色) +H2O
(橙色) +H2O
 (黄色) + 2H+
(黄色) + 2H+(1)进行实验ⅰ和ⅱ:
| 序号 | 操作 | 现象 |
| ⅰ | 向2 mLpH=2的0.05 mol/LK2Cr2O7的橙色溶液中滴加饱和Na2SO3溶液(pH约为9)3滴 | 溶液变绿色(含Cr3+) |
| ⅱ | 向2 mLpH=8的0.1 mol/L的K2CrO4黄色溶液中滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
②用离子方程式解释i中现象:
(2)继续进行实验ⅲ:
| 序号 | 操作 | 现象 |
| ⅲ | 向2 mL饱和Na2SO3溶液中滴加pH=2的0.05 mol/LK2Cr2O7的橙色溶液3滴 | 溶液变黄色 |
向2 mL蒸馏水中滴加pH=2的0.05 mol/L K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验ⅳ的目的是
②用化学平衡移动原理解释iii中现象:
③根据实验ⅰ~ⅲ,可推测:Na2SO3溶液和铬( VI)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬( VI)盐溶液不发生氧化还原反应;
b.
④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是
您最近半年使用:0次
2020-12-29更新
|
468次组卷
|
5卷引用:重庆市第三十二中学2020-2021学年高二上学期期末考试化学试题
名校
解题方法
9 . 下列实验操作和现象、结论或目的均正确的是
| 选项 | 操作和现象 | 结论或目的 |
| A | 向某溶液中滴加盐酸,再加Ba(NO3)2溶液,有白色沉淀生成 | 原溶液中一定含有SO |
| B | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 | 黑色固体中可能含有Fe3O4 |
| C | 用托盘天平称取1.0g NaOH固体,在烧杯中加少量蒸馏水溶解,转移至250mL容量瓶中定容 | 配制250mL 0.1nol/L的NaOH溶液 |
| D | 用 pH 试纸分别测定等浓度的 NaClO 和NaHCO3溶液的 pH,pH:NaClO> NaHCO3 | 碱性:NaClO> NaHCO3 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
10 . 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置Ⅲ中有Na2S2O5黄色晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。

(1)装置Ⅰ中盛放浓硫酸的仪器名称为_____ ;装置Ⅰ中产生气体的化学方程式为______ 。
(2)装置Ⅱ的作用之一是观察SO2的生成速率,盛装的试剂为_____ 。
(3)要从装置Ⅲ中获得已析出的晶体,可采取的分离方法是_____ 。
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3
(4)证明NaHSO3溶液中 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是_____ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是_______ 。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_______ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果______ (填“偏高”“偏低”或“不变”)。
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置Ⅲ中有Na2S2O5黄色晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。

(1)装置Ⅰ中盛放浓硫酸的仪器名称为
(2)装置Ⅱ的作用之一是观察SO2的生成速率,盛装的试剂为
(3)要从装置Ⅲ中获得已析出的晶体,可采取的分离方法是
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3
(4)证明NaHSO3溶液中
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
②在上述实验过程中,若有部分HI被空气氧化,则测得结果
您最近半年使用:0次
2020-09-21更新
|
457次组卷
|
2卷引用:重庆实验中学2021届高三第一学月测试化学试题



