解题方法
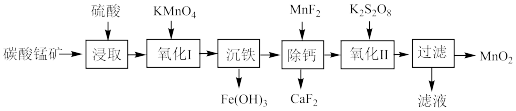
1 . 以碳酸锰矿(含 和少量FeO、
和少量FeO、 、CaO)为原料制取
、CaO)为原料制取 的工业流程如图所示。已知:
的工业流程如图所示。已知: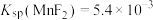 ,
,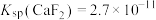 ,
, 氧化性强于
氧化性强于 ,其还原产物为
,其还原产物为 。
。
(1)Mn在元素周期表中的位置___________ 。
(2)为提高碳酸锰矿浸取速率,在用硫酸“浸取”时可采取的措施有:①___________ ;②搅拌;③适当升高温度等。
(3)“氧化I”的离子方程式为___________ 。
(4)“沉铁”过程加入的含钙元素的沉铁剂可能为___________ (写出一种即可)。
(5)若“除钙”后溶液中 ,则此时溶液中
,则此时溶液中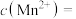
___________ mol/L。
(6)“氧化II”需加入 且过量,其原因是
且过量,其原因是___________ 。
(7)“过滤”后的滤液的溶质主要是___________ (填化学式)和过量的 。
。
 和少量FeO、
和少量FeO、 、CaO)为原料制取
、CaO)为原料制取 的工业流程如图所示。已知:
的工业流程如图所示。已知: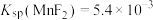 ,
,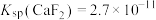 ,
, 氧化性强于
氧化性强于 ,其还原产物为
,其还原产物为 。
。
(1)Mn在元素周期表中的位置
(2)为提高碳酸锰矿浸取速率,在用硫酸“浸取”时可采取的措施有:①
(3)“氧化I”的离子方程式为
(4)“沉铁”过程加入的含钙元素的沉铁剂可能为
(5)若“除钙”后溶液中
 ,则此时溶液中
,则此时溶液中
(6)“氧化II”需加入
 且过量,其原因是
且过量,其原因是(7)“过滤”后的滤液的溶质主要是
 。
。
您最近一年使用:0次
2024-09-17更新
|
85次组卷
|
2卷引用:山西省吕梁市2025届高三上学期开学考试化学试题
解题方法
2 . 实验室制取氮气的一种方法为 。下列有关化学用语表示正确的是
。下列有关化学用语表示正确的是
 。下列有关化学用语表示正确的是
。下列有关化学用语表示正确的是A. 的VSEPR模型为三角锥形 的VSEPR模型为三角锥形 |
B. 和 和 的球棍模型均为 的球棍模型均为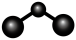 |
C.离子化合物 的电子式为 的电子式为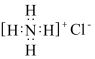 |
D. 中某一个 中某一个 键的形成可表示为 键的形成可表示为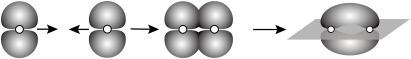 |
您最近一年使用:0次
2024-09-17更新
|
114次组卷
|
2卷引用:山西省吕梁市2025届高三上学期开学考试化学试题
解题方法
3 . 下列有关化学应用或性质的判断正确的是
| A.利用核磁共振氢谱无法鉴别丙烯和丙醛 |
B.制作豆腐时常添加石膏,体现了 的难溶性 的难溶性 |
| C.氧化铁是质地疏松的红色固体,用做颜料为生活带来一抹红 |
| D.高分子材料聚四氟乙烯可由四氟乙烯加聚合成,且受热易分解 |
您最近一年使用:0次
2024-09-17更新
|
69次组卷
|
2卷引用:山西省吕梁市2025届高三上学期开学考试化学试题
4 .  会与溶液中的
会与溶液中的 形成多种配合物,
形成多种配合物,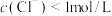 时,溶液中相关微粒主要有如下2个平衡:
时,溶液中相关微粒主要有如下2个平衡:
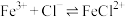
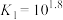
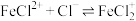
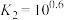
改变 的起始浓度,测得平衡时
的起始浓度,测得平衡时 、
、 、
、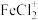 的分布系数
的分布系数 随
随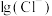 的变化如图所示(部分图)。已知:
的变化如图所示(部分图)。已知: ,
,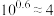 。下列说法正确的是
。下列说法正确的是
 会与溶液中的
会与溶液中的 形成多种配合物,
形成多种配合物,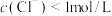 时,溶液中相关微粒主要有如下2个平衡:
时,溶液中相关微粒主要有如下2个平衡: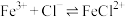
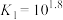
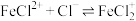
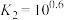
改变
 的起始浓度,测得平衡时
的起始浓度,测得平衡时 、
、 、
、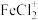 的分布系数
的分布系数 随
随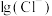 的变化如图所示(部分图)。已知:
的变化如图所示(部分图)。已知: ,
,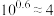 。下列说法正确的是
。下列说法正确的是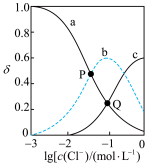
A.曲线c表示的微粒是 |
B.Q点溶液中 |
C.Q点溶液中 的平衡转化率约为83% 的平衡转化率约为83% |
D.P点溶液中一定存在: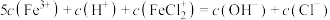 |
您最近一年使用:0次
2024-09-17更新
|
117次组卷
|
2卷引用:山西省吕梁市2025届高三上学期开学考试化学试题
解题方法
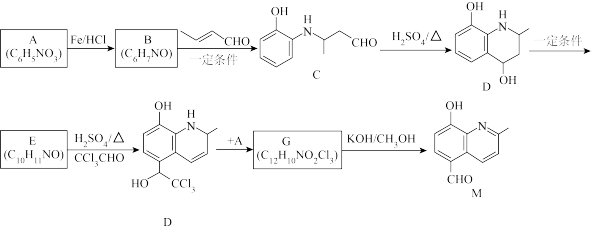
5 . 化合物M是一种重要的有机合成中间体,可用于光电材料等领域。由化合物A制备M的一种合成路线如图所示。
(1)A的结构简式为___________ ;B的化学名称为___________ 。
(2)C的含氧官能团的名称为___________ ;C→D反应的反应类型为___________ 反应。
(3)M分子中 杂化的C原子有
杂化的C原子有___________ 个,1molM在一定条件下与足量 发生加成反应,最多消耗
发生加成反应,最多消耗 的物质的量为
的物质的量为___________ mol。
(4)E→F反应的化学方程式为___________ 。
(5)同时满足下列条件的C的同分异构体有___________ 种(不考虑立体异构)。
①苯环上连接有2个取代基,其中一个为 ;
;
②能发生水解反应和银镜反应。
已知:①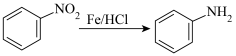
②
(1)A的结构简式为
(2)C的含氧官能团的名称为
(3)M分子中
 杂化的C原子有
杂化的C原子有 发生加成反应,最多消耗
发生加成反应,最多消耗 的物质的量为
的物质的量为(4)E→F反应的化学方程式为
(5)同时满足下列条件的C的同分异构体有
①苯环上连接有2个取代基,其中一个为
 ;
;②能发生水解反应和银镜反应。
您最近一年使用:0次
2024-09-17更新
|
110次组卷
|
2卷引用:山西省吕梁市2025届高三上学期开学考试化学试题
解题方法
6 . 化合物Z是合成非诺洛芬的中间体,其合成路线如图所示。下列说法错误的是
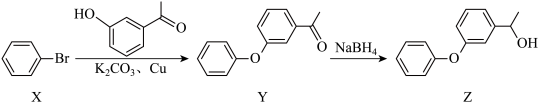
| A.Y在一定条件下可发生氧化、还原、取代反应 |
B. 分子中最多有8个C原子共平面 分子中最多有8个C原子共平面 |
C.从Y和Z分子结构可知, 具有还原性 具有还原性 |
D.Z与足量 发生加成反应的产物中有4个手性C原子 发生加成反应的产物中有4个手性C原子 |
您最近一年使用:0次
2024-09-17更新
|
161次组卷
|
2卷引用:山西省吕梁市2025届高三上学期开学考试化学试题
解题方法
7 . 下列装置(或操作)可完成对应实验的是
| A | B |
|
|
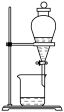
| 混合浓硫酸和乙醇 | 分离碘酒中的碘和乙醇 |
| C | D |
|
|
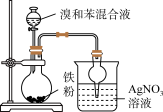
| 检验溴和苯反应有HBr生成 | 排空气法收集 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-09-17更新
|
117次组卷
|
2卷引用:山西省吕梁市2025届高三上学期开学考试化学试题
解题方法
8 . 短周期主族元素X、Y、Z、W的电负性依次增大,其中Y、Z、W位于同一周期,X元素的一种原子不含中子,四种元素可以形成结构如图所示的化合物,该化合物常用来检验 。下列有关说法错误的是
。下列有关说法错误的是
 。下列有关说法错误的是
。下列有关说法错误的是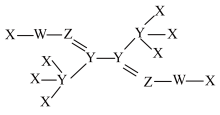
| A.图中所示化合物可形成分子间氢键 |
B.第一电离能大小关系: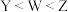 |
C.X和Z组成的常见分子中X和Z之间的化学键是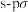 键 键 |
D.图中所示化合物可与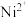 形成具有特征颜色的配位化合物 形成具有特征颜色的配位化合物 |
您最近一年使用:0次
2024-09-17更新
|
36次组卷
|
2卷引用:山西省吕梁市2025届高三上学期开学考试化学试题
解题方法
9 . 化学储氢的方法较多,将二氧化碳催化加氢制取甲醇是一种的常见的储氢方式,该过程涉及的主要反应如下。
反应I:
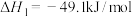
反应II:
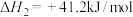
回答下列问题:
(1)反应I一般是在___________ (填“高温”或“低温”)条件下,可自发正向进行。
(2)工业上可通过改变催化剂的组成来提高甲醇的选择性和产率。在553K、4MPa条件下, 时,不同催化剂组成对甲醇时空产率、选择性及副产物CO的选择性的影响如表所示。
时,不同催化剂组成对甲醇时空产率、选择性及副产物CO的选择性的影响如表所示。
其中,wt.%指质量分数: 时空产率是指在给定条件下,单位时间内,使用单位质量的催化剂产生甲醇的质量。时空产率常用来评价催化剂活性。
时空产率是指在给定条件下,单位时间内,使用单位质量的催化剂产生甲醇的质量。时空产率常用来评价催化剂活性。
①该反应条件下工业生产中可选择___________ (填序号)组催化剂,原因是___________ 。
②在553K、4MPa条件下,使用第1组催化剂时, 不同比例时,对
不同比例时,对 的转化率、
的转化率、 的产率和CO的产率的影响如图所示,不论
的产率和CO的产率的影响如图所示,不论 比例为多少,副产物CO的产率总是高于甲醇产率,其原因可能是
比例为多少,副产物CO的产率总是高于甲醇产率,其原因可能是___________ 。 时,在553K、4MPa以及某催化剂条件下,达到平衡时
时,在553K、4MPa以及某催化剂条件下,达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为60%,此时,
的选择性为60%,此时, 气体物质的量分数为
气体物质的量分数为___________ %(结果保留1位小数),甲醇的平衡分压
___________ MPa。[已知: 的选择性
的选择性 ]
]
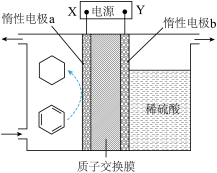
(4)利用如图所示电化学装置也可实现化学储氢,Y为电源的___________ (填“正”或“负”)极;电解一段时间后稀硫酸的pH___________ (填“增大”“减小”或“不变”)。
反应I:

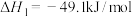
反应II:

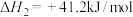
回答下列问题:
(1)反应I一般是在
(2)工业上可通过改变催化剂的组成来提高甲醇的选择性和产率。在553K、4MPa条件下,
 时,不同催化剂组成对甲醇时空产率、选择性及副产物CO的选择性的影响如表所示。
时,不同催化剂组成对甲醇时空产率、选择性及副产物CO的选择性的影响如表所示。| 序号 | 组成 | CuO/ Wt.% | ZnO Wt.% |  wt.% wt.% |  wt.% wt.% | MnO Wt.% | 甲醇时空产率 | 甲醇选择性 | CO选择性 |
| 1 | CuO/ZnO/ | 65.8 | 26.3 | 7.9 | 0 | 0 | 78 | 40 | 60 |
| 2 | CuO/ZnO/ | 62.4 | 25.0 | 0 | 12.6 | 0 | 96 | 88 | 12 |
| 3 | CuO/ZnO/ /MnO /MnO | 65.8 | 26.6 | 0 | 3.6 | 4 | 88 | 100 | 0 |
| 4 | CuO/ZnO/ /MnO /MnO | 65.8 | 26.6 | 0 | 5.6 | 2 | 138 | 91 | 9 |
 时空产率是指在给定条件下,单位时间内,使用单位质量的催化剂产生甲醇的质量。时空产率常用来评价催化剂活性。
时空产率是指在给定条件下,单位时间内,使用单位质量的催化剂产生甲醇的质量。时空产率常用来评价催化剂活性。①该反应条件下工业生产中可选择
②在553K、4MPa条件下,使用第1组催化剂时,
 不同比例时,对
不同比例时,对 的转化率、
的转化率、 的产率和CO的产率的影响如图所示,不论
的产率和CO的产率的影响如图所示,不论 比例为多少,副产物CO的产率总是高于甲醇产率,其原因可能是
比例为多少,副产物CO的产率总是高于甲醇产率,其原因可能是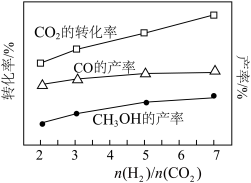
 时,在553K、4MPa以及某催化剂条件下,达到平衡时
时,在553K、4MPa以及某催化剂条件下,达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为60%,此时,
的选择性为60%,此时, 气体物质的量分数为
气体物质的量分数为
 的选择性
的选择性 ]
](4)利用如图所示电化学装置也可实现化学储氢,Y为电源的
您最近一年使用:0次
2024-09-17更新
|
82次组卷
|
2卷引用:山西省吕梁市2025届高三上学期开学考试化学试题
名校
10 . H2S是一种有毒气体,利用H2S与CH4的反应可将其转化为有价值的H2、S2等。发生的反应有:
反应ⅰ: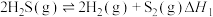
反应ⅱ:
回答下列问题:
(1)CO2中心原子价层电子对数为________ 。
(2)已知相关化学键的键能如下表:
反应ⅰ: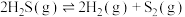 的
的
________ kJ⋅mol-1。
(3)一定温度下,在体积为2L的刚性容器中,充入1molCH4和2molH2S,发生反应i和反应ⅱ,5min时反应达到平衡,H2S的平衡转化率为40%, 。
。
①下列叙述中能说明反应ⅱ达到平衡状态的是________ (填字母)。
A. B.混合气体的密度不再变化
B.混合气体的密度不再变化
C.断裂1molC—H的同时生成1molC=S D.混合气体的平均摩尔质量不再变化
②0~5min内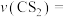
________ mol⋅L-1⋅min-1。
③此温度下,反应ⅱ的平衡常数Kx=________ (Kx是以平衡物质的量分数代替平衡浓度计算的平衡常数)。
(4)在常压和不同温度下,将H2S和CH4按照2∶1的体积比充入热解器中,用N2稀释,发生反应ⅰ和反应ⅱ。反应相同时间后,H2、S2和CS2的体积分数随温度的变化关系如图所示。
________ (填“>”“<”或“=”)0,低于1000℃时反应ⅱ________ (填“能”或“不能”)发生。
②1050℃时,H2的体积分数为________ 。
③温度高于1100℃时,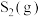 体积分数减小的原因是
体积分数减小的原因是________ 。
反应ⅰ:
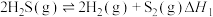
反应ⅱ:

回答下列问题:
(1)CO2中心原子价层电子对数为
(2)已知相关化学键的键能如下表:
化学键 | H—H | H—S | S2(化学键视为S—S) |
键能/(kJ·mol-1) | 436 | 339 | 298 |
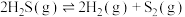 的
的
(3)一定温度下,在体积为2L的刚性容器中,充入1molCH4和2molH2S,发生反应i和反应ⅱ,5min时反应达到平衡,H2S的平衡转化率为40%,
 。
。①下列叙述中能说明反应ⅱ达到平衡状态的是
A.
 B.混合气体的密度不再变化
B.混合气体的密度不再变化C.断裂1molC—H的同时生成1molC=S D.混合气体的平均摩尔质量不再变化
②0~5min内
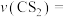
③此温度下,反应ⅱ的平衡常数Kx=
(4)在常压和不同温度下,将H2S和CH4按照2∶1的体积比充入热解器中,用N2稀释,发生反应ⅰ和反应ⅱ。反应相同时间后,H2、S2和CS2的体积分数随温度的变化关系如图所示。
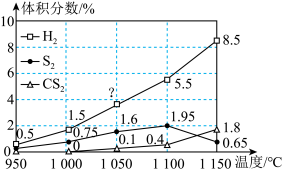

②1050℃时,H2的体积分数为
③温度高于1100℃时,
 体积分数减小的原因是
体积分数减小的原因是
您最近一年使用:0次
2024-09-16更新
|
161次组卷
|
4卷引用:山西省运城市康杰中学2024-2025学年高三上学期一模考试 化学试题