名校
1 . A,B,C,D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
| A.X、Y、Z的稳定性逐渐减弱 |
| B.自然界中存在多种由A、B、C、D四种元素组成的化合物 |
| C.Y、X、Z三种化合物的熔、沸点逐渐升高 |
| D.A,B,C,D只能形成5种单质 |
您最近一年使用:0次
名校
解题方法
2 . 下列描述中正确的是
A. 和 和 的中心原子均为 的中心原子均为 杂化 杂化 |
B. 的空间构型为平面三角形 的空间构型为平面三角形 |
C. 中有每个原子均满足最外层8电子稳定结构 中有每个原子均满足最外层8电子稳定结构 |
D. 分子的立体构型为V形 分子的立体构型为V形 |
您最近一年使用:0次
名校
3 . 在半导体生产或灭火剂的使用中,会向空气逸散气体如: 、
、 ,
,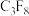 ,它们虽是微量的,有些确是强温室气体,下列推测不正确的是
,它们虽是微量的,有些确是强温室气体,下列推测不正确的是
 、
、 ,
,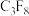 ,它们虽是微量的,有些确是强温室气体,下列推测不正确的是
,它们虽是微量的,有些确是强温室气体,下列推测不正确的是A.熔点 |
B. 分子中 分子中 原子是 原子是 杂化,分子呈三角锥形 杂化,分子呈三角锥形 |
C. 存在手性异构 存在手性异构 |
D.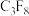 在 在 中的溶解度比水中大 中的溶解度比水中大 |
您最近一年使用:0次
名校
4 . 二氯化二硫( )是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,
)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下, 是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为
是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为 ,下列说法中错误的是
,下列说法中错误的是

 )是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,
)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下, 是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为
是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为 ,下列说法中错误的是
,下列说法中错误的是
A. 的结构式为 的结构式为 |
B.反应中 是还原产物, 是还原产物, 是氧化产物 是氧化产物 |
C. 为含有极性键和非极性键的分子 为含有极性键和非极性键的分子 |
D.在 分子中 分子中 原子采取 原子采取 杂化 杂化 |
您最近一年使用:0次
名校
5 . 下列物质中,含极性键和非极性键且分子有极性的是
| A.乙烯 | B.乙醛 | C.甲醇 | D.三氯甲烷 |
您最近一年使用:0次
名校
6 . 已知X、Y是主族元素,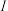 为电离能,单位是
为电离能,单位是 。请根据下表所列数据判断,错误的是
。请根据下表所列数据判断,错误的是
 为电离能,单位是
为电离能,单位是 。请根据下表所列数据判断,错误的是
。请根据下表所列数据判断,错误的是| 元素 |  |  |  |  | … |
| X | 500 | 4600 | 6900 | 9500 | … |
| Y | 580 | 1800 | 2700 | 11600 | … |
| A.若元素Y处于第三周期,它可与冷水剧烈反应 |
| B.元素Y是ⅢA族元素 |
C.元素X与氯形成化合物时,化学式可能是 |
| D.元素X为金属元素,常见化合价是+1价 |
您最近一年使用:0次
名校
7 . 1869年门捷列夫提出元素周期表,根据元素周期表和周期律,回答问题。
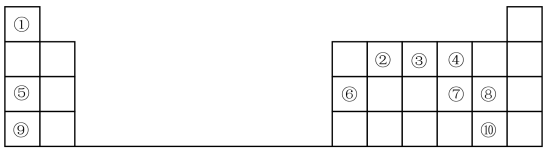
(1)元素⑦在周期表中的位置_______ 。
(2)元素①和⑤形成的化合物中化学键类型是_______ 。
(3)在①~⑧元素中,原子半径最大的是_______ (填元素名称);其某种氧化物可用于潜水艇中的供氧剂,该氧化物中阴离子与阳离子个数比为_______ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是_______ (用离子符号表示),元素⑨的最高价氧化物对应水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(5)元素的非金属性⑩_______ ⑧(填“>”或“<”);下列事实不能证明上述结论的是_______ 。
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的氢化物的还原性比元素⑩的弱
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
E.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
(6)⑤的最高价氧化物对应的水化物的电子式为_______ ,用电子式表示氯化钠的形成过程_______ 。

(1)元素⑦在周期表中的位置
(2)元素①和⑤形成的化合物中化学键类型是
(3)在①~⑧元素中,原子半径最大的是
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素的非金属性⑩
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的氢化物的还原性比元素⑩的弱
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
E.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
(6)⑤的最高价氧化物对应的水化物的电子式为
您最近一年使用:0次
名校
解题方法
8 . 为验证卤素单质氧化性的相对强弱,某学习小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:

(1)A中产生黄绿色气体,A中发生的离子方程式为______ ,该元素形成的有漂白性的含氧酸的电子式是______ 。
(2)验证氯气的氧化性强于碘单质的实验现象是______ 。
(3)过程Ⅲ实验的目的:某同学经分析认为,B中溶液由黄色变为棕红色,以此说明C中______ ,从而得出D中氧化 的氧化剂必为
的氧化剂必为 ,因此B装置是必不可少的。
,因此B装置是必不可少的。
(4)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到的现象为______ ,发生反应的离子方程式为______ 。
(5)浸有NaOH溶液的棉花的作用是______ 。
(6)新制氯水和 都有漂白性,但两者混合之后漂白性反而减弱了,请用离子方程式对其原因进行解释:
都有漂白性,但两者混合之后漂白性反而减弱了,请用离子方程式对其原因进行解释:______ 。
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
回答问题:

(1)A中产生黄绿色气体,A中发生的离子方程式为
(2)验证氯气的氧化性强于碘单质的实验现象是
(3)过程Ⅲ实验的目的:某同学经分析认为,B中溶液由黄色变为棕红色,以此说明C中
 的氧化剂必为
的氧化剂必为 ,因此B装置是必不可少的。
,因此B装置是必不可少的。(4)过程Ⅳ为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到的现象为
(5)浸有NaOH溶液的棉花的作用是
(6)新制氯水和
 都有漂白性,但两者混合之后漂白性反而减弱了,请用离子方程式对其原因进行解释:
都有漂白性,但两者混合之后漂白性反而减弱了,请用离子方程式对其原因进行解释:
您最近一年使用:0次
名校
解题方法
9 . 元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的价电子排布式为nsn-1npn+1,则下列说法不正确的是
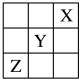
| A.Y元素原子的价电子排布式为4s24p4 |
| B.Y元素在元素周期表的第三周期VIA族 |
| C.X元素所在周期中所含非金属元素最多 |
| D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3 |
您最近一年使用:0次
2024-04-04更新
|
202次组卷
|
46卷引用:四川省邻水实验学校2020-2021学年高二下学期第一次月考化学试题
四川省邻水实验学校2020-2021学年高二下学期第一次月考化学试题四川省广安市第二中学2021-2022学年高二下学期第一次月考化学试题2014-2015福建省宁德市五校教学联合体高二下学期期中化学试卷2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷2016-2017学年四川省资阳市高二上学期期末化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:1.2 原子结构与元素的性质 第1课时黑龙江省齐齐哈尔市第八中学2018-2019学年高二下学期期中考试化学试题人教化学选修3第一章第二节课时1课时2 核外电子排布与元素周期表、原子半径——A学习区 夯实基础(鲁科版选修3)四川省越西中学2019-2020学年高二5月月考化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题河北省衡水市桃城区第十四中学2019-2020学年高二下学期摸底考试化学试题山西省太原市山西大学附属中学2019-2020学年高二下学期5月化学试题山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题宁夏大学附属中学2020-2021学年高二上学期期中考试化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题河南省驻马店市2020-2021学年高二上学期期终考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质 课时1 原子结构与元素周期表(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质鲁科版2019选择性必修2第1章 原子结构与元素性质 第2节 原子结构与元素周期表 第2课时 核外电子排布与元素周期表(已下线)1.1 原子结构(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)(已下线)第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)(已下线)1.2.2 核外电子排布与元素周期表-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)新疆乌苏市第一中学2020-2021学年高二3月月考化学(4-21班)试题黑龙江省牡丹江市海林市朝鲜族中学2020-2021学年高二下学期4月份月考化学试题贵州省凯里市第三中学2020-2021学年高二下学期第一次月考化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题(已下线)考向36 原子结构与性质-备战2022年高考化学一轮复习考点微专题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期中考试化学试题陕西省宝鸡市金台区2021-2022学年高二下学期期中考试化学试题第二节 原子结构与元素的性质 第1课时 原子结构与元素周期表吉林省长春外国语学校2021-2022学年高二下学期阶段测试化学试题四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题江苏省盐城市东台创新高级中学2021-2022学年高二2月份月检测化学试题浙江省绍兴蕺山外国语学校2021-2022学年高二下学期第一次月考化学试题天津市静海区四校2022-2023学年高二下学期3月阶段性检测化学试题四川省南充市嘉陵第一中学2022-2023学年高二下学期6月月考化学试题河北省张家口市宣化第一中学2022-2023学年高二下学期6月月考化学试题江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷安徽省蚌埠第二中学2023-2024学年高二下学期3月月考化学试题江苏省镇江市句容高级中学2023-2024学年高二下学期3月考试化学试题四川省成都市简阳实验学校2023-2024学年高二下学期3月月考化学试题名校期末好题汇编-原子结构与性质(选择题)(已下线)清单01 原子结构与性质(考点清单)(讲+练)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
解题方法
10 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1) 的离子结构示意图为
的离子结构示意图为______ 。
(2)卤素单质有着相似的化学性质,但同时也有差别。比如 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: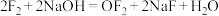 。其中
。其中 的电子式为
的电子式为______ ,用电子式描述NaF的形成过程:______ 。
(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性______ (填“大于”或“小于”)HI的稳定性,AgAt______ (填“易”或“难”)溶于水。
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。
① 与水反应的产物可能为
与水反应的产物可能为______ (填化学式)。
②下列说法不正确的是______ 。
A.HF、HCl、HBr的沸点依次升高
B. 沸点依次升高
沸点依次升高
C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D. (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(1)
 的离子结构示意图为
的离子结构示意图为(2)卤素单质有着相似的化学性质,但同时也有差别。比如
 与NaOH反应生成NaCl、NaClO和水,而
与NaOH反应生成NaCl、NaClO和水,而 与NaOH发生如下反应:
与NaOH发生如下反应: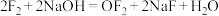 。其中
。其中 的电子式为
的电子式为(3)根据卤族元素性质的相似性和递变性,推测元素砹(At)的单质为有色固体,HAt的稳定性
(4)不同卤素原子之间以共价键相结合形成的化合物称为卤素互化物,如
 等。它们与卤素单质性质相似。
等。它们与卤素单质性质相似。①
 与水反应的产物可能为
与水反应的产物可能为②下列说法不正确的是
A.HF、HCl、HBr的沸点依次升高
B.
 沸点依次升高
沸点依次升高C.已知离子半径大小会影响离子键的强弱,从而影响物质的熔点:若离子半径越大,离子键越弱。据此推测NaF、NaCl、NaBr熔点依次降低
D.
 (X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
(X代表F、Cl、Br)的酸性随着X的原子序数递增逐渐减弱
您最近一年使用:0次
2024-04-04更新
|
201次组卷
|
2卷引用:四川省广安市华蓥中学2023-2024学年高二下学期3月月考化学试题



