名校
1 . 含4个碳原子的烃分子结构中,碳原子相互结合的几种方式如下图,下列说法不正确 的是
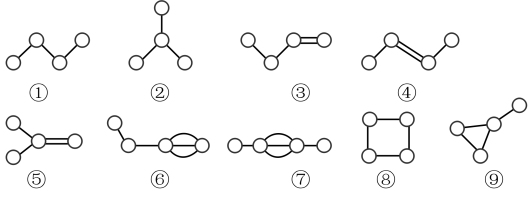
| A.①②⑧均为饱和烃 | B.③④互为同系物 | C.⑥⑦属于炔烃 | D.⑤⑨互为同分异构体 |
您最近一年使用:0次
2022-07-12更新
|
2196次组卷
|
9卷引用: 青海省西宁市2022-2023学年高一下学期期末考试化学试题
青海省西宁市2022-2023学年高一下学期期末考试化学试题北京市东城区2021-2022学年高一下学期期末考试化学试题第七章 有机化合物(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)江西省上犹中学2022-2023学年高二下学期6月期末考试化学试题广东省汕尾市华大实验学校2022-2023学年高一下学期5月月考化学试题四川省成都石室蜀都中学2022-2023学年高一下学期培优考试化学试题(已下线)第七章 有机化合物【单元测试B卷】2.2.2 炔烃 随堂练习(已下线)专题04 认识有机化合物 乙烯与有机高分子材料-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)
2 . 已知:Ksp(AgCl)=1.8×10-10 ,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI>Ag2CrO4 | B.AgCl>Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
您最近一年使用:0次
2023-08-14更新
|
1016次组卷
|
55卷引用:2015-2016学年青海师大附属二中高二下4月月考化学试卷
2015-2016学年青海师大附属二中高二下4月月考化学试卷2010年普通高等学校招生全国统一考试化学试题(海南卷)2010年高考化学试题分项专题十 电解质溶液(已下线)2010年北京五中高二下学期期末考试化学试题(已下线)2010—2011学年山西省大同一中高二上学期期末考试化学试卷(已下线)2011-2012学年湖北省襄阳市四校高二上学期期中考试化学试卷(已下线)2011-2012学年江西省九江一中高二上学期第二次月考化学试卷(已下线)2011-2012学年江苏省南京三中高二下学期期末考试化学选修试卷(已下线)2011-2012学年河北省元氏一中高二上学期期中考试化学试卷(已下线)2012-2013学年山东省济宁市泗水一中高二12月质量检测化学试卷(已下线)2012-2013学年福建省南安一中高二上学期期末考试化学试卷(已下线)2013-2014学年湖北省恩施高中高二12月月考化学试卷2014-2015湖南省怀化市中小学课改高二上学期期末化学试卷2014-2015河北省隆化县存瑞中学高二下学期期中考试化学试卷2015-2016学年湖南省衡阳县高二上学期期末统考化学试卷2015-2016学年湖北省武汉三十九中高二上学期期末化学试卷2015-2016学年福建师大附中高二下期中化学试卷2017届湖北省枣阳市高级中学高三上学期8月月考化学试卷2017届内蒙古赤峰二中高三上第二次月考化学试卷广西陆川县中学2017-2018学年高二上学期期中考试化学试题河北省衡水市安平中学2017-2018学年高二上学期期中考试化学试题高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡内蒙古包头市第四中学2017-2018学年高二上学期期末考试化学试题(已下线)2018年11月15日 《每日一题》人教选修4-溶度积的应用【全国百强校】贵州省铜仁市第一中学2018-2019学年高二下学期开学考试化学试题步步为赢 高二化学暑假作业:作业十 水溶液中的离子平衡陕西省吴起高级中学2019-2020学年高二上学期期中考试化学(基础卷)试题(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算黑龙江省哈尔滨市第三中学2019-2020学年高二上学期期中考试化学(理)试题陕西省咸阳市西藏民族大学附属中学2019-2020学年高二上学期第二次月考化学试题2019年秋高三化学复习强化练习—— 与浓度积的相关计算(强化练)湖南省雅礼中学2019-2020学年高二上学期第一次月考化学试题吉林省通化市梅河口市博文学校2019-2020学年高二上学期第二次月考化学试题(已下线)山东省邹城市2018-2019学年高二上学期12月月考化学试卷湖北省恩施州清江外国语学校2020-2021学年高二上学期10月月考化学试题河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡湖南省长郡中学2020-2021学年高二上学期期中考试化学试题(已下线)练习14 难溶电解质的沉淀溶解平衡-2020-2021学年【补习教材·寒假作业】高二化学(苏教版)贵州省蟠龙高级中学2020-2021学年高二上学期第二次月考化学试题黑龙江省大庆中学2021-2022学年高二上学期期末考试化学试题(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)河南省新乡市第一中学2022-2023学年高二上学期第一次月考化学试题湖南省长沙市宁乡市四校联考2022-2023学年高二上学期11月月考化学试题湖北省罗田县第一中学2021-2022学年高二上学期12月月考化学试题山西省太原市英才学校2021-2022学年高二上学期第二次月考化学试题山东省潍坊第一中学2022-2023学年高二上学期期末考试化学试题(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)第1课时 沉淀溶解平衡与溶度积作业(二十一) 沉淀溶解平衡与溶度积天津市第一中学2023-2024学年高二上学期期末考试化学试卷山东师大附中幸福柳分校2023-2024学年高二上学期12月份化学学科阶段性测试(已下线)湖南省郴州市临武县第一中学2023-2024学年高三下学期5月期中化学试题
3 . 某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是________ 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______ 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____ (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______ (填离子符号),由此可以证明该氧化还原反应为______ 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______ ;生成沉淀的原因是______ (用平衡移动原理解释)。
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁屑,其目的是
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2019-01-30更新
|
5626次组卷
|
40卷引用:青海省西宁二十一中2018届高三上学期12月月考化学试卷
青海省西宁二十一中2018届高三上学期12月月考化学试卷2016年全国普通高等学校招生统一考试化学(新课标2卷精编版)2017届湖北省应城一中高三上学期调研测试化学试卷2017届四川省双流中学高三上学期10月月考化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届海南省海南中学高三上学期月考三化学试卷2016-2017学年广东省清远三中高二上第二次月考化学卷2017届四川省泸州市泸化中学高三上10月月考化学卷2016-2017学年北京五十六中九高三上学期期中考试化学试卷天津市南开区2017届高三高考二模化学试卷黑龙江省大庆实验中学2018届高三上学期第一次月考理科综合化学试题内蒙古巴彦淖尔市第一中学2018届高三上学期期中考试理科综合化学试题甘肃省会宁县第一中学2018届高三上学期第三次月考理科综合化学试题黑龙江省哈尔滨市第九中学2017-2018学年高一上学期期末考试化学试题(已下线)解密05 金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题【校级联考】福建省龙岩市非一级达标校2018-2019学年高二上学期期末教学质量检查化学试题2016年全国普通高等学校招生统一考试化学(全国2卷参考版)内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测广东省韶关市2019-2020学年高二下学期期末考试化学试题(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测黑龙江省牡丹江市第一高级中学2021届高三上学期开学考试化学试题(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精练)——2021年高考化学一轮复习讲练测(已下线)专题讲座(九) 热点实验综合探究 (精练)-2021年高考化学一轮复习讲练测(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)四川省邻水实验学校2022届高三上学期入学考试理综化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)第三章 金属及其化合物 第13讲 铁及其重要化合物(已下线)题型31 Fe2+、Fe3+的检验与性质探究(已下线)第一部分 化学综合实验 热点6 物质性质探究实验
真题
名校
4 . 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
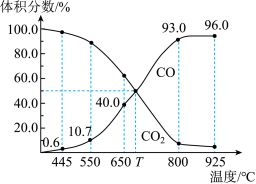
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
| A.550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动 |
| B.650℃时,反应达平衡后CO2的转化率为25.0% |
| C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 |
| D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总 |
您最近一年使用:0次
2019-01-30更新
|
6507次组卷
|
84卷引用:青海省湟川中学2020-2021学年高二上学期期中考试化学试题
青海省湟川中学2020-2021学年高二上学期期中考试化学试题2015年全国普通高等学校招生统一考试化学(四川卷)2016届河南省扶沟县高级中学高三上学期开学考试化学试卷2015-2016学年河南洛阳高级中学高二上9月月考化学试卷2016届江西省临川区第二中学高三上学期期中测试化学试卷2016届浙江省舟山中学高三上学期期中考试化学试卷2015-2016学年江西省丰城中学高二上学期期中考试化学试卷2016届河北省衡水市冀州中学高三上一轮复习检测二化学试卷2016届河南省洛阳市孟津一中高三上学期期末化学试卷2016届江苏省清江中学高三下冲刺模拟二化学试卷2015-2016学年福建省厦门一中高二下期中化学试卷浙江省宁波市效实中学2015-2016学年高一下期中化学卷2015-2016学年广西桂林十八学高二下期中化学试卷2015-2016学年辽宁沈阳二中高一6月月考化学试卷2015-2016学年河北省定州中学高二下期末化学试卷12015-2016学年河北省定州中学高二下期末化学试卷22016-2017学年山西省怀仁一中高二上第一次月考化学试卷2016-2017学年河北省冀州中学高二上期中化学卷广西桂林市第十八中学2016-2017学年高二下学期期中考试化学试题(已下线)2.3.3 化学平衡常数高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第三课时(化学平衡常数)陕西省西安市长安区第一中学2018届高三上学期第五次质量检测化学试题2018-2019学年鲁科版高中化学选修四:模块综合检测题(一)【全国校级联考】江西省红色七校2019届高三第一次联考化学试题【全国百强校】黑龙江省鹤岗市第一中学2018-2019学年高二上学期第一次月考(10月)化学试题【全国百强校】云南省玉溪市第一中学2018-2019学年高二上学期第二次月考化学试题【全国百强校】湖北省随州市第一中学2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题9 化学反应速率与化学平衡(教学案)【全国百强校】江西省九江第一中学2018-2019学年高二上学期期末考试化学试题吉林省白城市第一中学2018-2019学年高一6月月考化学试题江西省赣州市南康中学2019-2020学年高二上学期第一次月考化学试题河北省石家庄二中雄安校区-河北安新中学2019-2020学年高二上学期期中考试化学试题山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试化学试题山东省实验中学2019-2020学年高二上学期期中考试化学试题(已下线)专题7.3 化学平衡常数 化学反应进行的方向(讲)-《2020年高考一轮复习讲练测》辽宁师范大学附中2019-2020学年高二10月月考化学试题江西省赣州市寻乌中学2019-2020学年高二上学期第二次段考化学试题重庆市朝阳中学2019-2020学年高一12月月考化学试题湖北省利川市第五中学2019-2020学年高二12月月考化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 转化率与产率的相关计算(提升练)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡移动及其影响因素(强化练习)【懂做原理题】2020届高三化学选修4二轮专题练—— 浓度商及其应用【精编23题】浙江省宁波市效实中学2020届高三上学期复习阶段性测试化学试题(已下线)专题十一 化学反应速率和化学平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)考点09 化学平衡及反应方向-2020年高考化学命题预测与模拟试题分类精编广西桂林市第十八中学2019-2020学年高二下学期开学考试化学试题河北省石家庄市第二中学2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分(已下线)【南昌新东方】江西省九江市第一中学2018-2019学年高二上学期期末考试化学试题湖南省长沙市雅礼中学2020届高三上学期第3次月考化学试题湖南省株洲市茶陵县第一中学2020-2021学年高二年上学期入学考试化学试题山东省潍坊市临朐县实验中学2020-2021学年高二9月月考化学试题鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度山东省临沂市沂水一中2020-2021学年高二9月月考化学试题人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡四川省简阳市阳安中学2020-2021学年高二上学期9月月考化学试题安徽省宣城二中2020-2021学年高二上学期第一次月考化学试题河南省洛阳市第三中学东城校区2020-2021学年高二9月月考化学试题(已下线)第24讲 化学平衡常数及转化率的计算 (精讲)——2021年高考化学一轮复习讲练测河南省洛阳市新安县第一高级中学2020-2021学年高二10月月考化学试题安徽省黄山市屯溪第一中学2020-2021学年高二上学期期中考试化学试题山西省怀仁市2020-2021学年高二上学期期中化学试题湖北省鄂州市部分高中联考协作体2020-2021学年高二上学期期中考试化学试题吉林省长春市实验中学2021届高三上学期期中考试化学试题(已下线)【浙江新东方】96(已下线)【浙江新东方】104广东省深圳实验学校2020-2021学年高二上学期第二阶段考试化学试题江西省南康中学2020-2021学年高二上学期第四次大考化学试题山东济南章丘第四中学2021届高三上学期第一次阶段性检测化学试题(已下线)专题10 化学平衡(速率、影响因素、图像、标志、平衡压强及常数)-2021年高考化学必做热点专题(已下线)2.2.2 影响化学平衡的因素-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第20讲 化学平衡常数及转化率的计算(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)河北正定中学2020-2021学年高二上学期开学考试化学试题广东省梅州市梅江区梅州中学2021-2022学年高二上学期阶段性考试化学试题辽宁省大连市第一中学2021-2022学年高二上学期阶段性学情反馈(二)化学试题第二节 化学平衡 第2课时 化学平衡常数江西省宜春市万载中学2021-2022学年高一上学期第二次月考化学试题(已下线)第20讲 化学平衡常数及转化率的计算(练)-2023年高考化学一轮复习讲练测(新教材新高考)河北省邯郸市大名县第一中学2022-2023学年高二上学期第一次月考化学试题广东省广州大学附属中学2022-2023学年高二上学期期中考试化学试题山东省德州市德州耀华学校2021-2022学年高二上学期第三次质量调研12月考化学试题河南省鹤壁市第一中学2022-2023学年高二上学期期末检测化学试题广东省大埔县虎山中学等五校2022-2023学年高二上学期(11月)期中考试化学试题辽宁省大连市第八中学2022-2023学年高二上学期12月月考化学试题
真题
名校
5 . 测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比试验,④产生白色沉淀多。下列说法错误的是( )
| 时刻 | ① | ② | ③ | ④ |
| 温度/℃ | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
A.Na2SO3溶液中存在水解平衡:SO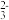 +H2O +H2O  HSO HSO +OH- +OH- |
B.④的pH与①不同,是由于SO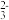 浓度减小造成的 浓度减小造成的 |
| C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致 |
| D.①与④的Kw值相等 |
您最近一年使用:0次
2018-06-09更新
|
8603次组卷
|
60卷引用:青海省湟川中学2019-2020学年高二上学期期中考试化学试题
青海省湟川中学2019-2020学年高二上学期期中考试化学试题2018年全国普通高等学校招生统一考试化学(北京卷)辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题(已下线)2018届高三高考题及模拟题汇编 专题10 水溶液中的离子平衡(已下线)2019年高考总复习巅峰冲刺-专题07 电解质溶液应试策略浙江省嘉兴市第一中学2020届高三上学期期中考试化学试题(已下线)专题8.3 盐类水解(讲)-《2020年高考一轮复习讲练测》(已下线)专题8.3 盐类水解(练)-《2020年高考一轮复习讲练测》(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》步步为赢 高二化学寒假作业:综合检测(二)江西省赣州市石城中学2020届高三上学期第二次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 化学平衡移动及其影响因素(强化练习)夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——水的离子积常数的应用(强化练习)湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题7 盐类水解的基础知识复习题上海市南洋模范中学2019-2020学年高三上学期期中考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题03-2020年北京新高考化学模拟试题(已下线)专题十二 水溶液中的离子平衡(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训陕西省榆林市绥德县绥德中学2020届高三下学期第五次模拟考试化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第2节 弱电解质的电离盐类的水解(已下线)3.3.2+影响盐类水解的主要因素和盐类水解的应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)3.2.2+pH的计算及其应用-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)福建省福州第三中学2019-2020学年高二上学期期末考试化学试题(已下线)【全国百强校】广西桂林市第十八中学2018-2019学年高二下学期期中段考化学试题鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过高考 3年真题强化闯关北京清华大学附属中学朝阳分校2020-2021学年高二上学期期中考试化学试题(已下线)第27讲 盐类水解(精讲)——2021年高考化学一轮复习讲练测广东省广州市广大附中、广外2020-2021学年高二上学期期中考试化学试题(已下线)3.3.2 影响盐类水解的主要因素和盐类水解的应用(基础练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)小题必刷32 盐类的水解影响因素及应用——2021年高考化学一轮复习小题必刷(通用版本)上海市七宝中学2021届高三上学期期中考试化学试题浙江省金华市金华十校2020-2021学年高二上学期调研考试化学试题四川省成都市第七中学2021届高三下学期3月二诊模拟考试理综化学试题(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点24 水的电离和溶液的酸碱性-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)课时42 盐类的水解影响因素及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第23讲 盐类水解(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)安徽师范大学附属中学2021-2022学年高二上学期期中考查化学试题(已下线)3.3.2 影响盐类水解的主要因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(实验班)化学试题河南省郑州市第四高级中学2021-2022学年高二下学期第一次调研考试化学试题云南省曲靖市宣威市第七中学2021-2022学年高三下学期3月考试化学试题河南省顶级名校2022届高三下学期阶段性联考三理科综合化学试题(已下线)考点27 水的电离和溶液的pH-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第23讲 盐类水解 (练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题八 水溶液中的离子反应与平衡 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)北京市北京师范大学附属中学2022-2023学年高二上学期期中考试化学试题(已下线)专题06 水溶液中的离子平衡(练)-2023年高考化学二轮复习讲练测(新高考专用)山东省滨州高新高级中学2022-2023学年高二上学期期中考试化学试题(已下线)专题十三水溶液中的离子平衡(已下线)第一部分 二轮专题突破 专题14 溶液中的三大平衡及应用安徽省宣城市2022-2023学年高二上学期期末调研考试化学试题(已下线)题型136 盐类水解平衡及影响因素(已下线)专题卷12 强弱电解质分析比较-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)第3课时 盐类水解平衡的移动及其应用北京首都师范大学附属中学2023-2024学年高二上学期10月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期10月月考化学试题四川省射洪中学校2022-2023学年高二下学期3月月考化学试题北京市第十三中学2023-2024学年高二上学期期中考试化学试题新疆石河子第一中学2023-2024学年高二上学期11月月考化学试题四川省泸州市叙永第一中学校2023-2024学年高二上学期1月期末化学试题
6 . 已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1
H-H、O=O和O-H的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
2C(s)+O2(g)=2CO(g) ΔH=-220 kJ·mol-1
H-H、O=O和O-H的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
| A.-332 | B.-118 | C.+350 | D.+130 |
您最近一年使用:0次
2022-10-12更新
|
2104次组卷
|
132卷引用:青海省西宁市北外附属新华联国际学校2021-2022学年高二上学期第一次月考化学(理)试题
青海省西宁市北外附属新华联国际学校2021-2022学年高二上学期第一次月考化学(理)试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷)(已下线)2015届河南省实验中学高二上学期期中考试化学试卷(已下线)2014秋河北省唐山一中高二上学期期中化学试卷2015届河北省衡水冀州中学高三12月月考化学试卷2015届福建省养正中学高三上学期第二次月考化学试卷2014-2015辽宁省沈阳二中高一下学期4月月考化学试卷2014-2015学年河北省正定中学高二下第三次月考化学试卷2016届西藏日喀则地区一中高三10月月考理综化学试卷2015-2016学年河南洛阳高级中学高二上9月月考化学试卷2015-2016学年湖南常德市第一中学高二12月月考化学卷2015-2016学年广西钦州市钦南区高二上学期期中测试化学试卷2015-2016学年湖北荆州中学高二上期中测试化学试卷2015-2016学年浙江省湖州中学高二上学期期中化学试卷2015-2016学年湖北省宜昌金东方高级中学高二上学期期末化学试卷2016-2017学年河北冀州市中学高二上开学调研化学卷2016-2017学年河南郑州外国语学校高二上开学考试化学2016-2017学年陕西省西安中学高二上10月月考化学试卷2016-2017学年山东省枣庄二中高二第二次月考化学试卷2016-2017学年广东省湛江一中高二上第一次大考化学卷2016-2017学年河南省漯河中学高二上第一次月考化学卷2016-2017学年安徽师大附中高二上10月月考化学卷2016-2017学年安徽省宣城市郎溪中学等四校高二上期中化学卷2016-2017学年四川省达州市年高二上学期期末检测化学试卷重庆市第十八中学2016-2017学年高一下学期期中考试化学试题天津市南开区2017届高三基础训练化学试题2018版化学(苏教版)高考总复习专题六课时跟踪训练--化学反应的热效应河南省林州市第一中学2017-2018学年高二上学期开学考试化学试题河北省大名县第一中学2017-2018学年高二上学期第一次月考化学试题河北省邯郸市成安县第一中学2017-2018学年高二9月月考化学试题甘肃省兰州第一中学2017-2018学年高二上学期第一次月考(9月)化学试题安徽省铜陵市第一中学2017-2018学年高二10月月考化学试题黑龙江省饶河县高级中学2017-2018学年高二上学期第一次月考化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题A内蒙古巴彦淖尔市第一中学2017-2018学年高二9月月考化学试题B浙江省温州中学2017-2018学年高二上学期期中考试化学试题河北省衡水市安平中学2018届高三上学期期中考试化学试题安徽省淮北市第一中学2017--2018学年度第一学期期中考试高二年级化学试题宁夏长庆高级中学2018届高三第四次月考理综化学试卷(已下线)黄金30题系列 高二化学(选修4) 小题好拿分【提升版】湖北省监利县实验高中2017-2018学年高二上学期期中考试化学试题山西省大同市第一中学2017-2018学年高二上学期期末考试化学试题福建省厦门双十中学2017-2018学年高二下学期期中考试化学试题【全国校级联考】内蒙古赤峰市重点高中(赤峰二中,平煤高级中学等)2017-2018学年高二下学期期末联考(A)化学试题辽宁省实验中学2017-2018学年高一下学期期中考试理科化学试题甘肃省岷县二中2018-2019学年高二上学期第一次月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期10月月考化学试题【市级联考】内蒙古鄂尔多斯市2019届高三上学期期中考试化学试题【全国百强校】湖北省武汉市华中师范大学第一附属中学2018-2019学年高二上学期期中检测化学试题河北省衡水市安平县安平中学2019届高三上学期期中考试化学试题河北省唐山市玉田县2018-2019学年高二上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)新疆维吾尔自治区昌吉市第九中学2018-2019学年高二上学期期末考试化学试题浙江省东阳中学2018-2019学年高一下学期期中考试化学试题甘肃省天水市第一中学2017-2018学年高二暑假作业检测考试化学试题安徽省怀宁中学2019-2020学年高二上学期开学考试化学试题甘肃省兰州市第一中学2019-2020学年高二9月月考化学试题河北省唐山一中2019-2020学年高二上学期10月月考化学试题安徽省青阳县第一中学2019-2020学年高二10月月考化学试题宁夏吴忠中学2019-2020学年高二上学期期中考试化学试题湖南省益阳市第六中学2019-2020学年高二上学期期中考试化学试题四川省绵阳市南山中学实验学校2019-2020学年高二12月月考化学试题四川省蓬溪县蓬南中学2019-2020学年高二上学期第四次月考化学试题宁夏海原县第一中学2019-2020学年高二上学期期末考试化学试题江西省南昌市八一中学、洪都中学等六校2019-2020学年高二上学期期末联考化学试题广东省深圳实验学校2019-2020学年高二上学期期末考试化学试题云南省楚雄市实验中学2018—2019学年高二上学期11月月考化学试题甘肃省酒泉市敦煌中学2020届高三上学期第二次调研考试化学试题【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】广西壮族自治区贺州市桂梧高中2019-2020学年高二上学期第一次月考化学试题河南省平顶山市鲁山县第一高级中学2019-2020高一下学期5月考试化学试题广东省湛江市第二十一中学2019-2020学年高二上学期期中考试化学试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题广东省广州大学附属中学2019-2020学年高一下学期期末考试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1吉林省长春实验中学2019-2020学年高一6月月考化学试题江苏省启东中学2020-2021学年高二上学期期初考试化学试题(已下线)1.3.2 反应热的计算(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)广东省广州大学附属中学等三校2019~2020学年高一下学期期末联考化学试题江苏省泰州中学2020-2021学年高二上学期期初检测化学试题(已下线)第01章 化学反应的热效应(B卷能力提高篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)(已下线)第一章 化学反应的热效应(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)(已下线)第01章 化学反应与能量转化(B卷能力提升篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材鲁科版)江苏省徐州市2020-2021学年高二上学期期初检测化学试题黑龙江省双鸭山市第一中学2021届高三上学期第一次月考化学试题河北省邢台市第七中学2019-2020学年高二上学期10月月考化学试题安徽省安庆市宜秀区白泽湖中学2020-2021学年高二上学期第一次月考化学试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题辽宁省盘锦市第二高级中学2020-2021学年高二上学期第一次阶段性考试化学试题山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题宁夏回族自治区海原县第一中学2020-2021学年高二上学期第一次月考化学试题福建省福清西山学校高中部2020-2021学年高二上学期期中考试化学试题内蒙古自治区通辽市科左后旗甘旗卡第二高级中学2020-2021学年高二上学期期中考试化学试题山东省德州市第一中学2020-2021学年高二上学期期中检测化学试题黑龙江省哈尔滨市南岗区哈尔滨师范大学附属中学2021届高三上学期期中考试化学试题宁夏银川一中2020-2021学年高二上学期期末考试化学试题黑龙江省龙东南六校2020-2021学年高二上学期期末联考化学试题黑龙江省七台河市勃利县高级中学2020-2021学年高二3月月考化学试题(已下线)【镇江新东方】高二上第二次月考黑龙江省大庆市铁人中学2020-2021学年高一下学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2020-2021学年高一下学期期末考试化学(理)试题新疆乌鲁木齐市第八中学2018-2019学年高二上学期期中考试化学试题(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)甘肃省民勤县第一中学2021-2022学年高二上学期第一次月考化学试题安徽省合肥市第六中学2021-2022学年高二上学期月考化学试题甘肃省庆阳市第六中学2021-2022学年高二上学期第一次月考化学(理)试题黑龙江省海林市朝鲜族中学2020届高三上学期第二次月考化学试题山西省乡宁县第一中学2021-2022高二上学期第一次月考化学试题浙江省绍兴市诸暨中学2021-2022学年高一上学期期中考试(实验班)化学试题新疆昌吉州2021-2022学年高二上学期期末考试化学试题江西省新余市2021-2022学年高二上学期期末检测化学试题安徽省亳州市第一中学2021-2022学年高二上学期第二次月考化学试题浙江省宁波市九校2021-2022学年高一下学期6月联考化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题新疆石河子第二中学2021-2022学年高二上学期第二次月考化学试题山东省济南市莱芜第四中学2021-2022学年高二上学期第一次质量检测化学试题 黑龙江省密山市牡丹江管理局高级中学2021-2022学年高二上学期期末考试化学试题北京市顺义区第一中学2022-2023学年高二上学期10月月考化学试题湖北省黄州中学2022--2023学年高二上学期10月月考化学试题湖北省武汉市东湖中学2022-2023学年高二上学期期中考试化学试题湖北省黄冈市麻城第二中学2021-2022学年高一下学期4月月考化学试题浙江省浙江大学附属中学(玉泉校区)2022-2023学年高二上学期期中考试 高二化学试卷(已下线)【2022】【高二化学】【期中考】-180(已下线)【知识图鉴】单元讲练测选择性必修1第1单元03巩固练安徽省安庆二中2022-2023学年高一下学期5月月考化学试题第二节 反应热的计算河北省新乐市第一中学2022-2023学年高二上学期11月期中考试化学试题山东省鄄城县第一中学2022-2023学年高一下学期3月月考化学试题江西省永修县第一中学2023-2024学年高二上学期10月月考化学试题陕西省渭南市瑞泉中学2023-2024学年高二上学期第一次质量检测化学试题江苏省无锡市市北高级中学2023-2024学年高二下学期6月月考化学试题
7 . 如图所示,在A处通入未经干燥的氯气。当关闭B处的弹簧夹时,C处的红布条看不到明显的现象;当打开B处的弹簧夹后,C处的红布条逐渐褪色,则D瓶中盛放的溶液可能是
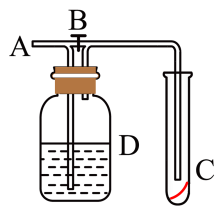
①饱和NaCl溶液 ②NaOH溶液 ③H2O ④浓硫酸

①饱和NaCl溶液 ②NaOH溶液 ③H2O ④浓硫酸
| A.①② | B.①③ | C.②④ | D.③④ |
您最近一年使用:0次
2022-12-19更新
|
2071次组卷
|
56卷引用:青海省西宁市大通县2023-2024学年高一上学期期末考试化学试题
青海省西宁市大通县2023-2024学年高一上学期期末考试化学试题2016届福建省大田市第一中学高三上学期第一次月考化学试卷2016届福建省福州格致中学高三上学期半期考试化学试卷(已下线)4.2.1 氯气高中化学人教版 必修1 第四章 非金属及其化合物 2.富集在海水中的元素——氯 活泼的黄绿色气体——氯气湖北省长阳县第一高级中学2017-2018学年高一上学期期末考试化学试题(已下线)2018年11月20日 《每日一题》人教必修1-氯气的性质山东省济宁市实验中学2019-2020学年高一上学期期中考试化学试题河北省承德第一中学2019-2020学年高一上学期期中考试化学试题(已下线)【新东方】2019新中心五地005高中化学云南省施甸县第三中学2019-2020学年高一12月月考化学试题夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——氯及其化合物 (强化练)天津市西青区2019-2020学年高一上学期期末考试化学试题(已下线)第二节 氯及其化合物(一)-2020-2021学年高一化学必修第一册课时同步练(新人教)高一必修第一册(苏教2019版)高效手册 专题3 从海水中获得的化学物质福建省厦门第一中学2020-2021学年高一上学期10月月考化学试题辽宁省辽南协作体2020-2021学年高一上学期期中考试化学试题山东省邹城第一中学2020-2021学年高一上学期期中质量检测化学试题安徽省利辛县阚疃金石中学2020-2021学年高二上学期期中考试化学试题湖南省湘潭市第一中学2020-2021学年高一上学期期中考试化学试题湖南省长沙市周南中学2020-2021学年高一上学期期末考试化学试题云南省文山州砚山县第三高级中学2020-2021学年高一上学期期中考试化学试题河北省石家庄精英中学2020-2021学年高二下学期期末考试化学试题黑龙江省双鸭山市第一中学2020-2021学年高一第二次月考化学试题安徽省宿州市砀山中学2021-2022学年高一上学期第一次质量检测化学试题福建省厦门同安一中2021-2022学年高一上学期(10月)第一次月考化学试题人教2019版必修第一册第二章第二节 氯及其化合物课后习题安徽省马鞍山第二中学2021-2022学年高一上学期期中考试化学试题 新疆吐鲁番市2021-2022学年高一上学期期末考试化学试题湖南省长郡中学2021-2022学年高一上学期期末考试化学试题广东省广州市华南师范大学附属中学2021-2022学年高一上学期期末考试化学试题黑龙江省密山市第四中学2021-2022学年高一上学期期中考试化学试题北京市第三中学2022-2023学年高一上学期期中考试化学试题辽宁省重点高中沈阳市郊联体2022-2023学年高一上学期期中考试化学试题辽宁省沈阳市辽中区第二高级中学2022-2023学年高一上学期期中考试化学试题广西桂林市第十九中学2021-2022学年高一上学期期中质量检测化学试题天津市和平区2022-2023学年高一上学期期末考试化学试题广东省广州市第九十七中学2022-2023学年高一上学期期末考试化学试题【2022】【高一上】【杭师大附中】【期中考】【高中化学】【徐外兰收集】内蒙古呼和浩特市2022-2023学年高一下学期3月质量监测化学试题(已下线)广东省广州市第一中学2022-2023学年高一上学期期中考试化学试题北京市顺义一中2023届高三下学期保温练习模拟考试化学试题广东省惠州市龙门县高级中学2021-2022学年高一下学期开学测试化学试题(已下线)专题突破卷04?非金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考)【精品卷】2.2.1 氯气的性质课堂例题-人教版2023-2024学年必修第一册江苏省兴化中学、泗洪中学2023-2024学年高一上学期10月学情调研(强基班)化学试题浙江省台州八校联盟2023-2024学年高一上学期期中联考化学试题广东实验中学越秀学校2023-2024学年高一上学期11月期中考试化学试题河北省石家庄市第二中学西校区2023-2024学年高一上学期12月月考化学试题河南省新乡市原阳县第一高级中学2023-2024学年高一上学期12月月考化学试题江苏省无锡市第一中学2023-2024学年高一上学期艺术班期末化学试题云南省宣威市第六中学2023-2024学年高一上学期12月月考化学试题安徽省合肥市六校联盟2023-2024学年高一上学期1月期末化学试题广东省江门市广雅中学2023-2024学年高一上学期12月月考化学试题B卷湖南省长沙市雅礼中学2023-2024学年高一下学期入学考试化学试卷 河南省商丘市柘城县德盛高级中学2023-2024学年高一上学期11月月考化学试题
名校
解题方法
8 . 在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,则此反应可表示为
| A.2A+3B⇌2C | B.A+3B⇌2C | C.3A+B⇌2C | D.A+B⇌C |
您最近一年使用:0次
2023-02-16更新
|
1032次组卷
|
55卷引用:青海省西宁北外附属新华联外国语高级中学2023-2024学年高二上学期期中考试化学试题
青海省西宁北外附属新华联外国语高级中学2023-2024学年高二上学期期中考试化学试题四川省阆中东风中学校2020-2021学年高二上学期第三学月调研监测化学试题安徽省桐城中学2020-2021学年高一上学期12月月考化学试题陕西省宝鸡市渭滨中学2020-2021学年度高二上学期期中考试化学试题北京市石景山区2020-2021学年高二上学期期末调研化学试题河北省张家口市宣化一中2020-2021学年高一下学期期初考试化学试题甘肃省民勤县第四中学2020-2021学年高二下学期开学考试化学试题辽宁省大连市普兰店区第一中学2020-2021学年高二上学期第二阶段考试化学试题四川省达州市2020-2021学年高一下学期期末检测化学试题广西桂林市2020-2021学年高二下学期期末质量检测化学试题贵州省铜仁第一中学2019-2020学年高一下学期期末考试化学试题(已下线)2.1 化学反应速率-2021-2022学年高二化学课后培优练(人教版选修4)北京市昌平区新学道临川学校2021-2022学年高二上学期第一次月考化学试题甘肃省民勤县第一中学2021-2022学年高二上学期第一次月考化学试题吉林省通化县综合高级中学2021-2022学年高二上学期期中考试化学试题安徽省宣城市六校2021-2022学年高二上学期期中联考化学试题(已下线)必考点02 化学反应速率-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版)人教2019版选择性必修一第二章 第一节 化学反应速率 课后习题黑龙江省牡丹江市第三中学2021-2022学年高二上学期期中考试化学(理)试题甘肃省庆阳市第六中学2021-2022学年高二上学期期中考试化学(理)试题辽宁省大连市2021-2022学年高二上学期期末联考化学试题 河南省洛阳市2021-2022学年高二上学期期末考试化学试题 吉林省长春市第六中学2021-2022学年高二上学期第三学程考试(理)化学试题(已下线)6.2.1 化学反应的速率-2021-2022学年高一化学课后培优练(人教版2019必修第二册)四川省达州市2021-2022学年高二下学期期末监测化学试题(已下线)2.1.1 化学反应速率-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)河北省石家庄市第二十三中学2021-2022学年高一下学期期末考试化学试题上海市黄浦区联合体2021-2022学年高二下学期联合体期末模拟考试化学试题内蒙古包头市第四中学2020-2021学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题河南省郑州励德双语学校2021-2022学年高一下学期期中考试化学试题黑龙江省大庆市第二中学2022-2023学年高二上学期第一次月考化学试题河北省石家庄市第十八中学2022-2023学年高二上学期10月月考化学试题吉林省吉林市2022-2023学年高二上学期期中调研测试化学试题黑龙江省牡丹江市第二中学2022-2023学年高二上学期期中考试化学试题陕西宝鸡市眉县槐芽中学2022-2023学年高二上学期期中考试化学试题安徽省亳州市涡阳县第二中学2022-2023学年高二上学期教学检测化学试题北京市西城职业学校2021-2021学年高二上学期期中测试化学试题云南昆明市昆明行知中学2021-2022学年高二上学期期中考试化学试题(已下线)6.2.1 化学反应速率及影响因素——同步学习必备知识四川省广元中学2022-2023学年高二上学期期中考试化学试题宁夏回族自治区银川一中2022-2023学年高二上学期期末考试化学试题陕西省西安市鄠邑区2022-2023学年高二上学期期末质量检测化学(理)试题安徽省黄山市2022-2023学年高二上学期期末考试化学试题湖北省黄冈市2022-2023学年高二上学期11月期中考试化学试题安徽省芜湖市无为襄安中学2022-2023学年高二上学期11月期中考试化学试题广东省湛江市第二十一中学2023-2024学年高二10月月考化学试题新疆喀什地区巴楚县2023-2024学年高二上学期10月期中考试化学试题云南省大理白族自治州民族中学2023-2024学年高二上学期10月月考化学试题湖南省张家界市民族中学2023-2024学年高二上学期第二次月考化学试题内蒙古呼和浩特市第一中学2023-2024学年高二上学期期中考试化学试题陕西省西安市 周至县第四中学2023-2024学年高二上学期10月份月考化学试题 北京市第一六六中学2023-2024学年高二上学期期中考试化学试卷黑龙江省哈尔滨师范大学青冈实验中学2023-2024学年高二上学期期中考试化学试题内蒙古呼和浩特市回民区2023-2024学年高二上学期期中考试化学试题
名校
9 . 氮的化合物种类繁多,性质也各不相同。请回答下列问题:
(1)已知:
①SO3(g)+NO(g)=NO2(g)+SO2(g) ∆H1=+41.8kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) ∆H2=-196.6kJ·mol-1
则2NO2(g)=2NO(g)+O2(g)的∆H=_______ 。
(2)NO作为主要空气污染物,其主要来源是汽车尾气,研究人员用活性炭对汽车尾气中的NO进行吸附,并发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ∆H<0.在恒压密闭容器中加入足量活性炭和一定量NO气体,反应相同时间时,测得NO的转化率α(NO)随温度的变化如图所示:
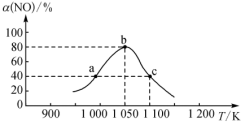
图中a、b、c三点中,达到平衡的点是_______ ;温度为1100K时,N2的平衡体积分数为_______ 。
(3)现代技术用氨气将汽车尾气中的NOx还原为N2和H2O,反应原理是NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g) ∆H<0。
3H2O(g)+2N2(g) ∆H<0。
①实际生产中NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g)的反应温度不宜过高的原因是
3H2O(g)+2N2(g)的反应温度不宜过高的原因是_______ 。
②500℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,8min时反应达到平衡,此时NH3的转化率为40%,体系压强为p0MPa,则0~8min内用N2表示的平均反应速率v(N2)=_______ mol·L-1·min-1,500℃时该反应的平衡常数Kp=_______ MPa(用含p0的代数式表示,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
(1)已知:
①SO3(g)+NO(g)=NO2(g)+SO2(g) ∆H1=+41.8kJ·mol-1
②2SO2(g)+O2(g)=2SO3(g) ∆H2=-196.6kJ·mol-1
则2NO2(g)=2NO(g)+O2(g)的∆H=
(2)NO作为主要空气污染物,其主要来源是汽车尾气,研究人员用活性炭对汽车尾气中的NO进行吸附,并发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ∆H<0.在恒压密闭容器中加入足量活性炭和一定量NO气体,反应相同时间时,测得NO的转化率α(NO)随温度的变化如图所示:

图中a、b、c三点中,达到平衡的点是
(3)现代技术用氨气将汽车尾气中的NOx还原为N2和H2O,反应原理是NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g) ∆H<0。
3H2O(g)+2N2(g) ∆H<0。①实际生产中NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g)的反应温度不宜过高的原因是
3H2O(g)+2N2(g)的反应温度不宜过高的原因是②500℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3,8min时反应达到平衡,此时NH3的转化率为40%,体系压强为p0MPa,则0~8min内用N2表示的平均反应速率v(N2)=
您最近一年使用:0次
2021-07-13更新
|
3547次组卷
|
8卷引用:青海省西宁市大通回族土族自治县2021届高三下学期高考二模化学试题
2020·浙江·模拟预测
10 . 下列说法不正确的是( )
A.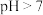 的溶液不一定呈碱性 的溶液不一定呈碱性 |
B.中和pH和体积均相等的氨水、 溶液,所需 溶液,所需 的物质的量相同 的物质的量相同 |
C.相同温度下,pH相等的盐酸、 溶液中, 溶液中,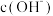 相等 相等 |
D.氨水和盐酸反应后的溶液,若溶液呈中性,则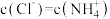 |
您最近一年使用:0次
2020-01-10更新
|
5363次组卷
|
28卷引用:青海省西宁市湟源县第一中学2020-2021学年高二上学期期中考试化学试题
青海省西宁市湟源县第一中学2020-2021学年高二上学期期中考试化学试题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)(已下线)2020年浙江省学业水平模拟考试化学试题【省级联考】浙江省2020年1月普通高中学业水平考试化学试题浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题河南省洛阳市2019-2020学年高二下学期期末质量检测化学试题(已下线)第03章 水溶液中的离子平衡(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)陕西省黄陵县中学2020-2021学年高二上学期期中考试化学试题(高新部)黑龙江省肇东市第四中学校2020-2021学年高二上学期期中考试化学试题(已下线)小题必刷30 水的电离与溶液的酸碱性——2021年高考化学一轮复习小题必刷(通用版本)(已下线)【浙江新东方】高中化学20210304-003(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省杭州市长征中学2020-2021学年高二下学期第二学期阶段性练习化学试题(已下线)考点23 弱电解质的电离-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)课时42 盐类的水解影响因素及应用-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题14.水溶液中的离子平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)考向24 弱电解质的电离平衡-备战2022年高考化学一轮复习考点微专题(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密10 水溶液中的离子平衡(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点26 弱电解质的电离-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题37 强弱电解质的判断与比较-备战2023年高考化学一轮复习考点微专题湖南省株洲市五雅中学2022-2023学年高二上学期11月期中考试化学试题(已下线)题型132 溶液酸碱性的判断与溶液pH的计算湖北省武汉市重点中学4G+联合体2022-2023学年高二上学期1月期末考试化学试题浙江省嘉兴八校2023-2024学年高二上学期11月期中联考化学试题



