1 . 赤铜矿(主要成分为 ,含少量
,含少量 、
、 )含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备
)含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备 晶体的流程为:
晶体的流程为: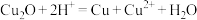
(1) 晶体结构如下图所示。晶体中存在的作用力包括离子键、
晶体结构如下图所示。晶体中存在的作用力包括离子键、_______ 。_______ 。 发生反应的离子方程式为
发生反应的离子方程式为_______ 。检验氧化完全的试剂为_______ (填化学式)。
(4)沉铁。离子浓度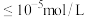 时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则
时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则 的
的 为
为_______ 。
(5)试从产率、试剂选择角度评价该制备流程并提出修改建议_______ 。
 ,含少量
,含少量 、
、 )含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备
)含铜量高达88.8%,是重要的冶金材料,某化学兴趣小组利用其制备 晶体的流程为:
晶体的流程为:
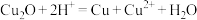
(1)
 晶体结构如下图所示。晶体中存在的作用力包括离子键、
晶体结构如下图所示。晶体中存在的作用力包括离子键、

 发生反应的离子方程式为
发生反应的离子方程式为(4)沉铁。离子浓度
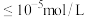 时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则
时,可认为该离子被沉淀完全。若室温下溶液pH应调节至略大于3.7,则 的
的 为
为(5)试从产率、试剂选择角度评价该制备流程并提出修改建议
您最近一年使用:0次
2 . 乙二胺四乙酸铁钠(化学式 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。
已知:① 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为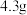 。
。
②乙二胺四乙酸( ,用
,用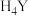 表示)是一种弱酸。
表示)是一种弱酸。
Ⅰ.制备
实验室用铁屑制备 的主要流程如下:
的主要流程如下:___________
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量 ,过程中浓度减少的离子有
,过程中浓度减少的离子有___________ (填离子符号)。
(3)“制备”步骤,向氧化所得的 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。
①从反应后的混合物中获得较高产率的 粗品的实验操作是,
粗品的实验操作是,___________ ,过滤,水洗,干燥。检验 是否洗净的试剂是
是否洗净的试剂是___________
②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是___________ 。
样品中乙二胺四乙酸铁钠纯度可用 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为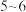 发生反应:
发生反应: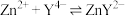 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
(4)补充完整实验方案:准确称取 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:___________ 。
 )是一种重要补铁剂,某小组以铁屑为原料制备
)是一种重要补铁剂,某小组以铁屑为原料制备 并测定其含量。
并测定其含量。已知:①
 是一种配合物,微溶于乙醇,
是一种配合物,微溶于乙醇, 时水中的溶解度为
时水中的溶解度为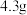 。
。②乙二胺四乙酸(
 ,用
,用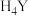 表示)是一种弱酸。
表示)是一种弱酸。Ⅰ.制备

实验室用铁屑制备
 的主要流程如下:
的主要流程如下:
A.升高温度 B.加快搅拌速率 C.缩短浸取时间
(2)向酸浸所得滤液中通入足量
 ,过程中浓度减少的离子有
,过程中浓度减少的离子有(3)“制备”步骤,向氧化所得的
 溶液中加入一定量
溶液中加入一定量
 ,控制反应温度为
,控制反应温度为 ,加入
,加入 溶液调节
溶液调节 为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为
为5,搅拌,直到溶液中出现少量浑浊。其中发生的反应为 。
。①从反应后的混合物中获得较高产率的
 粗品的实验操作是,
粗品的实验操作是, 是否洗净的试剂是
是否洗净的试剂是②保持其他条件不变,乙二胺四乙酸铁钠的产率随反应液
 的变化如图1所示。
的变化如图1所示。 过低或过高产品产率均减小的主要原因是
过低或过高产品产率均减小的主要原因是
样品中乙二胺四乙酸铁钠纯度可用
 标准溶液滴定。原理是在
标准溶液滴定。原理是在 为
为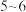 发生反应:
发生反应: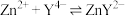 ,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。
,二甲酚橙作指示剂,滴定终点时溶液由紫红色变黄色。(4)补充完整实验方案:准确称取
 样品,溶于一定量的蒸馏水,加入掩蔽剂排除
样品,溶于一定量的蒸馏水,加入掩蔽剂排除 干扰,得到待测溶液
干扰,得到待测溶液 ,将溶液
,将溶液 完全转移到
完全转移到 容量瓶中定容;按规定操作分别将
容量瓶中定容;按规定操作分别将 标准溶液和待测溶液
标准溶液和待测溶液 装入如图2所示的滴定管中:
装入如图2所示的滴定管中:
您最近一年使用:0次
名校
解题方法
3 . 苯乙烯作为一种重要的基础有机化工原料,广泛用于合成塑料和橡胶。工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应Ⅰ: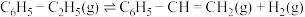

(1)近期有科技工作者结合是实验与计算机模拟结果,研究了乙苯在催化剂表面脱氢制苯乙烯的反应,其历程如下图所示(吸附在催化剂表面的物种用 标注):
标注):
___________  (计算结果保留整数)。
(计算结果保留整数)。
②依据上述反应历程,推测乙苯脱氢反应产生的副产物可能是___________ (填结构简式)
(2)在 下,乙苯直接脱氢反应的
下,乙苯直接脱氢反应的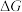 和
和 随温度的变化如图所示。
随温度的变化如图所示。___________ (选填“能”或“不能”)自发。
② 随温度的变化曲线为
随温度的变化曲线为___________ (选填“a”或“b”)。
(3)在某温度、 下,向反应器中充入
下,向反应器中充入 气态乙苯和
气态乙苯和 发生反应Ⅰ,其平衡转化率为
发生反应Ⅰ,其平衡转化率为 ,则乙苯脱氢反应的压强平衡常数
,则乙苯脱氢反应的压强平衡常数
___________ (计算时忽略副反应)。
(4)工业上还可以利用 氧化乙苯制乙烯,其原理为:反应Ⅱ:
氧化乙苯制乙烯,其原理为:反应Ⅱ: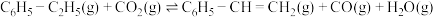
 ,在相同反应条件下,工业上可采用
,在相同反应条件下,工业上可采用 替代水蒸气进行乙苯脱氢反应,已知
替代水蒸气进行乙苯脱氢反应,已知 ;则
;则 代替水蒸气参与反应的优点有
代替水蒸气参与反应的优点有___________ 。
A.降低反应的能耗 B.乙苯转化率更高
C.提高了反应速率 D.提高了产物选择性
(5)苯乙烯被酸性高锰酸钾溶液充分氧化后的产物是___________ 和___________ (填名称)。
反应Ⅰ:
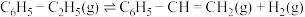

(1)近期有科技工作者结合是实验与计算机模拟结果,研究了乙苯在催化剂表面脱氢制苯乙烯的反应,其历程如下图所示(吸附在催化剂表面的物种用
 标注):
标注):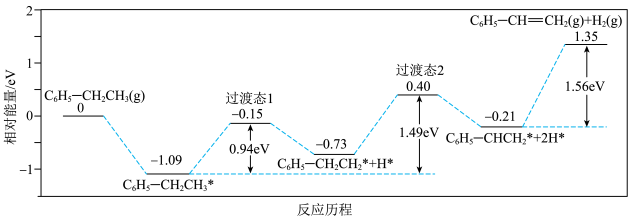

 (计算结果保留整数)。
(计算结果保留整数)。②依据上述反应历程,推测乙苯脱氢反应产生的副产物可能是
(2)在
 下,乙苯直接脱氢反应的
下,乙苯直接脱氢反应的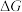 和
和 随温度的变化如图所示。
随温度的变化如图所示。
②
 随温度的变化曲线为
随温度的变化曲线为(3)在某温度、
 下,向反应器中充入
下,向反应器中充入 气态乙苯和
气态乙苯和 发生反应Ⅰ,其平衡转化率为
发生反应Ⅰ,其平衡转化率为 ,则乙苯脱氢反应的压强平衡常数
,则乙苯脱氢反应的压强平衡常数
(4)工业上还可以利用
 氧化乙苯制乙烯,其原理为:反应Ⅱ:
氧化乙苯制乙烯,其原理为:反应Ⅱ:
 ,在相同反应条件下,工业上可采用
,在相同反应条件下,工业上可采用 替代水蒸气进行乙苯脱氢反应,已知
替代水蒸气进行乙苯脱氢反应,已知 ;则
;则 代替水蒸气参与反应的优点有
代替水蒸气参与反应的优点有A.降低反应的能耗 B.乙苯转化率更高
C.提高了反应速率 D.提高了产物选择性
(5)苯乙烯被酸性高锰酸钾溶液充分氧化后的产物是
您最近一年使用:0次
4 . 某试样含有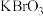 、
、 及㤢性物质。称取试样
及㤢性物质。称取试样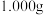 ,溶解后配制到
,溶解后配制到 容量瓶中。吸取
容量瓶中。吸取 ,在
,在 介质中用
介质中用 将
将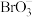 还原为
还原为 ,除去过量的
,除去过量的 后调至中性测定
后调至中性测定 ,消耗
,消耗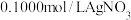 溶液
溶液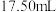 。另吸取
。另吸取 试液用
试液用 酸化后加热除去
酸化后加热除去 ,再调至中性,滴定过剩
,再调至中性,滴定过剩 时消耗了上述
时消耗了上述 溶液
溶液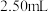 。计算试样中
。计算试样中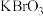 、
、 的质量分数
的质量分数_______ 、_______ 。
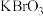 、
、 及㤢性物质。称取试样
及㤢性物质。称取试样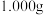 ,溶解后配制到
,溶解后配制到 容量瓶中。吸取
容量瓶中。吸取 ,在
,在 介质中用
介质中用 将
将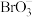 还原为
还原为 ,除去过量的
,除去过量的 后调至中性测定
后调至中性测定 ,消耗
,消耗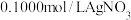 溶液
溶液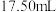 。另吸取
。另吸取 试液用
试液用 酸化后加热除去
酸化后加热除去 ,再调至中性,滴定过剩
,再调至中性,滴定过剩 时消耗了上述
时消耗了上述 溶液
溶液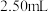 。计算试样中
。计算试样中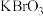 、
、 的质量分数
的质量分数
您最近一年使用:0次
名校
5 . 按要求回答下列问题:
(1)下列变化属于吸热反应的是______ (填序号)。
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤ 固体溶于水
固体溶于水
(2)强酸与强碱的稀溶液发生中和反应生成1mol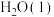 时的反应热
时的反应热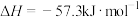 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为______ 。(结果保留小数点后一位)
(3)已知1g 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为______ ,试写出该反应的热化学方程式为______ 。
(4)试比较反应热的大小:
①

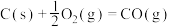
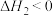
则
______  (填“>”或“<”,下同)。
(填“>”或“<”,下同)。
②已知常温时红磷比白磷稳定。
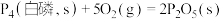

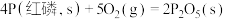

则
______  。
。
(5)已知:25℃、101kPa时,
①

②

③
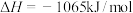
则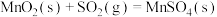

______ 。
(1)下列变化属于吸热反应的是
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤
 固体溶于水
固体溶于水(2)强酸与强碱的稀溶液发生中和反应生成1mol
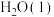 时的反应热
时的反应热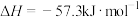 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为(3)已知1g
 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为(4)试比较反应热的大小:
①


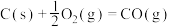
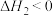
则

 (填“>”或“<”,下同)。
(填“>”或“<”,下同)。②已知常温时红磷比白磷稳定。
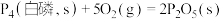

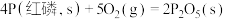

则

 。
。(5)已知:25℃、101kPa时,
①


②


③

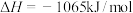
则

您最近一年使用:0次
2024-05-04更新
|
356次组卷
|
3卷引用:福建省泉州中远学校2024届高三下学期5月模拟化学试题
6 . 盐与碱的反应是水溶液中常见的反应,某学习小组展开相关探究。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=
①步骤a需要称量NaOH固体为______ g(保留一位小数)
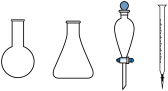
②步骤b需要用到下图所示仪器中的______ (填名称)。______ mol·g-1
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关
(2)NH4Cl溶液显酸性,用离子方程式解释原因:______ 。
(3)小组同学设计实验探究[c )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
①实验结果显示,NaCl溶液不具备抗碱能力,即曲线______ (填曲线标号)表示溶液1.
②实验结果显示,当[c( )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液______ (填溶液组号)
③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=______ (精确至小数点后1位)。
Ⅰ.NH4Cl抗碱容量(σ)的测定
(1)某小组同学测定NH4Cl固体抗碱容量的实验步骤如下:
a.配置100mL0.2mol·L-1NaOH溶液;
b.称取xgNH4Cl固体,溶于20mL水中,用上述NaOH溶液滴定至pH=11.
已知:氯化铵的抗碱容量是指用NaOH溶液滴定NH4Cl溶液至pH=11时,单位质量的NH4Cl所消耗NaOH的物质的量,即σ=

①步骤a需要称量NaOH固体为
②步骤b需要用到下图所示仪器中的
Ⅱ.NH4Cl-NH3混合溶液抗碱能力的探究
NH4Cl-NH3混合溶液具有抗碱能力。向该溶液中加入少量NaOH,溶液的pH变化不大。
已知:i.25℃时,NH3·H2O的Kb=1.75×10-5=10-4.8
ii.NH4Cl-NH3混合溶液的抗碱能力与
 、[c(
、[c( )+c(NH3)]有关
)+c(NH3)]有关(2)NH4Cl溶液显酸性,用离子方程式解释原因:
(3)小组同学设计实验探究[c
 )+c(NH3)]一定时,
)+c(NH3)]一定时, 对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示
对混合溶液抗碱能力的影响。分别向溶液1、溶液2、溶液3、溶液4中滴加0.1mol·L-1NaOH溶液,溶液的pH随加入NaOH的变化情况如下图所示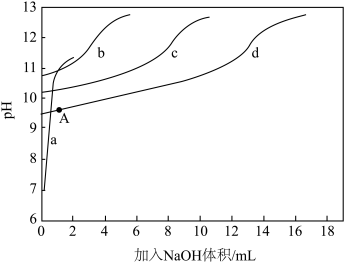
| 溶液组号 | 组成 | 体积/mL |
| 1 | 0.2mol·L-1NaCl溶液 | 15 |
| 2 | 0.1mol·L-1NH4Cl | 3 |
| 0.1mol·L-1氨水 | 12 | |
| 3 | 0.1mol·L-1NH4Cl | 7.5 |
| 0.1mol·L-1氨水 | 7.5 | |
| 4 | 0.1mol·L-1NH4Cl | 12 |
| 0.1mol·L-1氨水 | 3 |
②实验结果显示,当[c(
 )+c(NH3)]相同时,
)+c(NH3)]相同时, 越大,混合溶液的抗碱能力越强,则曲线b表示溶液
越大,混合溶液的抗碱能力越强,则曲线b表示溶液③已知A点时,c(NH4+)=c(NH3·H2O),则此时溶液的pH=
您最近一年使用:0次
解题方法
7 . 化合物Na3CrO8的负离子结构可表示为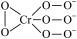 ,则Cr的化合价为
,则Cr的化合价为 呈四面体构型,结构为
呈四面体构型,结构为 , Cr2O
, Cr2O 由两个
由两个 四面体组成,这两个
四面体组成,这两个 四面体通过共用一个顶角氧原子彼此连接,结构为
四面体通过共用一个顶角氧原子彼此连接,结构为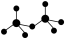 。则由n (n>1)个
。则由n (n>1)个 通过顶角氧原子连结的链式结构的通式为
通过顶角氧原子连结的链式结构的通式为
您最近一年使用:0次
8 . 卤素化合物在生产生活中应用广泛,回答下列问题
(1)研究表明 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: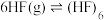 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是____________ ;在测定 相对分子质量的实验中,
相对分子质量的实验中,____________ (填“低压”或“高压”)有利于测定的准确性.
(2) 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为__________ ;产物中的另一种气体可以起到的作用是________________ .
(3) 与
与 以共价键形成
以共价键形成 ,其中
,其中________ 显负电性, 与水反应的方程式是
与水反应的方程式是____________ .
(4)利用 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: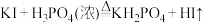 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:________ (“强酸性”“强氧化性”“高沸点”).
(1)研究表明
 气体中存在单体和环状六聚体的平衡:
气体中存在单体和环状六聚体的平衡: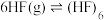 ,HF形成环状六聚体的作用力是
,HF形成环状六聚体的作用力是 相对分子质量的实验中,
相对分子质量的实验中,(2)
 气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸
气体是高效绿色消毒剂,但其性质不稳定,浓度大时会发生爆炸.可用草酸 和氯酸钾
和氯酸钾 在酸性条件下制备
在酸性条件下制备 ,离子方程式为
,离子方程式为(3)
 与
与 以共价键形成
以共价键形成 ,其中
,其中 与水反应的方程式是
与水反应的方程式是(4)利用
 和浓磷酸制备
和浓磷酸制备 的原理是:
的原理是: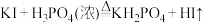 ,该反应中利用了浓磷酸的什么性质:
,该反应中利用了浓磷酸的什么性质:
您最近一年使用:0次
名校
解题方法
9 . 钇是稀土元素之一。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),用NaOH初步处理钇矿石可以得到Y(OH)3、Fe2O3、Na2SiO3和Na2BeO2的共熔物。工业上利用该共熔物制取氧化钇,并获得副产物铍,流程如图:
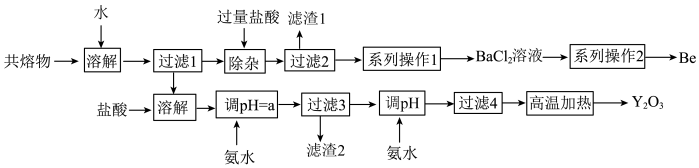
已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
(1)滤渣1的主要成分是_______ 。
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1_______ 。
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为_______ 。
(4)用氨水调节pH=a时,a的取值范围是_______ 。
(5)计算常温下Y3++3H2O Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=_______ 。(常温下Ksp[Y(OH)3]=8.0×10-23)
(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为_______ 。
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由_______ 。

已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.3 |
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为
(4)用氨水调节pH=a时,a的取值范围是
(5)计算常温下Y3++3H2O
 Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由
您最近一年使用:0次
名校
解题方法
10 . 金属锡及其化合物在生产和科研中应用广泛。回答下列问题:
(1)某种含锡的有机金属化合物的结构如图所示。已知烷基配位体以C、N整合形式键合于Sn原子。_______ ,在周期表中的位置为_______ ,C、Si、Cl电负性由大到小的顺序为_______ 。
②该化合物中共有_______ 种杂化方式;提供电子对形成配位键的原子是_______ 。
(2)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。_______ ,晶胞中Sn的配位数与Cu的配位数之比为_______ 。
②立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为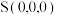 、
、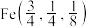 ,则晶胞中Sn原子的分数坐标为
,则晶胞中Sn原子的分数坐标为_______ ;晶胞中Sn原子和Cu原子间的最短距离为_______ pm。
(1)某种含锡的有机金属化合物的结构如图所示。已知烷基配位体以C、N整合形式键合于Sn原子。
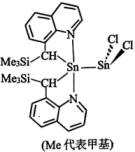
②该化合物中共有
(2)一种含锡的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为90°,其结构可看作是由两个立方体A、B上下堆叠而成。如图,甲为A的体对角线投影图,乙为B的沿y轴方向的投影图。A中Fe、Sn位置互换即为B。

②立方体A、B棱长均为a pm,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。晶胞中部分原子的分数坐标为
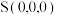 、
、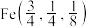 ,则晶胞中Sn原子的分数坐标为
,则晶胞中Sn原子的分数坐标为
您最近一年使用:0次



