名校
解题方法
1 . 用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是

| A.若②中为浓盐酸,产生大量气体:说明硫酸的酸性比盐酸强 |
| B.若②中为铜片,有气泡产生,底部生成灰白色固体:说明浓硫酸有强氧化性 |
| C.若②中为蓝色硫酸铜晶体,蓝色晶体变为白色:说明浓硫酸有吸水性,发生物理变化 |
| D.若②为蔗糖,白色固体变为黑色海绵状,有气体放出:说明浓硫酸有脱水性、强氧化性 |
您最近一年使用:0次
2021-03-11更新
|
872次组卷
|
20卷引用:鲁科版必修一2019—2020学年第三章检测试题
鲁科版必修一2019—2020学年第三章检测试题(已下线)第三单元 物质的性质与转化(基础过关)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题福建省泉州市泉港区第一中学2018-2019学年高一下学期期中考试化学试题云南省通海县三中2019-2020学年高二9月份(开学考试)化学试题云南省文山州马关县二中2019-2020学年高二上学期9月份考试化学试题云南省弥勒市第二中学2019-2020学年高二上学期开学考试化学试题福建省南安市侨光中学2019-2020学年高一下学期第一次阶段考化学试题黑龙江省肇州县第二中学2019-2020学年高一下学期3月月考化学试题专题4 第一单元综合拔高练-高中化学苏教2019版必修第一册山东省青岛第二中学2020-2021学年高一上学期12月月考化学试题(已下线)【浙江新东方】高中化学20210304-020浙江省诸暨市第二高级中学2020-2021学年高一下学期期中考试化学试题 (已下线)4.1.2 硫酸的工业制备 浓硫酸的性质(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)(已下线)6.3.2 化工生产(第2课时 节约资源和环境保护)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)河北省定州市2021-2022学年高一下学期期中考试化学试题河北保定市唐县田家炳中学2021-2022学年高三上学期11月化学试题广东实验中学越秀学校2023-2024学年高一3月段考化学试题安徽省滁州市定远县育才学校2022-2023学年高一下学期期末考试化学试卷 云南省丽江润泽高级中学2023-2024学年高一下学期3月月中考试化学试题
名校
解题方法
2 . 如图所示是实验室制取 并验证
并验证 的某些性质的装置图。
的某些性质的装置图。
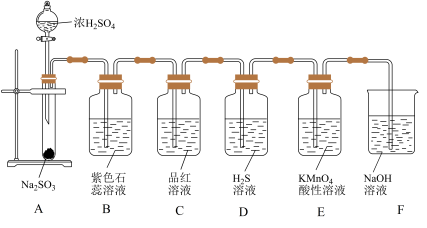
试回答下列问题:
(1)在A中发生反应的化学方程式为______ 。
(2)B中的实验现象为______ ,此实验证明 与水反应生成的产物呈
与水反应生成的产物呈______ 性。
(3)C中的品红溶液______ ,证明 有
有______ 。
(4)D中的实验现象是______ ,证明 有
有______ 性。
(5)E中的实验现象是______ ,证明 有
有______ 性。
(6)F的作用是______ ,反应的化学方程式为______ 。
 并验证
并验证 的某些性质的装置图。
的某些性质的装置图。
试回答下列问题:
(1)在A中发生反应的化学方程式为
(2)B中的实验现象为
 与水反应生成的产物呈
与水反应生成的产物呈(3)C中的品红溶液
 有
有(4)D中的实验现象是
 有
有(5)E中的实验现象是
 有
有(6)F的作用是
您最近一年使用:0次
2021-02-16更新
|
1597次组卷
|
12卷引用:人教版高中化学必修1第四章《非金属及其化合物》测试卷2
人教版高中化学必修1第四章《非金属及其化合物》测试卷2(已下线)第五章 化工生产中的重要非金属元素(基础过关卷)-2020-2021学年高一化学必修第二册章末集训必刷卷(新教材人教版)黑龙江省双鸭山市第一中学2017-2018学年高一3月开学考试化学试题云南省西双版纳州2017-2018学年高一学年学业达标测试化学试题【区级联考】安徽省宿州市埇桥区2018-2019学年高一上学期期末考试化学试题新疆疏勒县八一中学2018-2019学年高一上学期期末考试化学试题吉林省白城市第十四中学2019-2020学年高一上学期期末考试化学试题甘肃省静宁县第一中学2019-2020学年高一下学期第一次月考化学试题高一必修第一册(苏教2019)专题4 第一单元 含硫化合物的性质4(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物湖北省宜昌英杰学校2020-2021学年高一下学期3月测试化学试题第2课时 实验室里研究不同价态硫元素之间的转化
3 . 二氧化氯( )是易溶于水且不与水发生化学反应的黄绿色气体,沸点为
)是易溶于水且不与水发生化学反应的黄绿色气体,沸点为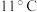 ,可与NaOH反应,可用于处理含硫废水。某小组在实验室探究
,可与NaOH反应,可用于处理含硫废水。某小组在实验室探究 与
与 的反应。请回答下列问题:
的反应。请回答下列问题:

(1) 的制备(已知:
的制备(已知: )
)
①装置A中发生反应的化学方程式为_______________________________ 。
②欲收集一定量的 ,其连接顺序为
,其连接顺序为
__________ (按气流方向从左向右,用小写字母表示)。
(2) 与
与 的反应
的反应
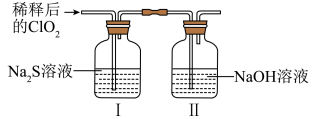
将上述收集到的 用
用 稀释以增强其稳定性,并将适量的稀释后的
稀释以增强其稳定性,并将适量的稀释后的 通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究装置Ⅰ中反应的产物。
通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究装置Ⅰ中反应的产物。
④ 与
与 反应的离子方程式为
反应的离子方程式为_______________________________ 。用于处理含硫废水时, 相对于
相对于 的优点是
的优点是_______________________________ (任写一条)。
 )是易溶于水且不与水发生化学反应的黄绿色气体,沸点为
)是易溶于水且不与水发生化学反应的黄绿色气体,沸点为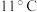 ,可与NaOH反应,可用于处理含硫废水。某小组在实验室探究
,可与NaOH反应,可用于处理含硫废水。某小组在实验室探究 与
与 的反应。请回答下列问题:
的反应。请回答下列问题:
(1)
 的制备(已知:
的制备(已知: )
)①装置A中发生反应的化学方程式为
②欲收集一定量的
 ,其连接顺序为
,其连接顺序为
(2)
 与
与 的反应
的反应将上述收集到的
 用
用 稀释以增强其稳定性,并将适量的稀释后的
稀释以增强其稳定性,并将适量的稀释后的 通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究装置Ⅰ中反应的产物。
通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究装置Ⅰ中反应的产物。
| 操作步骤 | 实验现象 | 结论 |
| 取少量装置Ⅰ中溶液于试管甲中,滴加品红溶液和盐酸 | 溶液始终不褪色 | ①无 |
另取少量装置Ⅰ中溶液于试管乙中,加入 溶液,振荡 溶液,振荡 | ② | 有 生成 生成 |
③继续在试管乙中滴加 溶液至过量,静置,取上层清液于试管丙中, 溶液至过量,静置,取上层清液于试管丙中, | 有白色沉淀生成 | 有 生成 生成 |
 与
与 反应的离子方程式为
反应的离子方程式为 相对于
相对于 的优点是
的优点是
您最近一年使用:0次
2020-10-10更新
|
1221次组卷
|
2卷引用:高一必修第一册(苏教2019)专题4 专题综合检测卷
名校
4 . 化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
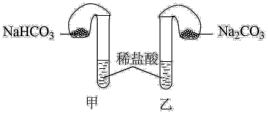
请回答:
(1)各组反应开始时,________ 装置中的气球体积先变大,该装置中反应的离子方程式是_________________________ 。
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
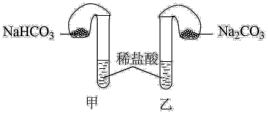
请回答:
(1)各组反应开始时,
(2)当试管中不再有气体生成时,三组实验出现不同现象,填写下表的空格。
| 试剂用量 | 实验现象 | 分析原因 | |
| 第①组 | 042g NaHCO3 053g Na2CO3 10mL 4mol/L盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n(Na2CO3) V甲(CO2)=V乙(CO2) |
| 第②组 | 03g NaHCO3 03g Na2CO3 10mL 4mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 第③组 | 1.0g NaHCO3 1.0g Na2CO3 10mL 1mol/L盐酸 | 甲中气球比乙中气球的体积大 | |
| 片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用离子方程式表示) |
您最近一年使用:0次
2020-11-17更新
|
404次组卷
|
3卷引用:第二章 海水中的重要元素——钠和氯(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
(已下线)第二章 海水中的重要元素——钠和氯(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)山东师范大学附属中学2020-2021学年高一11月学分认定考试(期中)化学试题河北省祖冲之中学2020-2021学年高一上学期期中考试化学试题
解题方法
5 . 喷泉是一种常见的现象,其产生的原理是存在压强差。

试回答下列问题:
(1)实验室制取氨气的化学方程式为________ 。
①用图A装置进行喷泉实验,上部烧瓶已充满干燥的氨气,引发喷泉的操作是_______ 。
②利用图B装置引发喷泉的操作是___________ 。
(2)利用图C装置,在锥形瓶中分别加入足量的下列物质,反应后可能产生喷泉的有______ 。
A. 与稀盐酸 B.
与稀盐酸 B. 与稀硫酸
与稀硫酸
C. 与稀硝酸 D.
与稀硝酸 D. 溶液与
溶液与 溶液
溶液
(3)在图D装置的锥形瓶中加入乙醇,瓶外放一水槽,水槽中加入冷水后,再加入足量的下列物质,结果也形成了喷泉,水槽中加入的物质可能是_____ 。
A 浓硫酸 B 食盐 C 硝酸钾 D 硫酸铜
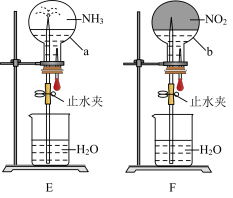
(4)同温同压下,两个等体积的干燥圆底烧瓶中分别充满 和
和 ,进行喷泉实验如图E、F所示,经充分反应后,发现烧瓶a中充满液体,b中有
,进行喷泉实验如图E、F所示,经充分反应后,发现烧瓶a中充满液体,b中有 体积的液体,则两烧瓶内溶质的物质的量浓度的关系是
体积的液体,则两烧瓶内溶质的物质的量浓度的关系是_______ 。
A.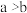 B.
B. C.
C. D.不能确定
D.不能确定

试回答下列问题:
(1)实验室制取氨气的化学方程式为
①用图A装置进行喷泉实验,上部烧瓶已充满干燥的氨气,引发喷泉的操作是
②利用图B装置引发喷泉的操作是
(2)利用图C装置,在锥形瓶中分别加入足量的下列物质,反应后可能产生喷泉的有
A.
 与稀盐酸 B.
与稀盐酸 B. 与稀硫酸
与稀硫酸C.
 与稀硝酸 D.
与稀硝酸 D. 溶液与
溶液与 溶液
溶液(3)在图D装置的锥形瓶中加入乙醇,瓶外放一水槽,水槽中加入冷水后,再加入足量的下列物质,结果也形成了喷泉,水槽中加入的物质可能是
A 浓硫酸 B 食盐 C 硝酸钾 D 硫酸铜
(4)同温同压下,两个等体积的干燥圆底烧瓶中分别充满
 和
和 ,进行喷泉实验如图E、F所示,经充分反应后,发现烧瓶a中充满液体,b中有
,进行喷泉实验如图E、F所示,经充分反应后,发现烧瓶a中充满液体,b中有 体积的液体,则两烧瓶内溶质的物质的量浓度的关系是
体积的液体,则两烧瓶内溶质的物质的量浓度的关系是
A.
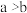 B.
B. C.
C. D.不能确定
D.不能确定
您最近一年使用:0次
2020-09-16更新
|
322次组卷
|
2卷引用:鲁科版(2019)高一必修第一册高效手册——第3章 物质的性质与转化
解题方法
6 . 实验探究;探究碳、硅元素的非金属性的相对强弱。根据要求回答下列问题。
(1)实验装置(部分夹持装置已略)
仪器a的名称为__________________ 。
(2)实验步骤
连接装置、__________ 、加药品后,打开K,然后滴入浓硫酸,加热。
(3)问题探究(已知酸性: ,
, 为白色沉淀)
为白色沉淀)
①Cu与浓硫酸反应的化学方程式是________ ;装置C中酸性 溶液的作用是
溶液的作用是_________ 。
②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是___________ 。
③依据装置B中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性________ (填“能”或“否"),装置B中发生反应的离子方程式是______________________ 。
(1)实验装置(部分夹持装置已略)

仪器a的名称为
(2)实验步骤
连接装置、
(3)问题探究(已知酸性:
 ,
, 为白色沉淀)
为白色沉淀)①Cu与浓硫酸反应的化学方程式是
 溶液的作用是
溶液的作用是②能说明碳元素的非金属性比硅元素的非金属性强的实验现象是
③依据装置B中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性
您最近一年使用:0次
名校
解题方法
7 . 某课外活动小组为了检验钠与水反应的产物,设计如图所示实验装置(夹持装置已略去)。首先在U形管内加入少量煤油和几粒钠块,再从U形管左端加入水(含有酚酞),赶出装置中空气后加热铜丝。

根据反应中观察到的现象,回答下列问题:
(1)U形管中溶液的颜色_______ ,说明有______ 生成。
(2)铜丝的变化现象:_________ ,说明有______ 生成。
(3)若ag钠与bmL水(设水的密度为1g/mL且水足量)完全反应,则该溶液中溶质的质量分数是_______ 。

根据反应中观察到的现象,回答下列问题:
(1)U形管中溶液的颜色
(2)铜丝的变化现象:
(3)若ag钠与bmL水(设水的密度为1g/mL且水足量)完全反应,则该溶液中溶质的质量分数是
您最近一年使用:0次
2020-09-22更新
|
289次组卷
|
2卷引用:高一必修第一册(鲁科2019)第1章 章末综合检测卷
解题方法
8 . 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课外活动小组设计了下列装置进行探究。广口瓶②、③中分别装有试剂X和试剂Y,④、⑤中均是干燥的过氧化钠。
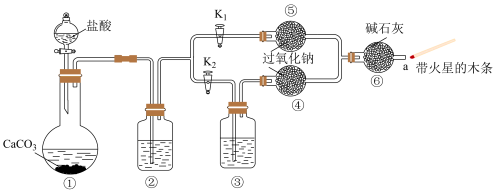
【实验与现象】
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条不复燃。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条复燃。
【思考与分析】
(1)装置①中反应的离子方程式是_________ 。
(2)装置②中的试剂X是__________ ;装置③中的试剂Y是____________ (填序号)。
A.浓H2SO4 B.饱和食盐水
C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
【结论与反思】
(3)根据步骤1和步骤2的实验现象,得到的结论是_________ 。
(4)实验后有同学提出质疑: “步骤2的实验并不能证明过氧化钠跟二氧化碳发生了化学反应。”小组其他同学也认为很有道理,请写出其理由的方程式_______________ 。
(5)若要证明“过氧化钠跟二氧化碳发生了化学反应”,需要补充的实验操作是:取⑤中反应后的少量固体,___________________ 。

【实验与现象】
步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条不复燃。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条复燃。
【思考与分析】
(1)装置①中反应的离子方程式是
(2)装置②中的试剂X是
A.浓H2SO4 B.饱和食盐水
C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
【结论与反思】
(3)根据步骤1和步骤2的实验现象,得到的结论是
(4)实验后有同学提出质疑: “步骤2的实验并不能证明过氧化钠跟二氧化碳发生了化学反应。”小组其他同学也认为很有道理,请写出其理由的方程式
(5)若要证明“过氧化钠跟二氧化碳发生了化学反应”,需要补充的实验操作是:取⑤中反应后的少量固体,
您最近一年使用:0次
9 . 用相同的铝片、6 mol·L-1稀盐酸、3 mol·L-1稀硫酸、6 mol·L-1氢氧化钠溶液、试管等分别进行下表实验:
对上述实验的相关说法不正确 的是
| 实验方案 | 实验现象 | 实验原理(化学方程式) |
| (1)铝片与足量盐酸反应 | 铝片开始无现象,一段时间后逐渐溶解,并有大量气泡产生 | Al2O3+6HCl=2AlCl3+3H2O 2Al+6HCl=2AlCl3+3H2↑ |
| (2)铝片与足量硫酸反应 | 铝片开始无现象,一段时间后反应缓慢,铝片表面有少量气泡产生 | Al2O3+3H2SO4=2Al2(SO4)3+3H2O 2Al+3H2SO4=2Al2(SO4)3+3H2↑ |
| (3)铝片与足量氢氧化钠溶液反应 | 铝片开始无现象,一段时间后铝片逐渐溶解,并有大量气泡产生 | Al2O3+2NaOH=2NaAlO2+H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
| A.对比(1)、(2)、(3)中Al2O3参与的反应可得出:Al2O3既有碱性氧化物的某些性质,又有酸性氧化物的某些性质 |
| B.对比(1)、(2)、(3)中气体产生现象和酸碱的挥发性可得出:实验(3)最适宜于实验室制备H2 |
| C.对比实验(1)、(2)中后来产生气泡的现象,可得出:c(H+)越大,相同时间内产生气泡越多 |
D.对比实验(1)、(2)中后来产生气泡的现象,可得出: 对Al与H+的反应可能有阻碍作用 对Al与H+的反应可能有阻碍作用 |
您最近一年使用:0次
2020-10-31更新
|
314次组卷
|
3卷引用:第3章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)
(已下线)第3章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)江苏省徐州市沛县2020-2021学年高一上学期第一次学情调研化学试题吉林省吉化第一高级中学校2020-2021学年高一上学期第一次月考化学试题
解题方法
10 . 为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究性学习小组设计了如图所示的发生装置。

(1)Y可以选用______________ (填序号)。
A.苯 B.饱和食盐水 C.四氯化碳
(2)实验前检验该装置气密性的方法是____________________________________ 。
(3)钠能在 气体中燃烧。他们对钠在
气体中燃烧。他们对钠在 气体中燃烧后的产物中的自色物质进行了如下探究:
气体中燃烧后的产物中的自色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入盛满 的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。
的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。
【提出假设】
假设1:白色物质是 ,
,
假设2:白色物质是 ,
,
假设3:白色物质是_________________ 。
(4)【设计实验方案·验证假设】该小组对燃烧后的自色产物进行如下探究:
【思考与交流】
①甲同学认为白色物质有可能是氢氧化钠,你是否同意丙同学的观点?并简述理由:___________________ 。
②乙同学认为方案1得到的结论不正确,其理由是_________________ 。钠在二氧化碳中燃烧的化学方程式为____________________________________ 。

(1)Y可以选用
A.苯 B.饱和食盐水 C.四氯化碳
(2)实验前检验该装置气密性的方法是
(3)钠能在
 气体中燃烧。他们对钠在
气体中燃烧。他们对钠在 气体中燃烧后的产物中的自色物质进行了如下探究:
气体中燃烧后的产物中的自色物质进行了如下探究:【实验】将燃烧的钠迅速伸入盛满
 的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。
的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质。【提出假设】
假设1:白色物质是
 ,
,假设2:白色物质是
 ,
,假设3:白色物质是
(4)【设计实验方案·验证假设】该小组对燃烧后的自色产物进行如下探究:
实验操作 | 实验现象 | 结论 | |
方案1 | 取少量白色产物于试管中,加入适量水,振荡,样品全部溶于水,向其中加入酚酞试液 | 溶液变成红色 | 白色物质为 |
方案2 | ①取少量白色产物于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的 溶液 溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加酚酞试液 | 无明显现象 |
【思考与交流】
①甲同学认为白色物质有可能是氢氧化钠,你是否同意丙同学的观点?并简述理由:
②乙同学认为方案1得到的结论不正确,其理由是
您最近一年使用:0次



