2024高三·全国·专题练习
1 . 除去废水中Cr( )的方法有多种。请按要求回答下列问题。
)的方法有多种。请按要求回答下列问题。
(1)NaHSO3与熟石灰除Cr( )法:向酸性废水中加入NaHSO3,再加入熟石灰,使Cr3+沉淀。
)法:向酸性废水中加入NaHSO3,再加入熟石灰,使Cr3+沉淀。
①实验中NaHSO3的作用是___________ 。
②Cr( )在水溶液中的存在形态分布如图1所示。当pH>12时,Cr(
)在水溶液中的存在形态分布如图1所示。当pH>12时,Cr( )去除率下降的原因可用离子方程式表示为
)去除率下降的原因可用离子方程式表示为___________ 。
用硫酸盐还原菌(SRB)处理含Cr( )的废水时,Cr(
)的废水时,Cr( )去除率随温度的变化如图2所示。55 ℃时,Cr(Ⅵ)去除率很低的原因是
)去除率随温度的变化如图2所示。55 ℃时,Cr(Ⅵ)去除率很低的原因是___________ 。
①“酸浸、还原”时,反应的化学方程式为___________ 。
该步骤若pH过低,则消耗Na2S2O5的量比理论值高出许多,其原因是___________ (文字叙述)。
②“沉铬”时所发生反应的离子方程式为___________ 。能不能将纯碱改为足量NaOH溶液?___________ 。(给出结论,并结合离子方程式给出理由)
 )的方法有多种。请按要求回答下列问题。
)的方法有多种。请按要求回答下列问题。(1)NaHSO3与熟石灰除Cr(
 )法:向酸性废水中加入NaHSO3,再加入熟石灰,使Cr3+沉淀。
)法:向酸性废水中加入NaHSO3,再加入熟石灰,使Cr3+沉淀。①实验中NaHSO3的作用是
②Cr(
 )在水溶液中的存在形态分布如图1所示。当pH>12时,Cr(
)在水溶液中的存在形态分布如图1所示。当pH>12时,Cr( )去除率下降的原因可用离子方程式表示为
)去除率下降的原因可用离子方程式表示为
用硫酸盐还原菌(SRB)处理含Cr(
 )的废水时,Cr(
)的废水时,Cr( )去除率随温度的变化如图2所示。55 ℃时,Cr(Ⅵ)去除率很低的原因是
)去除率随温度的变化如图2所示。55 ℃时,Cr(Ⅵ)去除率很低的原因是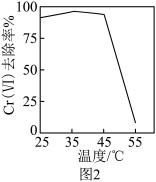

①“酸浸、还原”时,反应的化学方程式为
该步骤若pH过低,则消耗Na2S2O5的量比理论值高出许多,其原因是
②“沉铬”时所发生反应的离子方程式为
您最近一年使用:0次
2 . 锗是一种战略性金属,广泛应用于光学及电子工业领域。一种用锌浸渣(主要含 、
、 ,另含少量ZnS、
,另含少量ZnS、 以及
以及 )提取Ge和
)提取Ge和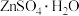 的工艺流程如下:
的工艺流程如下: ,
, 时主要为
时主要为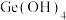 。
。
②常温下, ,
, 。
。
请回答下列问题:
(1)Ge是第四周期第ⅣA族元素,其基态原子的价层电子排布式为___________ 。
(2)“氧化酸浸”工序中,溶液 ,浸渣的主要成分为
,浸渣的主要成分为 、S和
、S和___________ (填化学式); 被双氧水氧化的离子方程式为
被双氧水氧化的离子方程式为___________ 。
(3)“中和沉淀”工序中,所加化合物A为___________ (填一种物质的化学式);调节溶液 ,Ge和Fe共沉淀,此时滤液中
,Ge和Fe共沉淀,此时滤液中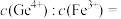
___________ 。
(4)① 在水溶液中的溶解度曲线如图所示,则从滤液中回收
在水溶液中的溶解度曲线如图所示,则从滤液中回收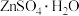 的操作为蒸发浓缩、
的操作为蒸发浓缩、___________ 、洗涤、干燥。 溶液可制取金属锌,电解后的溶液可在上述流程中
溶液可制取金属锌,电解后的溶液可在上述流程中___________ 工序循环使用。
(5)“水解”工序中, 水解生成
水解生成 的化学方程式为
的化学方程式为___________ ; 的沸点(1200℃)远高于
的沸点(1200℃)远高于 的沸点(84℃),其原因为
的沸点(84℃),其原因为___________ 。
(6)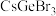 是一种可用于制作太阳电池的钙钛矿型材料,其立方晶胞如图所示,Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为
是一种可用于制作太阳电池的钙钛矿型材料,其立方晶胞如图所示,Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为___________ (填“体心”“面心”或“顶角”);晶体中一个Cs周围与其距离最近的Br的个数为___________ 。
 、
、 ,另含少量ZnS、
,另含少量ZnS、 以及
以及 )提取Ge和
)提取Ge和 的工艺流程如下:
的工艺流程如下: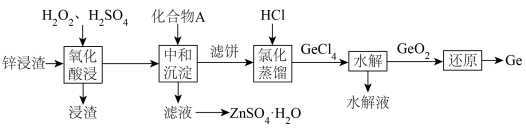
 ,
, 时主要为
时主要为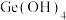 。
。②常温下,
 ,
, 。
。请回答下列问题:
(1)Ge是第四周期第ⅣA族元素,其基态原子的价层电子排布式为
(2)“氧化酸浸”工序中,溶液
 ,浸渣的主要成分为
,浸渣的主要成分为 、S和
、S和 被双氧水氧化的离子方程式为
被双氧水氧化的离子方程式为(3)“中和沉淀”工序中,所加化合物A为
 ,Ge和Fe共沉淀,此时滤液中
,Ge和Fe共沉淀,此时滤液中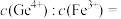
(4)①
 在水溶液中的溶解度曲线如图所示,则从滤液中回收
在水溶液中的溶解度曲线如图所示,则从滤液中回收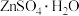 的操作为蒸发浓缩、
的操作为蒸发浓缩、
 溶液可制取金属锌,电解后的溶液可在上述流程中
溶液可制取金属锌,电解后的溶液可在上述流程中(5)“水解”工序中,
 水解生成
水解生成 的化学方程式为
的化学方程式为 的沸点(1200℃)远高于
的沸点(1200℃)远高于 的沸点(84℃),其原因为
的沸点(84℃),其原因为(6)
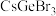 是一种可用于制作太阳电池的钙钛矿型材料,其立方晶胞如图所示,Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为
是一种可用于制作太阳电池的钙钛矿型材料,其立方晶胞如图所示,Cs与Br的最短距离比Ge与Br的最短距离大,则Ge在晶胞中的位置为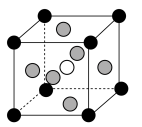
您最近一年使用:0次
3 . 碲被誉为金属性最强的非金属,某科研小组从碲渣(主要含有Cu2Te )中提取粗碲的工艺流程如图所示。下列有关说法错误的是
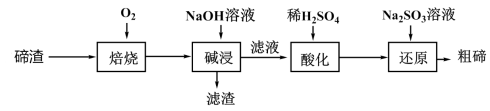
| A.“焙烧”后铜以Cu2O形式存在 |
| B.“碱浸”后过滤用到的主要仪器有:烧杯、漏斗、玻璃棒 |
| C.“酸化”后生成Te(SO4)2 |
| D.“还原”后,溶液的酸性减弱 |
您最近一年使用:0次
4 . 下列装置及操作能达到实验目的的是
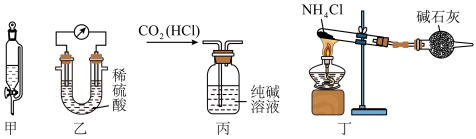
| A.利用甲装置用四氯化碳萃取碘水中的碘 | B.利用乙装置验证金属镁、铝的活泼性 |
C.利用丙装置除去 气体中混有的少量HCl 气体中混有的少量HCl | D.利用丁装置制备少量 |
您最近一年使用:0次
2024高三·全国·专题练习
5 . 含氮化合物(NOx、NO 等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
 .NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图1所示;若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。
.NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图1所示;若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。___________ 。用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,第一步反应的化学方程式为___________ 。
 .用铁去除含氮废水中的硝酸盐(
.用铁去除含氮废水中的硝酸盐( )是重要的方法。一种去除
)是重要的方法。一种去除 的过程如图:
的过程如图:___________ 。酸化废水与铁粉反应的离子方程式是___________ 。
(3)研究发现Fe2+能与FeO(OH)反应生成Fe3O4,在去除 的过程中,Fe3O4(导电)覆盖在铁粉表面,随着反应的进行,产生FeO(OH)(不导电),它覆盖在Fe3O4表面,形成钝化层,阻碍电子传输,导致
的过程中,Fe3O4(导电)覆盖在铁粉表面,随着反应的进行,产生FeO(OH)(不导电),它覆盖在Fe3O4表面,形成钝化层,阻碍电子传输,导致 的去除率低。若要提高
的去除率低。若要提高 的去除率,可采取的措施是
的去除率,可采取的措施是___________ 。
 .测定某废水中
.测定某废水中 含量。先取V mL含
含量。先取V mL含 水样并将O2去除,加入催化剂、V1 mL c1 mol·L-1 FeSO4标准溶液(过量),再加入稀硫酸;最后用c2 mol·L-1的K2Cr2O7标准溶液滴定剩余的Fe2+,滴定至终点时消耗V2 mL。
水样并将O2去除,加入催化剂、V1 mL c1 mol·L-1 FeSO4标准溶液(过量),再加入稀硫酸;最后用c2 mol·L-1的K2Cr2O7标准溶液滴定剩余的Fe2+,滴定至终点时消耗V2 mL。
已知:3Fe2++ +4H+=NO↑+3Fe3++2H2O,
+4H+=NO↑+3Fe3++2H2O,  +14H++6Fe2+=2Cr3++6Fe3++7H2O。
+14H++6Fe2+=2Cr3++6Fe3++7H2O。
(4)若需要480 mL FeSO4、K2Cr2O7标准溶液,配制时所需的仪器有天平、量筒、烧杯、玻璃棒、___________ 。
(5)加入稀硫酸的作用是___________ 。
(6)水样中NO 的含量为
的含量为___________ mol·L-1(用含c1、c2、V1、V2、V的代数式表示)。
 等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
等)是大气主要污染物之一,消除含氮化合物的污染备受关注。 .NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图1所示;若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。
.NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图1所示;若用H2模拟尾气中还原性气体研究Ba(NO3)2的催化还原过程,该过程分两步进行,图2表示该过程相关物质浓度随时间的变化关系。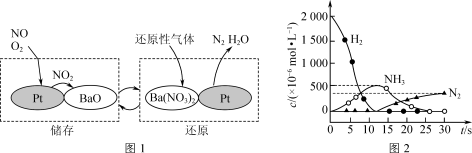
 .用铁去除含氮废水中的硝酸盐(
.用铁去除含氮废水中的硝酸盐( )是重要的方法。一种去除
)是重要的方法。一种去除 的过程如图:
的过程如图: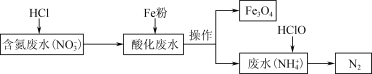
(3)研究发现Fe2+能与FeO(OH)反应生成Fe3O4,在去除
 的过程中,Fe3O4(导电)覆盖在铁粉表面,随着反应的进行,产生FeO(OH)(不导电),它覆盖在Fe3O4表面,形成钝化层,阻碍电子传输,导致
的过程中,Fe3O4(导电)覆盖在铁粉表面,随着反应的进行,产生FeO(OH)(不导电),它覆盖在Fe3O4表面,形成钝化层,阻碍电子传输,导致 的去除率低。若要提高
的去除率低。若要提高 的去除率,可采取的措施是
的去除率,可采取的措施是 .测定某废水中
.测定某废水中 含量。先取V mL含
含量。先取V mL含 水样并将O2去除,加入催化剂、V1 mL c1 mol·L-1 FeSO4标准溶液(过量),再加入稀硫酸;最后用c2 mol·L-1的K2Cr2O7标准溶液滴定剩余的Fe2+,滴定至终点时消耗V2 mL。
水样并将O2去除,加入催化剂、V1 mL c1 mol·L-1 FeSO4标准溶液(过量),再加入稀硫酸;最后用c2 mol·L-1的K2Cr2O7标准溶液滴定剩余的Fe2+,滴定至终点时消耗V2 mL。已知:3Fe2++
 +4H+=NO↑+3Fe3++2H2O,
+4H+=NO↑+3Fe3++2H2O,  +14H++6Fe2+=2Cr3++6Fe3++7H2O。
+14H++6Fe2+=2Cr3++6Fe3++7H2O。(4)若需要480 mL FeSO4、K2Cr2O7标准溶液,配制时所需的仪器有天平、量筒、烧杯、玻璃棒、
(5)加入稀硫酸的作用是
(6)水样中NO
 的含量为
的含量为
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
6 . 探究影响H2O2分解速率的影响因素,实验方案如图所示。
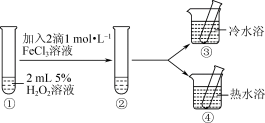
| A.热水浴的温度越高,其对比实验现象越明显 |
| B.H2O2易溶于水,主要是由于H2O2与H2O分子之间能形成氢键 |
| C.对比①②,可探究FeCl3溶液对H2O2分解速率的影响 |
| D.对比②③④,可探究温度对H2O2分解速率的影响 |
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
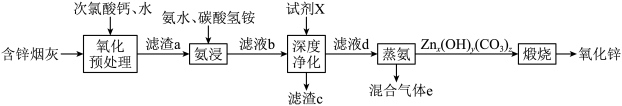
7 . 氧化锌在橡胶、油漆涂料、化工、医疗及食品等行业有着广泛应用。一种以含锌烟灰(含有ZnO、CuO、PbO、FeO、Fe2O3、MnO、MnO2、CdO等)为原料制备氧化锌的工艺流程如图所示:
②25℃时相关物质的Ksp如下表:
③ Zn(OH)2和ZnCO3的分解温度分别为125℃、300℃。
请回答下列问题:
(1)“氧化预处理”阶段得到的氧化产物有FeOOH、MnO2,写出生成FeOOH的离子方程式:___________ ;“氧化预处理”的目的是___________ 。
(2)若“氨浸”阶段溶解ZnO时消耗的n(NH3·H2O)∶n(NH4HCO3)=2∶1,写出该反应的离子方程式:___________ 。
(3)实验室模拟蒸氨装置如图所示。蒸氨时控制温度为95℃左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。___________ (填字母)。
A.液面上方但不接触液面 B.略伸入液面下 C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是___________ (写出一种)。
③混合气体e可返回至“___________ ”阶段循环利用。
(4)研究发现Znx(OH)y(CO3)z热分解得到ZnO的过程可分为两步。
某实验小组取11.2 g Znx(OH)y(CO3)z固体进行热重分析,两步反应的固体失重率( ×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为
×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为___________ 。
②25℃时相关物质的Ksp如下表:
| 物质 | MnS | FeS | ZnS | PbS | CdS | CuS |
| Ksp | 2.5×10-13 | 6.3×10-18 | 1.6×10-24 | 8.0×10-28 | 3.6×10-29 | 5.0×10-36 |
请回答下列问题:
(1)“氧化预处理”阶段得到的氧化产物有FeOOH、MnO2,写出生成FeOOH的离子方程式:
(2)若“氨浸”阶段溶解ZnO时消耗的n(NH3·H2O)∶n(NH4HCO3)=2∶1,写出该反应的离子方程式:
(3)实验室模拟蒸氨装置如图所示。蒸氨时控制温度为95℃左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。
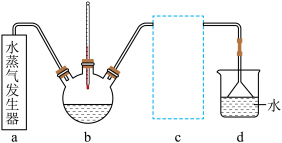
A.液面上方但不接触液面 B.略伸入液面下 C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是
③混合气体e可返回至“
(4)研究发现Znx(OH)y(CO3)z热分解得到ZnO的过程可分为两步。
某实验小组取11.2 g Znx(OH)y(CO3)z固体进行热重分析,两步反应的固体失重率(
 ×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为
×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为
您最近一年使用:0次
8 .  被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: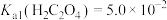 ,
,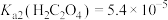 ,
, ;
;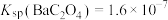 ,
,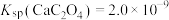 。
。
回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_____ 种。
(2)浸渣的主要成分为_____ 和_____ (填化学式),“浸出”步骤中 与
与 溶液反应的原理为
溶液反应的原理为_____ (用离子方程式表示)。
(3)若浸出液中 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为_____ 。
(4) 溶液显
溶液显_____ (填“酸”“碱”或“中”)性;“沉钛”步骤所得沉淀为 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是_____ (填化学式)。
(5)“热解”步骤的化学方程式为_____ 。
(6) 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。 ,则B点微粒的坐标为
,则B点微粒的坐标为_____ 。
②Ti在晶胞中的位置为_____ ;晶胞中一个Ba周围与其最近的O的个数为_____ 。
 被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为
被誉为电子陶瓷工业的支柱。工业中以毒重石(主要成分为 ,含少量
,含少量 、
、 和
和 )为原料制备
)为原料制备 的流程如下:
的流程如下: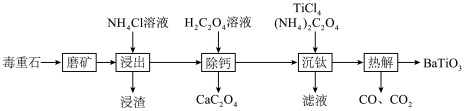
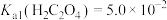 ,
,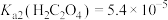 ,
, ;
;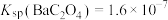 ,
,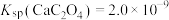 。
。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有
(2)浸渣的主要成分为
 与
与 溶液反应的原理为
溶液反应的原理为(3)若浸出液中
 ,
, ,“除钙”步骤中,当沉钙率为90%时,钡损率为
,“除钙”步骤中,当沉钙率为90%时,钡损率为(4)
 溶液显
溶液显 ,该步骤生成的能循环利用的物质是
,该步骤生成的能循环利用的物质是(5)“热解”步骤的化学方程式为
(6)
 在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。
在室温下为立方晶胞,其结构如图所示,已知Ba与O的最小间距大于Ti与O的最小间距。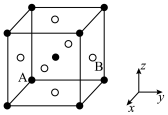
 ,则B点微粒的坐标为
,则B点微粒的坐标为②Ti在晶胞中的位置为
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
9 . 下列各实验的操作、现象及结论错误的是
| 选项 | 操作 | 现象 | 结论 |
| A | 分别测定等浓度Na2SO3、NaNO3溶液的pH | 前者pH大 | 非金属性:N>S |
| B | 取少量Na2SO3固体溶解,加入足量BaCl2溶液,产生白色沉淀;再加入足量稀盐酸 | 沉淀部分溶解 | Na2SO3固体部分被氧化 |
| C | 分别在石蕊溶液与品红溶液中通入适量SO2气体 | 石蕊溶液变红后没有褪色,品红溶液褪色 | SO2水溶液呈酸性,有漂白性 |
| D | 甲试管中加入KMnO4溶液,再滴入浓盐酸;乙试管中加入K2MnO4溶液和NaOH溶液,再通入氯气 | 甲试管中产生黄绿色气体,乙试管中溶液变为紫红色 | 物质氧化性的强弱与pH有关 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024高三·全国·专题练习
10 . 工业上利用黄铁矿(主要成分是FeS2)生产硫酸,同时得到烧渣(主要成分为Fe2O3、少量SiO2和Al2O3),为了“变废为宝”,通过下列生产流程可将烧渣转化为绿矾(FeSO4·7H2O)产品:
(1)滤渣能溶于NaOH,写出该反应的化学方程式:___________ 。
(2)检验“还原”是否完全的实验方法是___________ 。
(3)设计将“还原液”转化为绿矾晶体的实验操作:___________ 得绿矾晶体(在实验过程中须用试剂:FeCO3·H2O、乙醚)。
(4)检测所得绿矾(FeSO4·7H2O)产品的纯度,称取35.00g样品,配成250mL溶液,取25.00mL所配溶液放入锥形瓶中,然后滴加0.1000mol·L-1的酸性高锰酸钾溶液,至恰好完全反应时用去21.00mL。
①已知酸性高锰酸钾反应时有Mn2+生成,写出该反应的离子方程式:___________ 。
②计算该样品的纯度________ (写出计算过程)。

| 金属离子 | 开始沉淀的pH | 完全沉淀的pH | 沉淀开始溶解的pH | 沉淀完全溶解的pH |
| Fe2+ | 7.6 | 9.6 | / | / |
| Fe3+ | 2.7 | 3.7 | / | / |
| Al3+ | 4.0 | 5.2 | 7.8 | 10.8 |
(2)检验“还原”是否完全的实验方法是
(3)设计将“还原液”转化为绿矾晶体的实验操作:
(4)检测所得绿矾(FeSO4·7H2O)产品的纯度,称取35.00g样品,配成250mL溶液,取25.00mL所配溶液放入锥形瓶中,然后滴加0.1000mol·L-1的酸性高锰酸钾溶液,至恰好完全反应时用去21.00mL。
①已知酸性高锰酸钾反应时有Mn2+生成,写出该反应的离子方程式:
②计算该样品的纯度
您最近一年使用:0次



