1 . 氨基甲酸铵(H2NCOONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用如下方法制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0
(1)实验室通常采用图1装置制取氨气,你所选择的试剂是__________________ 。
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
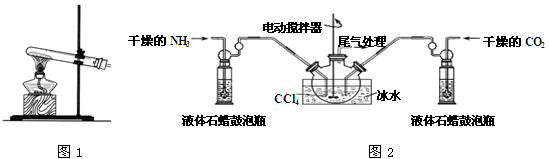
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是___________________________________________ 。
液体石蜡鼓泡瓶的作用是_______________________________________________ 。
②从反应后的混合物中分离出产品的实验方法___________ (填操作名称)。为了得到干燥产品,应采取的方法是________ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
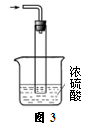
③尾气处理装置如图3所示。能否将浓H2SO4改为稀H2SO4_______ (填“能”或“否”),理由是___________________________ 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000 g。则样品中氨基甲酸铵的质量分数为_______ 。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
2NH3(g)+CO2(g)
 H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0(1)实验室通常采用图1装置制取氨气,你所选择的试剂是
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。

注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是
液体石蜡鼓泡瓶的作用是
②从反应后的混合物中分离出产品的实验方法
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图3所示。能否将浓H2SO4改为稀H2SO4

(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.570 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为2.000 g。则样品中氨基甲酸铵的质量分数为
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
您最近一年使用:0次
2 . 某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+。为减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图填空,完成回收硫酸亚铁和铜的简单实验方案(成分A、B、C、D既可能是纯净物也可能是混合物,且可相同)。

(1)用化学式填空:试剂1为_______ 、试剂2为_______ 。
(2)操作1、2是同一分离操作,需要用到的玻璃仪器有_______ 。
(3)写出加入试剂1后所发生的离子方程式:_______ ,_______ 。
(4)若取B中溶液2mL,然后滴入NaOH溶液,产生的现象是_______ ,所涉及到的方程式是_______ (如果是是离子反应必须书写离子方程式)
(5)已知FeSO4溶液在近100℃进行蒸发时,FeSO4会因温度过高而与空气中的氧反应导致变质,而溶液沸点随压强减小而下降。为了得到未变质的FeSO4•7H2O固体,“操作3”应采取的操作为:_______ 。
(6)将FeSO4•7H2O 隔绝空气加强热,得到砖红色固体,并放出有刺激性气味的气体,且产物均为化合物。写出反应的方程式:_______ 。

(1)用化学式填空:试剂1为
(2)操作1、2是同一分离操作,需要用到的玻璃仪器有
(3)写出加入试剂1后所发生的离子方程式:
(4)若取B中溶液2mL,然后滴入NaOH溶液,产生的现象是
(5)已知FeSO4溶液在近100℃进行蒸发时,FeSO4会因温度过高而与空气中的氧反应导致变质,而溶液沸点随压强减小而下降。为了得到未变质的FeSO4•7H2O固体,“操作3”应采取的操作为:
(6)将FeSO4•7H2O 隔绝空气加强热,得到砖红色固体,并放出有刺激性气味的气体,且产物均为化合物。写出反应的方程式:
您最近一年使用:0次
3 . 硫酰氯(SO2Cl2)是一种重要的有机氯化剂,可用于制造医药品、农药和染料等。某化学学习小组用干燥的 和
和 在活性炭催化下制取硫酰氯,反应的化学方程式为:
在活性炭催化下制取硫酰氯,反应的化学方程式为: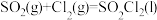 ,该反应为放热反应,装置如图所示(部分夹持装置省略)。
,该反应为放热反应,装置如图所示(部分夹持装置省略)。

已知:硫酰氯通常条件下为无色液体,熔点-54.1℃,沸点为69.1℃,遇水能发生剧烈反应,并产生白雾;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
(1)仪器A的名称为_______ ,仪器B中冷凝水入口为_______ 。(填“a”或“b”)。
(2)C中盛放的药品是_______ ,其作用为_______ 。
(3)用浓盐酸和高锰酸钾反应可以制备氯气,写出相关离子方程式_______ 。
(4)若缺少装置乙和丁,对产品硫酰氯会有何影响 ,请用化学方程式表示_______ 。
(5)反应过程中,为防止 分解,可采取的措施有
分解,可采取的措施有_______ 。(至少写一条)
(6)该化学小组成员经过实验测得产物量较少,猜测可能是原料中亚硫酸钠部分变质,为了验证亚硫酸钠发生了变质,可设计如下实验:取少量亚硫酸钠原料加水溶解,_______ 。
 和
和 在活性炭催化下制取硫酰氯,反应的化学方程式为:
在活性炭催化下制取硫酰氯,反应的化学方程式为: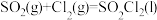 ,该反应为放热反应,装置如图所示(部分夹持装置省略)。
,该反应为放热反应,装置如图所示(部分夹持装置省略)。
已知:硫酰氯通常条件下为无色液体,熔点-54.1℃,沸点为69.1℃,遇水能发生剧烈反应,并产生白雾;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
(1)仪器A的名称为
(2)C中盛放的药品是
(3)用浓盐酸和高锰酸钾反应可以制备氯气,写出相关离子方程式
(4)若缺少装置乙和丁,
(5)反应过程中,为防止
 分解,可采取的措施有
分解,可采取的措施有(6)该化学小组成员经过实验测得产物量较少,猜测可能是原料中亚硫酸钠部分变质,为了验证亚硫酸钠发生了变质,可设计如下实验:取少量亚硫酸钠原料加水溶解,
您最近一年使用:0次
4 . 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室利用反应Cr2O3(s)+3CCl4 2CrCl3+3COCl2(g)制取CrCl3,其实验装置如下图所示。
2CrCl3+3COCl2(g)制取CrCl3,其实验装置如下图所示。

已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2将Cr3+氧化为CrO ;酸性条件下,H2O2将Cr2O
;酸性条件下,H2O2将Cr2O 还原为Cr3+。
还原为Cr3+。
回答下列问题:
(1)A中的试剂为___________ ;无水CaCl2的作用是___________ ;反应结束后继续通入一段时间氮气,主要目的是___________ 。
(2)装置E用来收集产物,实验过程中若D处出现堵塞,可通过___________ (填操作),使实验能继续进行。
(3)装置G中发生反应的离子方程式为___________ 。
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为CrO ,继续加热一段时间;
,继续加热一段时间;
Ⅱ.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使CrO 转化为Cr2O
转化为Cr2O ;
;
Ⅲ.用新配制的cmol·L−1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。
①产品中CrCl3的质量分数表达式为___________ (写出含m、c、V的表达式)。
②下列操作将导致产品中CrCl3质量分数测定值偏低的是___________ (填标号)。
a.步骤Ⅰ中未继续加热一段时间
b.步骤II用盐酸替代硫酸
c.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
d.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
 2CrCl3+3COCl2(g)制取CrCl3,其实验装置如下图所示。
2CrCl3+3COCl2(g)制取CrCl3,其实验装置如下图所示。
已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2将Cr3+氧化为CrO
 ;酸性条件下,H2O2将Cr2O
;酸性条件下,H2O2将Cr2O 还原为Cr3+。
还原为Cr3+。回答下列问题:
(1)A中的试剂为
(2)装置E用来收集产物,实验过程中若D处出现堵塞,可通过
(3)装置G中发生反应的离子方程式为
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为CrO
 ,继续加热一段时间;
,继续加热一段时间;Ⅱ.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使CrO
 转化为Cr2O
转化为Cr2O ;
;Ⅲ.用新配制的cmol·L−1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O
 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。①产品中CrCl3的质量分数表达式为
②下列操作将导致产品中CrCl3质量分数测定值偏低的是
a.步骤Ⅰ中未继续加热一段时间
b.步骤II用盐酸替代硫酸
c.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
d.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
解题方法
5 . 某实验小组设计一体化实验,通过量气法测定阿伏加德罗常数,同时制得 并探究其性质.回答下列问题:
并探究其性质.回答下列问题:
I.测定阿伏加德罗常数同时制得 .实验装置如图所示:
.实验装置如图所示:___________ ,阴极发生的电极反应式是___________ ;
(2)烧杯中最终会看到___________ 色沉淀;
(3)在一定电流强度下电解一段时间,收集到的气体体积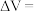
___________  (用含
(用含 的式子表示).将
的式子表示).将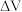 换算成标准状况下的体积记为
换算成标准状况下的体积记为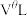 ,已知电路中通过的总电量为
,已知电路中通过的总电量为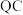 ,1个电子所带的电量为
,1个电子所带的电量为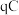 ,则阿伏伽德罗常数
,则阿伏伽德罗常数
___________ (用含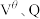 和q的表达式表示)。
和q的表达式表示)。
Ⅱ.探究 的性质.实验小组将上述电解得到的产物
的性质.实验小组将上述电解得到的产物 洗涤干净后,进行如下实验:
洗涤干净后,进行如下实验: 白色,
白色,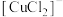 无色,
无色, 黄色.
黄色.
(4)检验电解产物 洗净需要用到的试剂是
洗净需要用到的试剂是___________ ;
(5)解释溶液颜色由无色变为黄色的原因___________ (用离子方程式表示);
Ⅲ.测量电解产物 的含量。
的含量。
(6)称取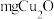 样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性
样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性 溶液,使
溶液,使 全部转化为
全部转化为 ,加入过量
,加入过量 溶液,然后用
溶液,然后用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 .(己知:
.(己知: )
)
则测得电解产物中 的含量为
的含量为___________  。
。
 并探究其性质.回答下列问题:
并探究其性质.回答下列问题:I.测定阿伏加德罗常数同时制得
 .实验装置如图所示:
.实验装置如图所示:
(2)烧杯中最终会看到
(3)在一定电流强度下电解一段时间,收集到的气体体积
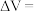
 (用含
(用含 的式子表示).将
的式子表示).将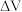 换算成标准状况下的体积记为
换算成标准状况下的体积记为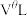 ,已知电路中通过的总电量为
,已知电路中通过的总电量为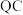 ,1个电子所带的电量为
,1个电子所带的电量为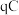 ,则阿伏伽德罗常数
,则阿伏伽德罗常数
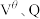 和q的表达式表示)。
和q的表达式表示)。Ⅱ.探究
 的性质.实验小组将上述电解得到的产物
的性质.实验小组将上述电解得到的产物 洗涤干净后,进行如下实验:
洗涤干净后,进行如下实验: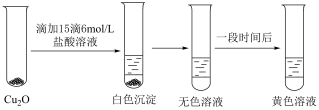
 白色,
白色,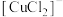 无色,
无色, 黄色.
黄色.(4)检验电解产物
 洗净需要用到的试剂是
洗净需要用到的试剂是(5)解释溶液颜色由无色变为黄色的原因
Ⅲ.测量电解产物
 的含量。
的含量。(6)称取
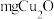 样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性
样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性 溶液,使
溶液,使 全部转化为
全部转化为 ,加入过量
,加入过量 溶液,然后用
溶液,然后用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 .(己知:
.(己知: )
)则测得电解产物中
 的含量为
的含量为 。
。
您最近一年使用:0次
名校
6 . 锑(Sb)及其化合物广泛用于化工生产。以粗锑氧为原料制备Sb和 的工艺流程如图所示。
的工艺流程如图所示。
Ⅰ.粗锑氧主要成分为 ,含有PbO、
,含有PbO、 、
、 、ZnO、FeO等杂质;
、ZnO、FeO等杂质;
Ⅱ.浸出液主要含 、
、 和
和 ,还含有
,还含有 、
、 、
、 和
和 等杂质;
等杂质;
Ⅲ. 为两性氧化物;
为两性氧化物;
Ⅳ.25℃时, 、
、
回答下列问题:
(1)已知 在熔融状态下不导电,则
在熔融状态下不导电,则 是
是________ 化合物(填“共价”或“离子”)。
(2)“还原”是用锑粉还原高价金属离子。其中Sb将 转化为
转化为 ,该转化有利于“水解”时锑与铁的分离,避免在滤渣Ⅱ中混入杂质
,该转化有利于“水解”时锑与铁的分离,避免在滤渣Ⅱ中混入杂质_________ (填化学式)。
(3)“过滤”得到滤渣成分SbOCl,加过量氨水对其“除氯”的化学反应方程式为___________ ,“除氯”步骤能否用NaOH溶液代替氨水,原因是:____________________ 。
(4)“除砷”时有 生成,该反应的离子方程式为
生成,该反应的离子方程式为_____________________ 。
(5)“电解”过程中单位时间内锑的产率与电压大小关系如图所示。当电压在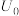 V之前时,阴极主要的电极反应式
V之前时,阴极主要的电极反应式__________ ,当电压超过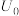 V时,单位时间内产率降低的原因可能是
V时,单位时间内产率降低的原因可能是______________ 。 的纯度,操作方法为:称取0.30g样品溶于稀硫酸中,用0.2000mol/L的硫酸铈
的纯度,操作方法为:称取0.30g样品溶于稀硫酸中,用0.2000mol/L的硫酸铈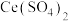 滴定,使用邻二氮菲-亚铁指示剂,发生反应:
滴定,使用邻二氮菲-亚铁指示剂,发生反应: ,重复3次实验平均消耗标准溶液15.60mL,则产物的纯度为
,重复3次实验平均消耗标准溶液15.60mL,则产物的纯度为________ %。
 的工艺流程如图所示。
的工艺流程如图所示。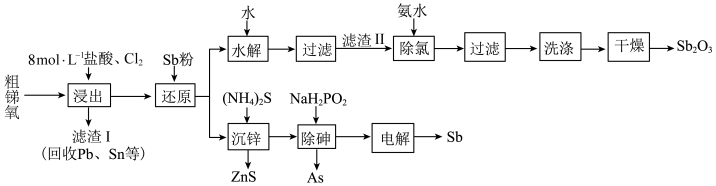
Ⅰ.粗锑氧主要成分为
 ,含有PbO、
,含有PbO、 、
、 、ZnO、FeO等杂质;
、ZnO、FeO等杂质;Ⅱ.浸出液主要含
 、
、 和
和 ,还含有
,还含有 、
、 、
、 和
和 等杂质;
等杂质;Ⅲ.
 为两性氧化物;
为两性氧化物;Ⅳ.25℃时,
 、
、
回答下列问题:
(1)已知
 在熔融状态下不导电,则
在熔融状态下不导电,则 是
是(2)“还原”是用锑粉还原高价金属离子。其中Sb将
 转化为
转化为 ,该转化有利于“水解”时锑与铁的分离,避免在滤渣Ⅱ中混入杂质
,该转化有利于“水解”时锑与铁的分离,避免在滤渣Ⅱ中混入杂质(3)“过滤”得到滤渣成分SbOCl,加过量氨水对其“除氯”的化学反应方程式为
(4)“除砷”时有
 生成,该反应的离子方程式为
生成,该反应的离子方程式为(5)“电解”过程中单位时间内锑的产率与电压大小关系如图所示。当电压在
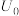 V之前时,阴极主要的电极反应式
V之前时,阴极主要的电极反应式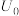 V时,单位时间内产率降低的原因可能是
V时,单位时间内产率降低的原因可能是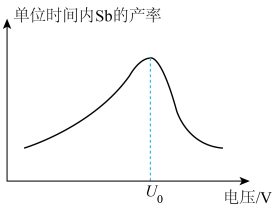
 的纯度,操作方法为:称取0.30g样品溶于稀硫酸中,用0.2000mol/L的硫酸铈
的纯度,操作方法为:称取0.30g样品溶于稀硫酸中,用0.2000mol/L的硫酸铈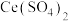 滴定,使用邻二氮菲-亚铁指示剂,发生反应:
滴定,使用邻二氮菲-亚铁指示剂,发生反应: ,重复3次实验平均消耗标准溶液15.60mL,则产物的纯度为
,重复3次实验平均消耗标准溶液15.60mL,则产物的纯度为
您最近一年使用:0次
解题方法
7 . 三水合硝酸铜[Cu(NO3)2·3H2O,M=242g/mol]是一种重要的无机试剂,用途广泛。
回答下列问题:
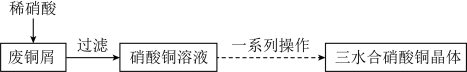
Ⅰ.三水合硝酸铜[Cu(NO3)2·3H2O]的制备。_______ 。
(2)由硝酸铜溶液获得三水合硝酸铜晶体过程中的一系列操作包括_______ 、过滤、洗涤、干燥。在洗涤操作中用乙醇洗涤的原因是_______ 。
(3)某工厂在用稀硝酸溶解废铜屑制备Cu(NO3)2·3H2O时,为避免NOx的生成,工程师提出还应加入H2O2溶液,反应的化学方程式为_______ ,当消耗含铜元素80%的废铜屑240kg时,得到653.4kg产品,产率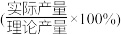 为
为_______ 。
Ⅱ.三水合硝酸铜[Cu(NO3)2·3H2O]的热分解实验。
(4)将24.2gCu(NO3)2·3H2O样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为_______ ,继续升温至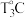 时生成的固体产物为
时生成的固体产物为_______ (填化学式)。
回答下列问题:
Ⅰ.三水合硝酸铜[Cu(NO3)2·3H2O]的制备。
(2)由硝酸铜溶液获得三水合硝酸铜晶体过程中的一系列操作包括
(3)某工厂在用稀硝酸溶解废铜屑制备Cu(NO3)2·3H2O时,为避免NOx的生成,工程师提出还应加入H2O2溶液,反应的化学方程式为
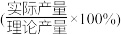 为
为Ⅱ.三水合硝酸铜[Cu(NO3)2·3H2O]的热分解实验。
(4)将24.2gCu(NO3)2·3H2O样品置于瓷坩埚中缓慢加热,其热重曲线(样品质量随温度变化的曲线)如图所示。在
 过程中有红棕色气体产生,反应的化学方程式为
过程中有红棕色气体产生,反应的化学方程式为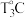 时生成的固体产物为
时生成的固体产物为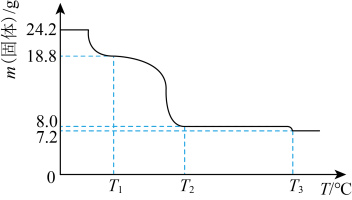
您最近一年使用:0次
名校
解题方法
8 . 铅的单质、氧化物、盐在现代工业中有着重要用途。以废旧铅酸电池中的含铅废料和H2SO4为原料,可以制备高纯PbO,从而实现铅的再生利用。在反应过程中Fe2+作催化剂,Pb和PbO2转化成PbSO4,发生的反应化学方程式为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
(1)在此过程中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++SO =2Fe3++PbSO4+2H2O
=2Fe3++PbSO4+2H2O
ii:……
写出反应ii的离子方程式:________ 。
(2)下列实验方案可证实上述Fe2+催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.________ 。
(3)草酸铅【PbC2O4受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用如图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A________ (填装置字母代号),证明产物中有CO气体的实验现象是________ 。
(4)实验室用滴定的方法来测定草酸铅样品纯度:称取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000mol/L的EDTA(Na2H2Y,弱酸酸式盐,强电解质)标准溶液滴定其中的Pb2+,滴定过程中杂质不与EDTA反应,而且滴定完成后溶液的酸性明显增强,则离子反应方程式为_______ ,平行滴定三次,平均消耗EDTA标准溶液14.52mL。
①若滴定管未用EDTA标准液润洗,测定结果将________ (填“偏高”“偏低”或“不变”)。
②草酸铅的纯度为________ (保留四位有效数字)。
 2PbSO4+2H2O
2PbSO4+2H2O(1)在此过程中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++SO
 =2Fe3++PbSO4+2H2O
=2Fe3++PbSO4+2H2Oii:……
写出反应ii的离子方程式:
(2)下列实验方案可证实上述Fe2+催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.
(3)草酸铅【PbC2O4受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用如图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A

(4)实验室用滴定的方法来测定草酸铅样品纯度:称取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000mol/L的EDTA(Na2H2Y,弱酸酸式盐,强电解质)标准溶液滴定其中的Pb2+,滴定过程中杂质不与EDTA反应,而且滴定完成后溶液的酸性明显增强,则离子反应方程式为
①若滴定管未用EDTA标准液润洗,测定结果将
②草酸铅的纯度为
您最近一年使用:0次
2024-02-29更新
|
73次组卷
|
2卷引用:湖北省武汉市新洲区第一中学2024届高二上学期期末联考化学试题
9 . 碱式碳酸铜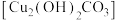 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
Ⅰ.配制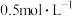 CuSO4溶液和
CuSO4溶液和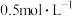 Na2CO3溶液各500 mL
Na2CO3溶液各500 mL
Ⅱ.探究CuSO4溶液和Na2CO3溶液的合适配比
取10 mL CuSO4溶液,按照不同的CuSO4和Na2CO3的物质的量之比进行混合,在合适温度的水浴锅中搅拌反应,沉淀生成的速率、颜色和质量如下表所示:
Ⅲ.探究反应的温度
取30 mL CuSO4溶液,选择合适配比的CuSO4和Na2CO3溶液混合均匀,分别放在不同温度的水浴锅中反应,沉淀生成的速率、颜色和质量如下表所示:
Ⅳ.碱式碳酸铜的制备
取60 mL CuSO4溶液,根据上面实验确定的反应物最合适比例及最适宜温度制取产物,待沉淀完全后减压过滤,洗涤,干燥。
回答下列问题
(1)步骤Ⅰ中,配制 CuSO4溶液时,不需要使用下列仪器中的
CuSO4溶液时,不需要使用下列仪器中的___________ (填仪器名称),还需要补充的玻璃仪器是___________ 。(填仪器名称)___________ ;反应产生“绿色沉淀”碱式碳酸铜的离子反应方程式为___________ 。
(3)步骤Ⅱ中产生蓝色沉淀的成分是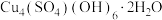 ,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是
,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是___________ 。
(4)步骤Ⅲ中反应的最适宜温度应为___________ ,“实验组⑧”中产物沉淀“绿色偏暗”的原因可能是___________ 。
(5)步骤Ⅳ中检验沉淀是否洗净的操作为___________ 。
(6)计算产品含铜量。称取0.5 g样品于100 mL小烧杯中,加入20 mL蒸馏水,再加入0.8 mL 6 mol/L的硫酸使其完全溶解,冷却至室温后,转移到250 mL容量瓶中,定容,摇匀。取20.00 mL上述配好的溶液与过量KI完全反应后,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜的质量分数为___________ (已知 ,
, )。
)。
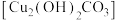 俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:
俗称铜绿,是一种不溶于水和乙醇的绿色固体,能用于催化剂、杀菌剂和电镀等行业。实验室制备碱式碳酸铜的步骤如下:Ⅰ.配制
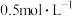 CuSO4溶液和
CuSO4溶液和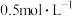 Na2CO3溶液各500 mL
Na2CO3溶液各500 mLⅡ.探究CuSO4溶液和Na2CO3溶液的合适配比
取10 mL CuSO4溶液,按照不同的CuSO4和Na2CO3的物质的量之比进行混合,在合适温度的水浴锅中搅拌反应,沉淀生成的速率、颜色和质量如下表所示:
| 实验组 | ① | ② | ③ | ④ |
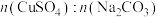 | 1:0.8 | 1:1 | 1:1.2 | 1:1.4 |
| 沉淀生成速率 | 最慢 | 较慢 | 快 | 很快 |
| 产物沉淀量/g | 0.501 | 0.428 | 0.549 | 0.527 |
| 沉淀颜色 | 蓝色 | 蓝色 | 绿色 | 绿色 |
取30 mL CuSO4溶液,选择合适配比的CuSO4和Na2CO3溶液混合均匀,分别放在不同温度的水浴锅中反应,沉淀生成的速率、颜色和质量如下表所示:
| 实验组 | ⑤ | ⑥ | ⑦ | ⑧ |
| 温度/℃ | 25 | 65 | 75 | 85 |
| 沉淀生成速率 | 最慢 | 较慢 | 快 | 很快 |
| 产物沉淀量/g | 无 | 1.303 | 1.451 | 1.28 |
| 沉淀颜色 | 蓝色 | 绿色 | 绿色 | 绿色(偏暗) |
取60 mL CuSO4溶液,根据上面实验确定的反应物最合适比例及最适宜温度制取产物,待沉淀完全后减压过滤,洗涤,干燥。
回答下列问题
(1)步骤Ⅰ中,配制
 CuSO4溶液时,不需要使用下列仪器中的
CuSO4溶液时,不需要使用下列仪器中的

(3)步骤Ⅱ中产生蓝色沉淀的成分是
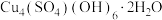 ,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是
,试从物质结构与性质的知识分析“实验组①”产生蓝色沉淀的原因是(4)步骤Ⅲ中反应的最适宜温度应为
(5)步骤Ⅳ中检验沉淀是否洗净的操作为
(6)计算产品含铜量。称取0.5 g样品于100 mL小烧杯中,加入20 mL蒸馏水,再加入0.8 mL 6 mol/L的硫酸使其完全溶解,冷却至室温后,转移到250 mL容量瓶中,定容,摇匀。取20.00 mL上述配好的溶液与过量KI完全反应后,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液V mL,则样品中铜的质量分数为
 ,
, )。
)。
您最近一年使用:0次
名校
10 . 一水硫酸四氨合铜 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
Ⅰ.制备少量晶体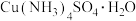 ,设计实验方案如下:
,设计实验方案如下:

(1)仪器A的名称为_____ ,对比铜和浓硫酸加热制备硫酸铜,该方案的优点是_____ 。
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是_____ 。
Ⅱ.氨含量的测定。精确称取 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10%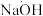 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用


 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
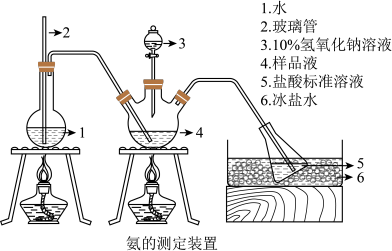
(3)“玻璃管2”的作用_____ ,样品中氨的质量分数的表达式_____ 。
Ⅲ.探究四氨合铜离子的性质
用所得晶体配成水溶液,取三份1 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
(4)上述实验现象与配位离子的解离平衡有关,请用适当的化学用语表示该配位离子的解离平衡_____ ,则加入氢氧化钠溶液后的现象为_____ 。
 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题Ⅰ.制备少量晶体
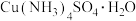 ,设计实验方案如下:
,设计实验方案如下:
(1)仪器A的名称为
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是
Ⅱ.氨含量的测定。精确称取
 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10%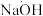 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用


 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
(3)“玻璃管2”的作用
Ⅲ.探究四氨合铜离子的性质
用所得晶体配成水溶液,取三份1
 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:| 加入试剂 | 水 | 稀硫酸 | 氢氧化钠 |
| 现象 | 几乎无变化 | 溶液颜色变成浅蓝色,与同浓度硫酸铜颜色相当 |
您最近一年使用:0次
2023-08-16更新
|
266次组卷
|
3卷引用:湖北省武汉部分重点高中2023-2024学年高三上学期8月联考化学试题
湖北省武汉部分重点高中2023-2024学年高三上学期8月联考化学试题江西省吉安市万安中学2023-2024学年高三上学期开学考试化学试题(已下线)化学(九省联考考后提升卷,广西卷)-2024年1月“九省联考”真题完全解读与考后提升



